茶皂素还原脱色法初探
2014-03-22,,*
,,*
(1.安徽师范大学环境科学与工程学院,安徽芜湖 241003;2.安徽农业大学教育部农业部茶叶生物化学与生物技术重点实验室,安徽合肥 230036)
茶籽油的生产过程中会产生大量的饼粕,其中含有皂素、蛋白质、多糖等可利用的成分[1]。茶皂素作为其中的一种重要成分,具有优良的表面活性[2],广泛应用于化学工业、日用化工、养殖业等[3-5]。然而目前广泛使用的主要是粗品茶皂素,其纯度较低,含有大量杂质,若使用膜分离、大孔树脂吸附、泡沫分离等方法进行纯化可以有效提高茶皂素纯度[1,6],但由于其中一些结构相似的黄酮类、多酚类杂质,即使高纯度茶皂素的水溶液颜色仍然较深,极大限制了茶皂素制品的使用范围。因此,茶皂素的脱色越来越引起学者的关注与研究。
目前,茶皂素的脱色主要有树脂层析法、氧化脱色法,这些方法都存在一定的缺陷。例如树脂层析法生产时间长,成本较高;而氧化脱色则使用双氧水、高氯酸等强氧化剂,在脱色时需要较为剧烈的反应条件,会对茶皂素的表面活性产生一定影响。其原因主要是强氧化剂对油茶皂苷的结构造成破坏,造成糖苷键断裂,从而影响产品的性能。为解决这一问题,本实验采用还原脱色方法对茶皂素溶液进行脱色实验,结果取得了很好的脱色效果。还原脱色法具有广泛的应用前景,为工业化生产应用提供了理论指导。
1 材料与方法
1.1 材料与仪器
茶皂素(90%纯度) 浙江东方茶业科技有限公司;香草醛、浓硫酸、硼氢化钾、亚硫酸氢钠等试剂 无锡展望化学试剂公司,均为分析纯;乙腈、乙酸 TEDIA公司,均为色谱纯。
Finnigan LCQ Advantage Max ion trap MS 美国Finnigan公司;BUCHI Mini Spray Dryer B-290喷雾干燥机 步琪实验设备贸易(上海)有限公司;CM-3500d色差计 日本Konica公司。
1.2 实验方法
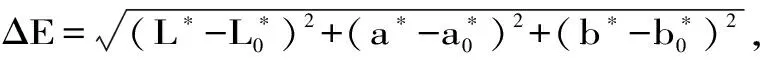
因脱色实验中溶液的颜色都是向着越来越浅的方向变化,因此可以通过考察ΔE值的大小来比较脱色效果的好坏。实验测定前均使用标准白度板和黑度板进行校准,以提高数据的准确性。
1.2.1 单因素实验 茶皂素溶液的浓度会显著影响脱色时脱色剂的使用量以及最终的脱色效果,因此实验均配制浓度为10%(w/v)的茶皂素水溶液。使用25℃恒温水浴维持反应温度,首先考察脱色剂的使用量对脱色效果的影响,确定亚硫酸氢钠的添加量为2.0%(与茶皂素的质量比,下同),通过改变硼氢化钾的加入量考察其对ΔE值的影响。随后均向溶液中加入1.0%硼氰化钾,考察不同亚硫酸氢钠加入量对脱色效果的影响。之后分别加入1.0%的硼氰化钾以及2.0%亚硫酸氢钠,调整反应温度考察温度的影响。最后其它条件不变,调整溶液pH,考察pH对脱色效果的影响。每组实验测定3次,具体实验参数见表1。
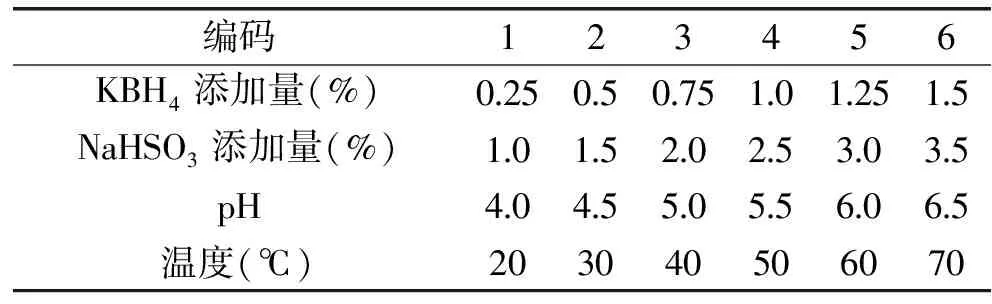
表1 单因素实验参数表Table 1 Single factor experimental design
1.2.2 二次响应面优化 将单因素确定的四个参数使用响应面法进一步优化。响应面优化实验编码见表2,所有实验数据均进行3次平行实验,所得数据使用SAS 9.1.3软件进行分析。
1.2.3 检测 脱色后的样品使用步琪B-290喷雾干燥器干燥,将获得的样品进行检测。喷雾干燥器进口温度140℃,出口温度90℃,泵速10%。
1.2.3.1 浓硫酸香草醛显色法 浓硫酸香草醛显色法参照文献[11]进行测定。
1.2.3.2 LC-MS/MS检测 使用Finnigan LCQ Advantage Max ion trap MS检测油茶皂苷,液相分离使用Agilent,TC-C18,25μm,250mm×4.6mm色谱柱。流动相A为0.1%乙酸-水,流动相B为0.1%乙酸-乙腈。使用梯度洗脱,流动相B在25min时间内从20%提高到80%,流速1.0mL/min,进样体积为10μL[12]。毛细管质谱仪使用阴离子检测方式(SIM)对样品进行检测。离子化喷雾器电压为4.5kV,毛细管和飘移管电压分别为-40V和-130V,毛细管温度为350℃[13]。
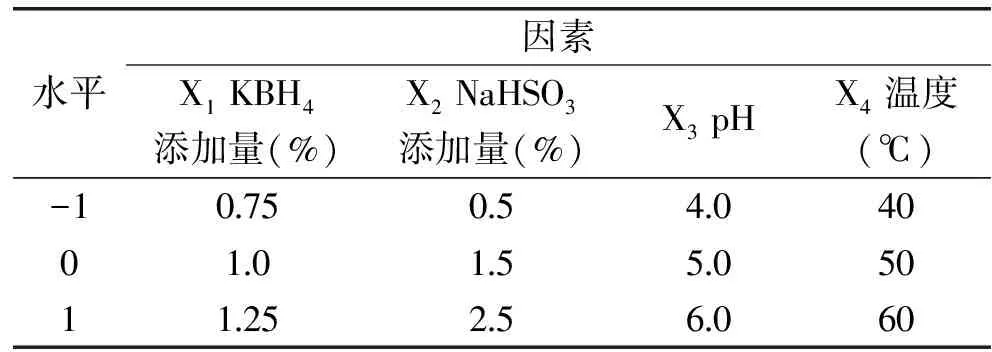
表2 响应面水平设计表Table 2 Coding of levels of the elements in these experiments
2 结果与分析
2.1 单因素实验结果
单因素实验结果见图1,从图中可以看出随着两种脱色剂加入量的逐渐增大,ΔE值有很大的提高,脱色效果非常明显,但表现出来的趋势却有明显差别。其中随着KBH4加入量的逐渐增大,ΔE值呈现先增加后减小的趋势,当KBH4的加入量为1.0%(w/w)时,脱色效果最佳,ΔE值为29.701±0.297。
另一种脱色剂NaHSO3对ΔE值的影响趋势则与KBH4有明显的不同,首先迅速增大,之后增速趋缓,而ΔE值增长幅度趋势的转变点的加入量为2.0%(w/w)。考虑到实际操作过程中成本的要求,因此后续实验均2.0%(w/w)NaHSO3添加量进行优化。
此外,从图中另外两条曲线的走势可以看出,pH和温度对于脱色效果的影响不大。随着pH的增大,脱色效果有小幅下降,而反应温度的升高则对脱色效果有小幅的提升,但这两个因素的影响都远不及两种脱色剂的使用效果。
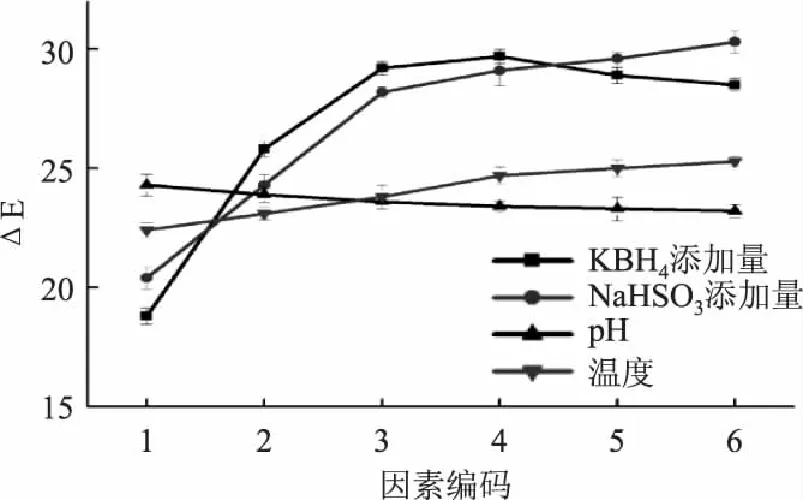
图1 脱色单因素实验 Fig.1 Effects of single factors on decolorization

表4 方差分析表Table 4 ANOVA analysis for the response surface modified
2.2 二次响应面优化
使用SAS 9.1.3分析软件对茶皂素还原脱色进行4因素3水平响应面设计与分析。共设计31组实验,其中7组为中心点重复实验,脱色结果见表3。软件对数据进行多元拟合,得到两种还原脱色剂脱色效果的回归方程如下:
ΔE=29.021+3.578X1+2.439X2-0.146X3+0.330X4-2.67X12+0.583X1X2-0.117X1X3-0.119X1X4-2.17X22-0.068X2X3+0.131X2X4-0.676X32+0.018X3X4-1.712X42

表3 响应面实验设计及色差测定结果Table 3 Response surface design matrix and result of ΔE
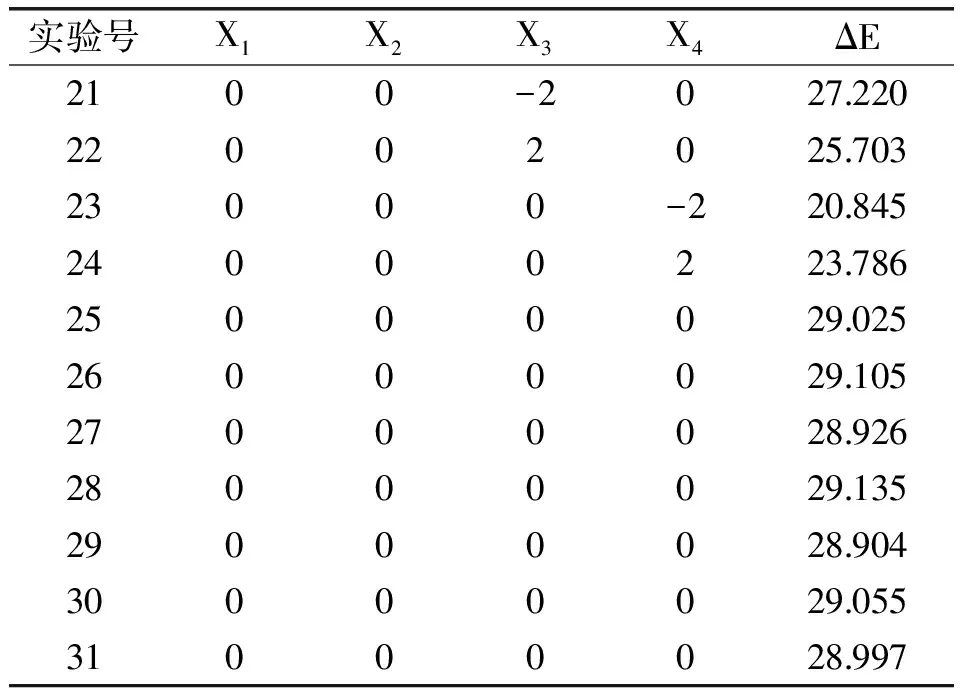
续表
表4为该模型的方差分析表,从表中可以看出模型显著性很高(p=0.0001),失拟项在α=0.01水平上不显著(p=0.1427>0.0633)。模型的决定系数R2为0.9981,校正决定系数为0.9777,说明该模型具有很好的拟合程度,对于整个脱色效果的拟合优化是非常合适的。脱色实验中KBH4与NaHSO3的添加量对脱色的效果影响为极显著(均为p=0.0001),而温度与pH则影响不大;在交互项中,仅有KBH4与NaHSO3的添加量之间有显著的影响(p=0.009198)。这说明,在整个脱色过程中起主要作用的是两种脱色剂的加入量以及加入比例。实验表明两种脱色剂的加入比例约为1∶2的时候能获得更好的脱色效果。两种脱色剂必须以一定比例进行反应,才能更好地生成中间产物,从而进行脱色作用,这与Gerrie的研究结果类似[14]。

图2 KBH4与NaHSO3交互作用响应面图 Fig.2 Response surfaces for ΔE as a function of KBH4 and NaHSO3
两种脱色剂中,KBH4可以电离出H-,而NaHSO3则可以电离出H+离子,这两种离子均会对溶液的pH产生影响,当然pH也会很大程度地影响这两种物质的电离以及反应。但从表4的数据可以看出,pH对脱色效果的影响不大,这主要是由于两种脱色剂进行脱色的时候并不是直接与色素反应,而是首先生成中间产物,通过具有高活性的中间产物与色素中的发色基团反应,达到脱色的效果[15],而这种中间产物对于溶液的pH并不敏感,因此表现在数据上为pH与两种脱色剂的交互作用不显著(X1X3:p=0.56108;X2X3:p=0.733004)。
2.3 验证实验
利用SAS软件进行分析和拟合的最终优化条件为X1=0.720,X2=0.664,X3=-0.203,X4=0.096,即KBH4、NaHSO3的添加量分别为1.180%(w/w)和2.164%(w/w),pH在4.797,脱色温度为50.96℃,此时ΔE值为31.150±0.304。
为验证模型预测的准确性,在KBH4、NaHSO3的添加量分别为1.2%(w/w)和2.2%(w/w),pH为4.8,脱色温度为51.0℃条件下进行3次实验,此时ΔE值为31.324±0.378,表明使用响应面法模拟的优化结果具有很高的可靠性和准确性。
2.4 检测
将茶皂素脱色溶液喷雾干燥得到粉末。与未脱色样品相比,脱色后的茶皂素颜色有了很大的改观,颜色由原先的土黄色变成乳白色。
2.4.1 浓硫酸香草醛检测 使用浓硫酸香草醛比色法进行检测,结果表明脱色后样品纯度为91.6%,与脱色前的91.8%相比没有明显变化。同时脱色后油茶皂苷的得率很高,为95.8%,具有很好的应用前景。
2.4.2 LC-MS/MS检测 鉴于氧化脱色法会对油茶皂苷的结构产生一定的影响,使用LC-MS/MS进行检测,考察还原脱色法是否同样会对油茶皂苷的结构造成破坏,结果见图3。图3中a为液相图,b为质谱离子流图,c为阴离子流图,d为m/z为1201的目标成分离子流图,e为目标成分的二级质谱图。从a、b、c、d图中可以看出,液相保留时间为15.97min时质谱图上出现m/z为1201的目标成分峰,而e图的二级质谱图上则显示m/z为1021、889两个峰,分别为失去一个己糖基和一个戊糖基的皂苷结构。结合以上几张图谱可以判断,保留时间为15.94min的成分为油茶皂苷B2[16],说明经过脱色以后,油茶皂苷的结构没有发生改变。

图3 脱色后油茶皂苷LC-MS/MS检测 Fig.3 LC-MS/MS chromatogram of sasanquasaponin after blanching
3 结论
本实验通过使用还原剂的方法对茶皂素进行脱色取得了很好的脱色效果。通过响应面优化得出最优条件为:KBH4、NaHSO3的添加量分别为1.2%(w/w)和2.2%(w/w),pH在4.8,脱色温度为51.0℃,此时ΔE值为31.324±0.378。脱色后的茶皂素纯度为91.6%,得率为95.8%。通过LC-MS/MS进行检测,结果表明还原脱色法对油茶皂苷的结构没有影响,脱色后仍然保持了原有的结构和特性,具有广泛的生产应用前景。
[1]Yan J,Wu Z L,Zhao Y L,etal. Separation of tea saponin by two-stage foam fractionation[J]. Separation and Purification Technology,2011,80(2):300-305.
[2]柳荣祥,朱全芬,夏春华. 茶皂素生物活性应用研究进展及发展趋势[J]. 茶叶科学,1996,16(2):81-86.
[3]Wina E,Muetzel S,Becker K. The impact of saponins or saponin-containing plant materials on ruminant production-a review[J]. J Agri Food Chem,2005,53(21):8093-8105.
[4]Xia H L,Chi X Y,Yan Z J,etal. Enhancing plant uptake of polychlorinated biphenyls and cadmium using tea saponin[J]. Bioresource Technology,2009,100(20):4649-4653.
[5]Mao H L,Wang J K,Zhou Y Y,etal. Effects of addition of tea saponins and soybean oil on methane production,fermentation and microbial population in the rumen of growing lambs[J]. Livestock Science,2010,129(1):56-62.
[6]Yavich P A. Sorption of saponins on ion-exchange resins[J]. Chem Nat Compd,1983,19(1):52-55.
[7]孙冀平,裘爱泳,胡学烟. 茶皂素的脱色研究[J]. 中国油脂,2003,28(4):42-45.
[8]钟海雁,王承南,谢碧霞,等. 茶油色泽测定及脱色工艺的研究[J]. 中南林学院学报,2000,20(4):25-29.
[9]Yong K Cho,Hye K. Purification and characterization of Polyphenol oxidase from potato:I.purification and properties[J].Journal of Food Biochemistry,2007,23( 6):577-592.
[10]王晋海,窦明. 颜色管理的标准化[J]. 现代涂料与涂装,2005( 2):50-54.
[11]赵静娟,杜先锋. 陶瓷膜纯化油茶皂苷的工艺研究[J]. 中国粮油学报,2009,24(7):89-92.
[12]Burnouf-Radosevich M,Delfel N E. High-performance liquid chromatography of triterpene saponins[J]. Journal of Chromatography,1986,368(2):433-438.
[13]Kim J A,Kim Y S,Choi Y E. Triterpenoid production and phenotypic changes in hairy roots of Codonopsis lanceolata and the plants regenerated from them[J]. Plant Biotechnol Rep,2011,5(3):255-263.
[14]Gerrie J W. Groundwood brightening with Borol[J]. Pulp Pap. Mag. Can,1974,75:251-254.
[5]丁艳华,李海燕,杨俊,等. 活性艳红水溶液的光助还原脱色反应机理研究[J]. 环境科学与技术,2009,32(12):31-34.
[6]Yoshikawa M,Harada E,Murakami T,etal. Camelliasaponins B1,B2,C1 and C2,new type inhibitors of ethanol absorption in rats from the seeds of Camellia japonica L[J]. Chem Pharm Bull,1994,42(3):742-744.
