产α-葡萄糖苷酶抑制剂菌株筛选 及固态发酵条件优化
2014-03-22,,,*,,
,,,*, ,
(1.北京市食品添加剂工程技术研究中心(北京工商大学),北京 100048;2.北京市食品风味化学重点实验室,北京 100048;3.中粮营养健康研究院,北京 100020; 4.山东龙力生物科技股份有限公司,山东禹城 251022)
α-葡萄糖苷酶抑制剂(α-glucosidase inhibitor,AGI)作为一种强的餐后血糖抑制剂,对II型糖尿病的预防表现出良好的生物活性[1]。其化学结构通常与单糖或寡糖的结构类似,通过竞争性抑制方式来抑制碳水化合物水解酶的活性。此外,α-葡萄糖苷酶抑制剂还能抑制蛋白及脂类糖基化[2],具有抗癌、抗HIV病毒、抗鼠白血病病毒、抗动脉粥样硬化等作用[1,3]。随着人们对α-葡萄糖苷酶抑制剂的认识不断深入,一些含α-葡萄糖苷酶抑制剂的食品已被研究者及糖尿病消费者所认可,在饮食疗法基础上配合运动治疗、药物治疗等整体治疗方案,有利于减少糖尿病发病率及死亡率[4-5]。然而目前能够用于辅助治疗糖尿病的特殊功能食品种类十分有限,难以满足急剧增长的糖尿病患者(2011年全世界糖尿病患者约3.66亿,我国已有9000多万)庞大的需求。因此开发新型、价廉、有效的能够预防或治疗糖尿病的功能性食品具有重要意义,其中含α-葡萄糖苷酶抑制剂的食品研究开发是一个重要的方向。
豆渣是大豆加工产品如豆奶或豆腐加工过程中的副产品,中国、阿根廷、巴西、美国、日本等国家每年豆渣的产量很大[6-9]。豆渣中含有多种功能性成分,如膳食纤维、大豆蛋白、多糖、异黄酮、皂甙等,具有丰富的营养价值[10]。但由于豆渣含水量较高、保质期短,这使得豆渣的利用受到一定的限制,大部分豆渣作为动物饲料直接喂养动物或者焚烧掉或者作为废弃物堆放,不做任何利用,这造成了豆渣资源的极大浪费[11]。以鲜豆渣为原料,通过固体发酵的方式酿造具有功能特性的发酵豆渣,如具有α-葡萄糖苷酶抑制活性的功能性豆渣,不仅能提高豆渣的利用价值,而且能为糖尿病患者功能性食品的研究奠定基础。
本研究从市售发酵豆制品中筛选得到产α-葡萄糖苷酶抑制剂的菌株,并以其为发酵初始菌株固态发酵鲜豆渣,通过单因素实验和正交实验研究考察影响发酵豆渣α-葡萄糖苷酶抑制活性的因素,并对发酵豆渣中α-葡萄糖苷酶抑制剂的稳定性进行研究。
1 材料与方法
1.1 材料与仪器
豆豉、腐乳、霉豆渣 均购买于全国各地不同地区的超市、农贸市场;大豆(小粒6号,2009年7月收获) 吉林省农科院,挑选颗粒饱满、无虫害的大豆,所用大豆品种有:小粒6号,中黄13号,郑90007,东农44号,中豆8号,中黄20号,豫豆25号,妥农14号,使用自来水清洗干净,使用纯净水按1∶3的比例室温浸泡8h,待大豆内部没有干心后,再加入5倍于原来质量的纯净水,磨浆后取渣,现做现用(水份含量85%,粗蛋白含量3.65%,粗脂肪含量1.37%,粗纤维含量9.22%,其它物质含量0.76%);α-葡萄糖苷酶(Rat intestinal acetone powders)、4-硝基苯-α-D-吡喃葡萄糖苷(4-nitrophenyl α-D-glucopyranoside,4-NPG) Sigma;其它化学试剂 均为分析纯;LB培养基 胰蛋白胨10g/L,酵母提取物5g/L,NaCl 10g/L,琼脂15g/L,蒸馏水配制,调pH7.2,121℃蒸汽灭菌20min;液体种子培养基 胰蛋白胨10g/L,酵母提取物5g/L,NaCl 10g/L,蒸馏水配制,调pH7.2,121℃蒸汽灭菌20min。
Model 550酶标仪 BIO-RAD Lab;T25BS4型均质机 IKALabortechnik。
1.2 实验方法
1.2.1 α-葡萄糖苷酶抑制活性的测定 在96孔酶标板上,经过稀释的样品中加入50μL α-葡萄糖苷酶溶液(25mg/mL),50μL 4-PNPG(0.9133mg/mL)及120μL 0.5mol/L的磷酸缓冲液(pH 6.7)。混匀后在37℃的培养箱中反应45min。加入50μL碳酸钠溶液(0.67mol/L)终止反应,在405nm下用酶标仪测定吸光度值。样品以相同体积的缓冲液代替所得的吸光度值作为对照。
α-葡萄糖苷酶抑制率(%)=(A对-A样)/A对×100
式中,A对:未加样品孔的吸光度值,A样:加样品孔的吸光度值。
测定冷冻干燥的发酵豆渣样品α-葡萄糖苷酶抑制活性需要对样品进行预处理。称取1.0g(m0)冻干粉置于20mL蒸馏水中,冰水浴均质(15000r/min,2min)。
1.2.2 菌株的筛选
1.2.2.1 菌种的初筛 以从全国收集的45份发酵豆制品样品为菌株来源,在无菌操作台中,取材料(豆豉、腐乳)1g于灭菌试管中,加晾凉后的无菌水10mL,用棉塞封口,震荡2min,稍静置后吸取上清液1mL,稀释10-1、10-2、10-3、10-4、10-5、10-6次,分别取0.2mL涂布LB平板。37℃培养24h观察结果,挑选在LB培养基上的单菌落,经划线分纯后分别编号。
1.2.2.2 菌种的复筛 分别从初筛菌株平板上取一环菌,接入新鲜液体种子培养基中,37℃摇床培养24h后,测定培养液的α-葡萄糖苷酶抑制活性。
通过菌株初筛复筛得到9株细菌,分别编号为菌株1、2、3、4、5、6、7、8、9。
1.2.3 固态发酵条件的优化
1.2.3.1 接种量对α-葡萄糖苷酶抑制活性的影响 称取含水量约80%的鲜豆渣(小粒6号),盛放于蒸笼中,在高压锅121℃灭菌20min。豆渣于无菌操作台晾凉后,自然pH条件下分别按0%、1%、2%、3%、4%(w:w)的比例接种,于恒温恒湿培养箱(37℃,RH 90%)中培养。发酵48h后取样冷冻干燥备用。
1.2.3.2 pH对α-葡萄糖苷酶抑制活性的影响 称取含水量约80%的鲜豆渣(小粒6号),盛放于蒸笼中,在高压锅121℃灭菌20min。豆渣于无菌操作台晾凉后,调节pH分别为6.65、6.9、8.15、9.5,分别按2%(w:w)的比例接种,于恒温恒湿培养箱(37℃,RH 90%)中培养。48h后取样并冻干,然后测定其α-葡萄糖苷酶抑制率。
1.2.3.3 含水量对α-葡萄糖苷酶抑制活性的影响 鲜豆渣(小粒6号)在50℃下烘干,加入适量的蒸馏水,使得最终豆渣含水量分别为50%,60%,70%,80%,90%,在高压锅121℃灭菌20min。分别按2%(w:w)的比例接种,于恒温恒湿培养箱(37℃,RH 90%)中培养。48h后取样冷冻干燥备用。
1.2.3.4 豆渣原料品种对α-葡萄糖苷酶抑制活性的影响 分别挑选8种不同品种的大豆,清洗干净、浸泡、磨浆后取渣,分别盛放于蒸笼中,在高压锅121℃灭菌20min 。豆渣于无菌操作台晾凉后,2%(w:w)的比例接种,于恒温恒湿培养箱(37℃,RH 90%)中培养。发酵48h后冷冻干燥备用。
1.2.3.5 发酵温度对α-葡萄糖苷酶抑制活性的影响 称取含水量约80%的鲜豆渣(小粒6号),盛放于蒸笼中,在高压锅121℃灭菌20min。豆渣于无菌操作台晾凉后,2%(w:w)的比例接种,采用不同温度20、25、30、35、40、45、50℃对菌株固态发酵培养,培养48h后样品冷冻干燥备用。
1.2.3.6 发酵时间对发酵豆渣α-葡萄糖苷酶抑制活性的影响 取鲜豆渣(小粒6号)200g(含水量80%),盛放于蒸笼中,在高压锅121℃灭菌20min 。豆渣于无菌操作台晾凉后,按2%(w:w)的比例接种,于恒温恒湿培养箱(37℃,RH 90%)中培养。分别在0、8、16、24、32、40、48、56、80h时取样。冻干干燥备用。
2 结果与讨论
2.1 葡萄糖苷酶产生菌株的筛选
论文作者前期研究过程中曾从食品中筛选到一株枯草芽孢杆菌B2,并对其产α-葡萄糖苷酶的抑制剂的能力展开了深入研究,并取得了一些正面的结果[12-13]。本研究在此基础上,进一步筛选能产α-葡萄糖苷酶的抑制剂的微生物菌株,以期获得新的产α-葡萄糖苷酶的抑制剂的菌株。从具有较强α-葡萄糖苷酶抑制活性的豆豉、豆酱及霉豆渣中初筛分离出45株细菌,经摇瓶发酵得到9株抑制活性在10%以上的菌株,结果如图1所示。其中,菌株4和菌株5的抑制活性最强,达到50%,从形态上初步判定菌株4和菌株5为同一株菌,通过菌落形态及显微镜观察发现该菌株与枯草芽孢杆菌B2有明显不同,选择菌株5作为进一步研究对象。
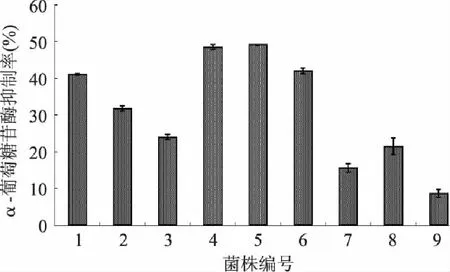
图1 不同菌种发酵液的α-葡萄糖苷酶的抑制活性 Fig.1 Inhibitory activity of fermented culture using different strains
2.2 固态发酵条件的优化
2.2.1 接种量对α-葡萄糖苷酶抑制活性的影响 接种量对菌株5发酵液α-葡萄糖苷酶抑制活性的影响如图2所示。当接种量大于2%时,发酵液的α-葡萄糖苷酶抑制活性稳定在50%以上,再增加接种量对抑制活性影响差别不大,当接种量为1%以下时,发酵液的抑制活性不高,在后续实验中将选择接种量2%。
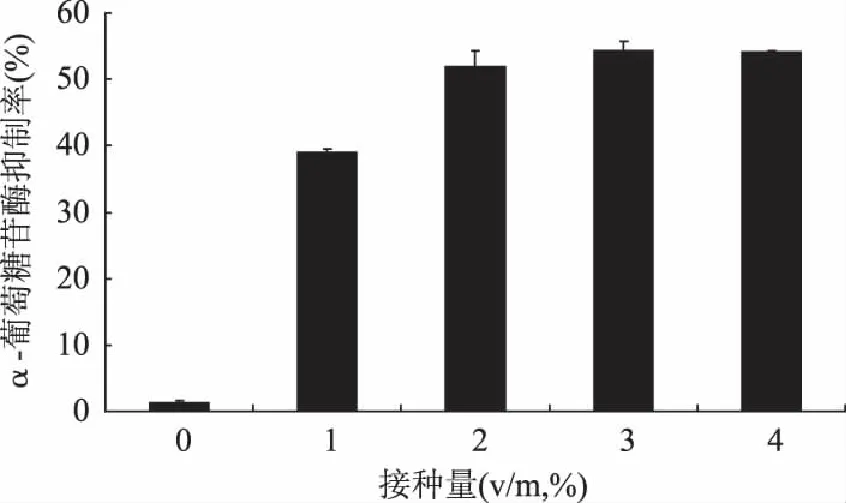
图2 接种量对α-葡萄糖苷酶抑制活性的影响 Fig.2 Effect of inoculation on the α-glucosidase inhibitory activity
2.2.2 初始pH对α-葡萄糖苷酶抑制活性的影响 由图3可见,培养基初始pH5时,菌株5发酵液的抑制活性仅为35%,抑制活性相对较低。当培养基初始pH6时,发酵液对α-葡萄糖苷酶活性达到45.7%。当初始pH7时,抑制活性最高达到56%。随着培养基初始pH进一步增加,发酵液抑制活性又逐渐下降,到pH10时,抑制活性为37.2%。培养基初始pH调节中性范围的时候,α-葡萄糖苷酶的抑制活性最高,偏酸性或偏碱性对α-葡萄糖苷酶的抑制活性有一定的影响,但影响程度较小。本文作者在研究液体发酵初始pH对枯草芽孢杆菌B2发酵液α-葡萄糖苷酶的抑制活性影响时发现,在酸性范围内时,pH的变化对抑制活性的影响显著,在pH5时,发酵液几乎没有α-葡萄糖苷酶的抑制活性[14],相比而言,固态发酵初始pH对α-葡萄糖苷酶的抑制活性影响不如液态发酵显著。
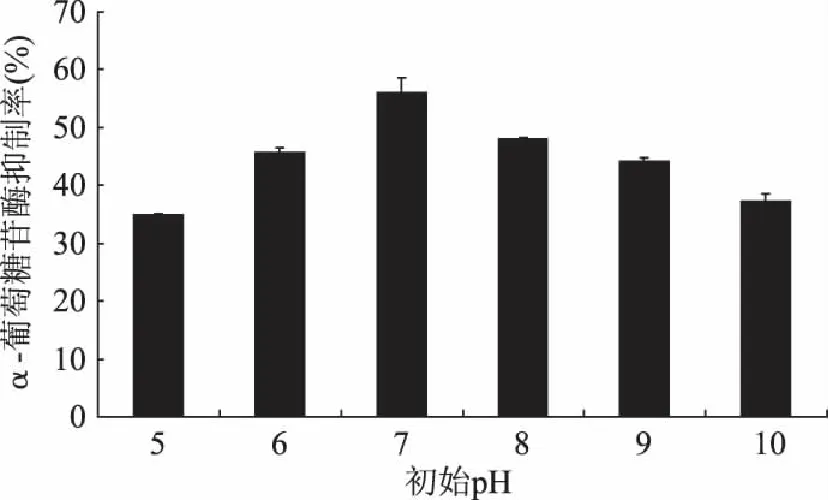
图3 pH对α-葡萄糖苷酶抑制活性的影响 Fig.3 Effect of pH value on the α-glucosidase inhibitory activity
2.2.3 含水量对α-葡萄糖苷酶抑制活性的影响 在固态发酵中,水分含量是影响菌株生长及代谢的关键因素之一。当豆渣含水量为80%时,α-葡萄糖苷酶抑制活性最高,达60.65%。水分对微生物生长及其产物的影响主要是由于水分对底物物理性质的作用。高于最佳水分含量将使豆渣的多孔性降低,微粒结构改变,氧气输送量减少;而低于最佳水分含量将导致固态底物中营养物质的可溶性下降,而微生物也得不到足够的水分进行生长[15]。
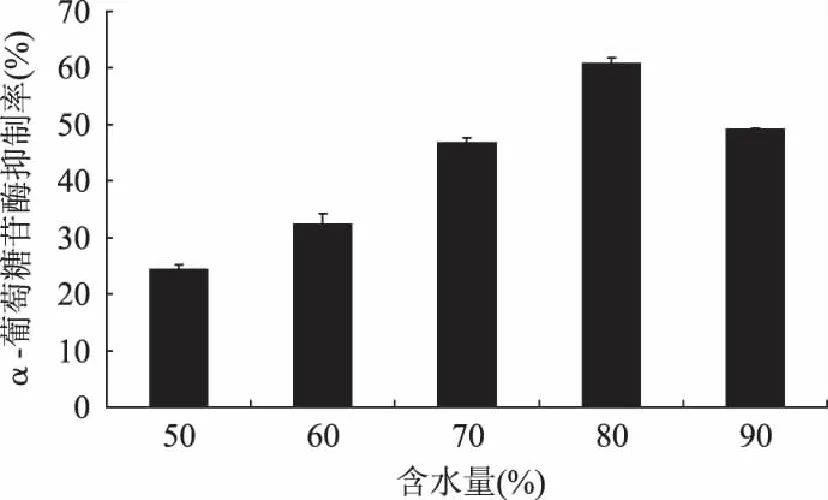
图4 含水量对α-葡萄糖苷酶抑制活性的影响 Fig.4 ffect of water content on the α-glucosidase inhibitory activity
2.2.4 豆渣品种对α-葡萄糖苷酶抑制活性的影响 考察8种不同品种的大豆所制备的豆渣对菌株5发酵豆渣α-葡萄糖苷酶抑制活性的影响。从图5可以看出,菌株5以不同品种的大豆豆渣进行固态发酵,均能生长良好,所得发酵豆渣的α-葡萄糖苷酶抑制活性均在50%以上,并无显著差异。
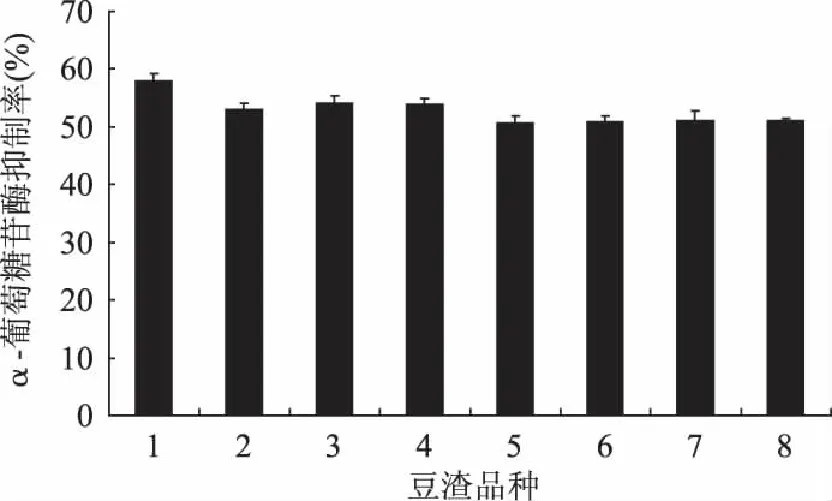
图5 豆渣品种对α-葡萄糖苷酶抑制活性的影响 Fig.5 ffect of okara variety on the α-glucosidase inhibitory activity
2.2.5 发酵温度对α-葡萄糖苷酶抑制活性的影响 由图6可见,40℃下发酵所得发酵液对α-葡萄糖苷酶抑制活性最强,达到59.3%。在35~45℃范围内发酵液的抑制活性均较高,在40%以上。但当温度低于35℃及高于45℃时,发酵液的抑制活性降低很快,20℃及50℃时的抑制活性分别是最高抑制活性的31.6%和21.8%。在温度较低的情况下,菌体生长缓慢,因此当发酵进行48h后,发酵液的抑制活性仍然不高。当温度增到50℃时,发酵液的抑制活性就显著降低,这可能是因为高温环境也会改变正常菌株合成α-葡萄糖苷酶抑制因子的能力[16]。
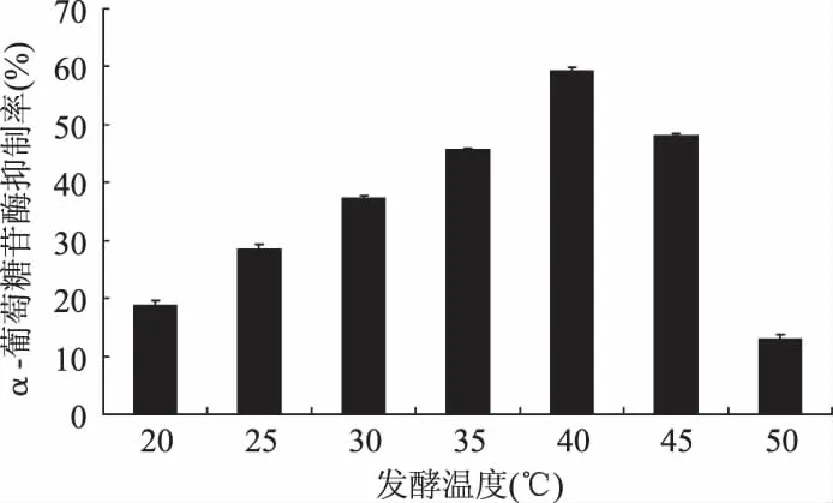
图6 发酵温度对α-葡萄糖苷酶抑制活性的影响 Fig.6 Effect of temperature on the α-glucosidase inhibitory activity
2.2.6 发酵时间对α-葡萄糖苷酶抑制活性的影响 由图7可见,当发酵进行到12h时,发酵液具有一定的α-葡萄糖苷酶抑制活性,随着发酵时间的延长,抑制活性也增加,发酵进行到48h时,抑制活性达到49.3%,进一步延长发酵时间,抑制活性增长速度缓慢。发酵进行到96h时,抑制活性达56.4%。

图7 发酵时间对α-葡萄糖苷酶抑制活性的影响 Fig.7 Effect of fermentation time on the α-glucosidase inhibitory activity
3 结论
本研究从传统发酵食品中筛选产α-葡萄糖苷酶抑制剂的菌株,并对细菌5固态发酵豆渣的发酵条件进行优化,结果表明:含水量、发酵时间、发酵温度对发酵豆渣的α-葡萄糖苷酶抑制活性影响较大。在豆渣含水量80%,接种量2%,初始pH6~8,发酵温度40℃的条件下发酵48h,发酵豆渣表现出较高的α-葡萄糖苷酶抑制活性。在本研究结果的基础上,有望通过进一步研究得到含稳定有效降血糖成分的功能性食品。同时,将发酵豆渣开发成特殊用途的食品,可以大大提高豆渣的利用价值,为豆渣的开发利用开辟新途径。
[1]Baron A D. Postprandial hyperglycaemia and α-glucosidase inhibitors[J]. Diabetes Research and Clinical Practice,1998,40(suppl.):51-55.
[2]Bertozzi C R,Kiessling LL. Chemical glycobiology[J]. Science,2001,291:2357-2364.
[3]Melo EB,da Silveira Gomes A,Carvalho I. α-and β-glucosidase inhibitors:chemical structure and biological activity[J]. Tetrahedron,2006,62:10277-10302.
[4]Asano N. Glycosidase inhibitors:update and perspectives on practical use[J]. Glycobiology,2003,13:93-104.
[5]朱运平,李秀婷,李里特. 天然α-葡萄糖苷酶抑制剂来源及应用研究现状[J]. 中国食品学报,2011(4),154-160.
[6]Murai A,Iwamura K,Takada M,etal. Control of postprandial hyperglycaemia by galactosyl maltobionolactone and its novel anti-amylase effect in mice[J]. Life Sciences,2002,71:1405-1415.
[7]Van der Riet W B,Wight A W,Cilliers J J L,etal. Food chemical investigation of tofu and its byproductokara[J]. Food Chemistry,1989,34:193-202.
[8]朱运平,程永强,刘海杰,等. 不同菌种发酵豆渣产α-葡萄糖苷酶抑制因子的研究[J]. 中国粮油学报,2008,23(4):70-74.
[9]朱运平,程永强,汪立君,等. 发酵豆渣的功能性及应用研究现状[J].食品科学,2008,29(5):475-479.
[10]O’toole D K. Characteristics and use of okara,the soybean residue from soy milk production[J]. Journal of Agricultural and Food Chemistry,1997,47:363-371.
[11]朱运平,李里特. 豆渣的营养功能特性[J]. 营养健康新观察,2006(2):47-49.
[12]Zhu Y P,Yin L J,Cheng Y Q,etal. Effects of sources of carbon and nitrogen on production of α-glucosidase inhibitor by a newly isolated strain ofBacillussubtilisB2[J]. Food Chemistry,2008,109(4):737-742.
[13]Zhu Y P,Yamaki K,Yoshihashi T,etal. Purification and identification of 1-deoxynojirimycin(DNJ)in okara fermented byBacillussubtilisB2 from Chinese traditional food(Meitaoza)[J]. Journal of Agricultural and Food Chemistry,2010,58(7):4097-4103.
[14]朱运平,李秀婷,李里特.BacillussubtilisB2产1-脱氧野尻霉素(DNJ)发酵条件优化[J]. 食品科学,2010,31(17):290-293.
[15]韦赟,江正强,李里特,等. 橄榄绿链霉菌固体发酵产木聚糖酶的研究[J]. 食品科学,2004,25:70-73.
[16]Stein DC,Kopec L K,Yasbin RE,etal. Characterization ofBacillussubtilisDSM704 and its production of 1-deoxynojirimycin[J]. Applied and Environmental Microbiology,1984,48(2):280-284.
