微波法提取西南委陵菜黄酮及其抗氧化活性的细胞模型法评价
2014-03-22,,
,,
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134)
西南委陵菜(Potentillafulgens)蔷薇科委陵菜属植物,在我国主要分布于湖北、安徽、四川、贵州、云南和广西等地。委陵菜的营养成分较为丰富,VC的含量甚至可达到每百克鲜样含92mg[1]。委陵菜在我国民间常作为食用野菜利用,是药食同源植物[2]。西南委陵菜具有清热解毒,涩肠止泻,凉血止血等疗效[3]。目前,西南委陵菜的研究已有少量报道,翁贵英等[4]分别以乙醇和甲醇为提取剂提取西南委陵菜根和叶部分的黄酮,发现70%乙醇溶液的提取率最高,其根部和茎叶部分的黄酮含量分别为24.15%和9.62%。Jaitak等[5]从喜马拉雅山委陵菜中分离出了Afzelchin-4α→8″-儿茶素、表儿茶素和芦丁,以及一种新的双黄酮Potifulgene。ABTS、DPPH和FRAP实验显示Potifulgene的抗氧化活性比表儿茶素更高[6]。Radhika等[7]发现西南委陵菜根的甲醇提取物能降低乳腺癌细胞(MCF-7)癌细胞活性,并提高携带埃利希腹水瘤细胞小鼠的存活率。前期[8]本研究组从总体抗氧化能力、对Fe2+诱发卵黄脂蛋白PUFA过氧化体系的抑制能力、清除羟基自由基能力、清除超氧阴离子自由基能力、清除DPPH自由基能力五个方面评价了委陵菜中黄酮类化合物的活性。
本文利用微波辅助提取法对西南委陵菜黄酮进行提取。与传统方法相比,微波辅助提取缩短了提取时间,成分损失更少[9]。利用细胞模型来测定抗氧化活性物质的抗氧化活性,是一种新的抗氧化活性评价方法,较完整地反映了抗氧化活性物质在细胞内的吸收、代谢和分布,以及抗氧化活性物质通过抑制自由基产生或提高人体内源性抗氧化物质的水平来达到抗氧化效果方面的信息。细胞模型法比化学法更具有生物相关性,能够较好地预测抗氧化活性物质在人体内的抗氧化活性。该方法弥补了化学抗氧化方法忽视在人体及细胞内的生物利用率和代谢等缺陷,在抗氧化活性评价方面发挥出非常重要的作用。
1 材料与方法
1.1 材料与仪器
西南委陵菜 亳州市真源堂药业有限公司,产地为河北,洗净后烘干备用;芦丁标准品(分析纯) 北京化学试剂公司;D101大孔吸附树脂 天津南开和成科技有限公司;DPPH 美国Sigma公司;HT-29细胞 北京康为世纪生物科技有限公司;RAW264.7细胞 美国模式培养物集存库;MTT试剂 中国医学科学院血液研究所科技公司;96孔板 Nalge Nunc International(美国);DCFH-DA荧光探针 江苏碧云天生物技术研究所。
MAS-1微波萃取仪 上海新仪微波化学科技有限公司;U-3900紫外可见分光光度计 日本Hitachi High-Technologies Corporation;HERACELL 150i CO2培养箱 Thermo Scientific(德国);FHC-1200A生物安全柜 美国Frontline公司;SpectraMax M5酶标仪 美国Molecular Devices公司;Eclipse Ti-U倒置显微镜 日本Nikon公司;RE52-86A型旋转蒸发仪 上海亚荣生化仪器厂;LGJ-10冷冻干燥机 北京松源华兴科技发展有限公司;HZS-H型水浴振荡器 哈尔滨市东联电子技术开发有限公司;80-1离心机 上海手术器械厂。
1.2 实验方法
1.2.1 西南委陵菜黄酮的微波提取 称取0.5g西南委陵菜粉末,按1∶30的料液比加入50%(v/v)乙醇溶液为提取剂,放入微波萃取仪的样品瓶中,选择微波功率为400W,在60℃下用微波萃取仪萃取5min,待提取液稍冷后进行过滤,滤液经石油醚萃取,弃掉石油醚层,再于旋转蒸发仪中减压旋转蒸发至粗提液中无乙醇,冷冻干燥得到西南委陵菜粗黄酮的干燥粉末。试验以黄酮得率为指标,通过单因素试验来确定乙醇浓度、料液比、提取温度、微波功率和提取时间的最佳条件,以得到微波辅助提取西南委陵菜黄酮的最佳工艺参数。按以下公式计算黄酮得率:
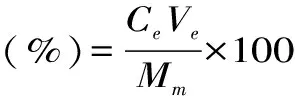
式(1)
其中Ce为提取液中黄酮浓度,由标准曲线得出(mg/mL);Ve为提取液体积(mL);Mm为物料质量,500mg。
1.2.2 西南委陵菜黄酮溶液的配制 使用D101大孔吸附树脂纯化粗黄酮。纯化条件:粗黄酮样品液(pH4)以吸附流速为2BV/h上样,解吸剂为60%乙醇溶液(pH8)。洗脱液收集后置于真空旋转蒸发仪中减压除去乙醇后,取适量提纯后的黄酮加蒸馏水稀释至浓度为1.0mg/mL作为样品液。再配制1.0mg/mL的抗坏血酸(VC)溶液作为对照液。
1.2.3 总抗氧化活性的测定 采用磷钼络合物法[10]测定黄酮总抗氧化活性。
1.2.4 清除羟自由基(·OH)能力的测定 目前清除羟自由基的研究方法可分为四类:Fenton反应、催化剂作用下的非Fenton反应、含巯基的有机物质发生自身氧化还原反应、紫外线照射。本文采用结晶紫法(Fenton反应)[11]测定黄酮清除羟自由基(·OH)能力。
1.2.6 清除DPPH自由基能力的测定 本文按照文献[13]的方法测定并计算IC50值。
1.2.7 Fe2+诱发脂蛋白不饱和脂肪酸过氧化体系中抗氧化活性的测定 本文按照文献[14]的方法测定。
1.2.8 对细胞生存能力的影响 根据文献的方法[15],并适当改进,测定了西南委陵菜黄酮对结肠癌细胞HT-29和小鼠巨噬细胞RAW-264.7的抑制能力。具体操作是:在96孔板中接种HT-29和RAW264.7,接种密度为1×105/mL,接种量为100μL,设置三个复孔,在37℃、5% CO2环境下培养24h。除去培养基,用PBS缓冲液冲洗两次,用0.0001、0.001、0.01、0.1、1mg/mL的西南委陵菜黄酮溶液处理细胞24h,每个浓度设置三个复孔。除去培养基,用PBS缓冲液冲洗两次,加入5mg/mL噻唑蓝溶液(MTT)20μL,培养4h。加入100μL二甲基亚砜,溶解结晶物,在570nm下测定光密度值ODs。同时测定空白组ODb:不培养细胞,不加入黄酮溶液,其它操作同上。对照组ODc:培养细胞但不加入黄酮溶液,其它操作同上。根据以下公式,计算经西南委陵菜黄酮处理后人类结肠癌细胞HT-29和小鼠巨噬细胞RAW-264.7的抑制能力:
式(2)
1.2.9 细胞内抗氧化实验 根据文献的方法[16],并适当改进,测定了西南委陵菜黄酮在HT-29和RAW264.7细胞内的抗氧化活性。具体操作是:将HT-29和RAW264.7细胞接种于96孔板,接种密度为1×105/mL,接种量为100μL,培养24h。弃掉培养基,用PBS缓冲液冲洗96孔板。用0.025、0.05、0.1、0.25、0.5mg/mL西南委陵菜黄酮溶液100μL处理细胞,每个浓度设置三个复孔,10μmol/L的DCFH-DA荧光探针溶液100μL,在37℃、5% CO2培养箱中继续培养1h。用PBS缓冲液冲洗96孔板,加入300μmol/L的H2O2溶液100μL。在激发波长488nm、发射波长525nm下,每隔5min测定荧光强度1h,并在荧光下拍照。同时测定空白组:用DCFH-DA处理,不加入H2O2和黄酮溶液,其它操作同上;对照组:用DCFH-DA和H2O2处理,不加黄酮溶液,其它操作同上。将细胞内抗氧化活性表达为相对荧光强度。
2 结果与讨论
2.1 西南委陵菜黄酮微波提取条件的优化
按1.2.1方法进行提取,固定其它条件,分别研究乙醇浓度、料液比、提取温度、微波功率及提取时间对西南委陵菜黄酮得率的影响,结果见图1和图2。

图1 提取剂乙醇浓度、料液比和提取温度对西南委陵菜黄酮得率的影响 Fig.1 The effect of concentration of ethanol extractant,material ratio and extraction temperature on the yield of Potentilla fulgens flavonoids
图1表明,当乙醇在溶液中的浓度小于50%时,黄酮得率随着乙醇浓度的增加而显著增加;当乙醇浓度大于50%时,黄酮得率急剧下降。一方面,根据“相似相溶”原理,提取得率与提取剂极性直接相关;另一方面,当提取剂中的乙醇浓度超过某一值时,一定量水的存在增加了植物原料在水中的膨胀,从而扩大了物料与提取剂的接触面积。黄酮得率随料液比的增加而增加,并在1∶30时达到最大值5.68%,当料液比大于1∶30时减少。这可能是因为较大体积的提取剂含水也较多,导致物料在水中膨胀并吸收所要提取的成分。在温度小于60℃时,黄酮得率随温度的增加而显著增加,大于60℃时,黄酮得率有下降的趋势。选择60℃为最佳提取温度。在高温下,溶剂粘度减小,扩散性增加,提取效率增加,但超过一定温度时,影响黄酮类化合物的稳定性,造成其分解[17]。
图2表明当微波功率增加至400W时,较多电磁能量被快速转移至提取系统并提高提取效率。黄酮的高效提取与微波能量通过离子传导和偶极旋转对生物分子的直接影响有关,微波会导致能量分布于溶剂和植物物料内,然后造成分子移动和升温[17]。起初,黄酮得率随微波辐射时间的延长而增加,并在400W下5min时达到最大值5.68%,然后缓慢下降。同样,长时间大功率的微波辐射所产生的热效应也会造成黄酮类化合物的分解为取代基,如羟基和甲氧基[18]。

图2 微波功率与提取时间对黄酮得率的影响 Fig.2 The effect of microwave power and extraction time on the yield of Potentilla fulgens flavonoids
2.2 西南委陵菜黄酮纯度计算
按照文献[19]的方法绘制标准芦丁曲线,吸光度与溶液浓度的关系为得线性回归方程A=12.660C+0.0013(R2=0.9999)。计算得提取出的提取西南委陵菜黄酮粉末纯度为28.2%,纯化后黄酮粉末的纯度为46.6%。
2.3 总抗氧化活性
根据实验方法1.2.3,测定西南委陵菜黄酮溶液和VC溶液在不同浓度下的吸光度,得到其抗氧化活性,结果如图3。

图3 吸光度与样品液浓度的关系 Fig.3 Relationship between absorbance and concentration of samples
磷钼方法是基于样品将Mo(VI)还原为Mo(V),以及随后绿色磷钼络合物的形成,在695nm处具有最大吸收[20]。因此,溶液吸光度越大,样品液还原力越强。图3表明西南委陵菜黄酮具有一定的抗氧化活性,并且随浓度的增加而提高。在浓度为2.73×10-2mg/mL时,西南委陵菜黄酮和VC的吸光度分别为0.48和1.36。即该浓度下西南委陵菜黄酮的抗氧化能力约为VC的1/3。
2.4 清除羟自由基能力
根据实验方法1.2.4,测定各溶液的吸光度,计算对羟自由基的清除率,结果如图4。

图4 羟自由基清除率与样品液浓度的关系 Fig.4 Relationship between scavenging rate of hydroxyl free radicals and concentration of samples
在人体内,羟自由基能够杀死红细胞,降解DNA、细胞膜和多糖化合物。羟自由基是最具反应性活性基团,其在有金属离子存在的情况下(如铜或铁)由超氧阴离子和过氧化氢形成。当羟自由基与芳香族化合物反应,羟自由基能插入双键,形成羟基环己二烯基。所产生的基团继续反应,例如与氧反应,提供氢过氧游离基,通过脱水分解为苯氧基形式的基团[21]。图4表明西南委陵菜黄酮具有较强的羟自由基清除能力,在浓度在5×10-4~1×10-3mg/mL时,西南委陵菜黄酮和VC的羟自由基清除率分别为48.8%~58.1%和7.9%~11.0%。可见该浓度范围内,西南委陵菜黄酮的羟自由基清除能力约为VC的6倍。此外,西南委陵菜黄酮的羟自由基清除能力随浓度有明显提高,而VC的羟自由基清除能力随浓度的变化不明显。
2.5 清除超氧阴离子自由基能力
2.5.1 光谱条件的选择 邻苯三酚自氧化的激发光谱和发射光谱如图5。

图5 邻苯三酚自氧化的激发光谱和发射光谱 Fig.5 Excitation and emission spectra of autoxidation of pyrogallol
在Tris-HCl缓冲液(pH8.20)中,通过邻苯三酚自氧化产生超氧阴离子,邻苯三酚自氧化的产物为3-羟基环己酮-3,5-二烯-1,2-二酮[22]。图5表明,邻苯三酚自氧化的最佳激发波长和发射波长分别为444、509nm,荧光强度随时间而增加,并在4~20min内呈线性关系。
2.5.2 清除超氧阴离子自由基的作用 西南委陵菜黄酮和VC抑制邻苯三酚自氧化的荧光动力学曲线如图6。
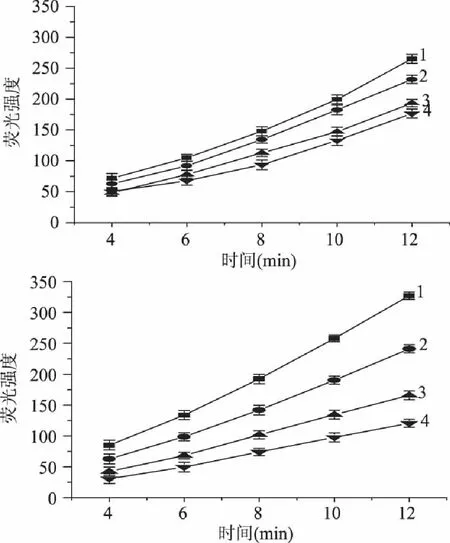
图6 西南委陵菜黄酮和VC抑制邻苯三酚自氧化的荧光动力学曲线 Fig. 6 Fluorescence kinetics curves of Potentilla fulgens flavonoids and VC inhibiting autoxidation of pyrogallol
人体内有一定数量的超氧阴离子存在,与羟基结合后的产物会导致DNA损坏,破坏人类机体功能。图6表明,西南委陵菜黄酮和VC的浓度越大,曲线的斜率Ss越小,说明样品液对邻苯三酚自氧化产生超氧阴离子的抑制作用越强。拟合动力学曲线得到曲线斜率,并计算在不同浓度下西南委陵菜黄酮和VC对超氧阴离子自由基的抑制率,结果见图7。
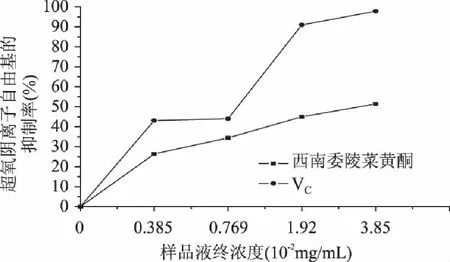
图7 样品液和对照品液对超氧阴离子自由基的抑制率 Fig. 7 Inhibition rates of flavonoids and reference substance to the supraoxygen anion free radicals
结果表明,西南委陵菜黄酮对超氧阴离子自由基具有一定的清除能力,并且随浓度的增加而提高。在浓度1.92×10-2~3.85×10-2mg/mL时,西南委陵菜黄酮和VC的超氧阴离子自由基清除率分别为45.0%~51.4%和91.0%~97.8%。可见该浓度范围内,西南委陵菜黄酮的清除超氧阴离子自由基能力约为VC的1/2。
2.6 清除DPPH自由基能力
西南委陵菜黄酮对DPPH·的清除率结果如图8。

图8 DPPH·清除率与样品液浓度的关系 Fig.8 Relationship between DPPH· scavenging and concentration of samples
DPPH·是一种稳定的自由基团,但它对光、氧、pH以及所用的溶剂敏感。此反应是基于DPPH·中氮的孤电子通过其中氮的孤电子接受抗氧化剂的氢原子而被还原,因此发生颜色消褪[23]。图8表明西南委陵菜黄酮对DPPH·具有明显的清除力,但小于VC。拟合线性方程,西南委陵菜黄酮:S=1448.6C-1.7595(R2=0.9901);VC:S=5450.0C-0.4347(R2=0.9979,横坐标范围:0~0.015mg/mL),得西南委陵菜黄酮清除DPPH自由基的IC50为0.036mg/mL;VC为0.009mg/mL,IC50为西南委陵菜黄酮的1/4。
2.7 Fe2+诱发脂蛋白VC多不饱和脂肪酸过氧化体系中抗氧化活性
西南委陵菜黄酮对卵黄脂蛋白过氧化的抑制作用结果如图9。

图9 样品液对Fe2+诱发卵黄脂蛋白过氧化的抑制作用 Fig.9 Inhibition of samples on Fe2+ yolk lipoprotein peroxide
脂质过氧化过程中发生的ROS氧化生物膜的过程,从而使细胞膜的流动性和通透性发生改变,最终导致细胞结构和功能的改变。图9表明,西南委陵菜黄酮对Fe2+诱发卵黄脂蛋白过氧化具有抑制作用,明显高于VC。并且其抑制能力随浓度的增加而增强。在低浓度时(0.016mg/mL)西南委陵菜黄酮和VC的抑制能力分别为67.1%和22.7%,约为VC的3倍。黄酮类化合物其的抗氧化性是因为捕获过氧化自由基的抗氧化能力,也可能是因为黄酮类化合物与白蛋白之间的反应和与小分子物质(如维生素、谷胱甘肽)的协同作用[24]。
2.8 对细胞生存能力的影响
西南委陵菜黄酮对细胞生存能力的影响结果如图10。
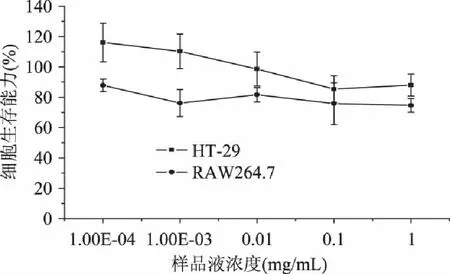
图10 西南委陵菜黄酮对细胞生存能力的影响 Fig.10 Potentilla fulgens flavonoids effects on cell viabilities
MTT赋予淡黄色水溶液,当被脱氢酶和在活细胞中的还原剂还原时,产生不溶于水、蓝紫色的化合物甲瓒,脂溶性的甲瓒可被有机溶剂溶解并可通过分光光度法测定[25],因此可用MTT法测定细胞的生存能力。图10表明了在西南委陵菜黄酮处理后活细胞的百分比。西南委陵菜黄酮溶液使HT-29的生存能力从116.08%降至88.00%,使RAW264.7的生存能力从87.85%降至74.65%。HT-29和RAW264.7活细胞的相对数量随黄酮剂量的增加而减少,但HT-29的相对数量在两个高浓度下均无明显变化,RAW264.7在四个高浓度下均无明显变化。
2.9 细胞内抗氧化实验
西南委陵菜黄酮的细胞内抗氧化结果如图11~图13。

图11 HT-29细胞和RAW264.7细胞的荧光照片 Fig.11 Fluorescent photos of HT-29 cell and RAW264.7 cell

图12 西南委陵菜黄酮在HT-29细胞中的抗氧化活性 Fig.12 Antioxidant activity of Potentilla fulgens flavonoids in HT-29 cells
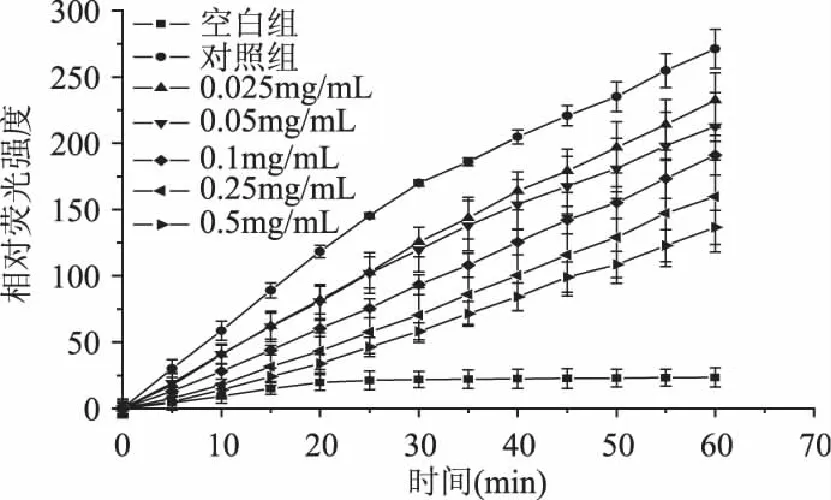
图13 西南委陵菜黄酮在RAW264.7细胞中的抗氧化活性 Fig.13 Antioxidant activity of Potentilla fulgens flavonoids in RAW264.7 cells
荧光探针被广泛用于监控细胞中的氧化活性。细胞内的酯酶将DCFH-DA转化为DCFH,通过与活性氧的反应无荧光的DCFH被氧化为DCF。DCFH的氧化是与H2O2或过氧硝酸盐反应的结果[26],如图11。西南委陵菜黄酮避免了DCFH的氧化,这表明西南委陵菜黄酮具有抗氧化性。在生物系统中正常代谢持续产生有毒的活性氧,因此研究对抗活性氧的物质很有必要。图12和图13表明西南委陵菜黄酮减少了在HT-29细胞和RAW264.7细胞DCF的荧光性,表明它们减少了DCFH的氧化,并且随着浓度的增加黄酮溶液在细胞内的抗氧化性增强。
西南委陵菜黄酮在HT-29中的抗氧化性较弱,并且黄酮溶液的浓度在0.25mg/mL和0.5mg/mL时,二者的抗氧化性变化不明显。这表明当黄酮的浓度达到0.25mg/mL,HT-29细胞内黄酮的浓度已经基本达到饱和,继续增加黄酮的浓度并不能引起细胞内黄酮浓度的改变。所以当浓度大于0.25mg/mL时,黄酮的抗氧化性趋于定值。考虑到不同浓度的黄酮溶液对HT-29细胞生存能力的抑制性差异,因此选取0.25mg/mL为HT-29细胞的最佳应用浓度。西南委陵菜黄酮在RAW264.7中的抗氧化性较强,不同浓度的黄酮溶液在RAW264.7中的抗氧化性变化明显,并考虑不同浓度的黄酮溶液对RAW264.7细胞生存能力的抑制差异较小,因此,对于RAW264.7细胞确定0.5mg/mL为最佳应用浓度。
2.10 环境因素对西南委陵菜黄酮的影响
前期研究[8]发现在总体抗氧化能力、对Fe2+诱发卵黄脂蛋白PUFA过氧化体系的抑制能力、清除羟基自由基能力和清除超氧阴离子自由基能力方面,河北产西南委陵菜高于福建产西南委陵菜,但在清除DPPH自由基方面,福建产西南委陵菜高于河北产西南委陵菜。即河北产委陵菜的抗氧化活性总体优于福建产西南委陵菜,其可能的原因为:河北省平均海拔1200~1500m,福建小于1000m,河北的海拔高度更接近西南委陵菜的主要产地中国西南地区;河北年日照时间为2400~3100h,福建为1700~2300h,因此河北的日照时间更有利于植物的光和作用;河北的年均降水量为300~800mm,福建为年降水量1400~2000mm,降雨所产生的臭氧不利于植物代谢。特别是,臭氧的氧化作用导致不饱和的有机分子的破裂,使臭氧分子结合在有机分子的双键上,生成臭氧化物。
3 结论
本文考察了微波提取西南委陵菜黄酮的最佳条件:乙醇浓度50%、料液比1∶30、提取温度60℃、微波功率400W、提取时间5min,最佳得率5.68%。测定了西南委陵菜黄酮的总抗氧化活性、清除羟自由基能力、清除超氧阴离子自由基能力、清除DPPH自由基能力和对卵黄脂蛋白过氧化的抑制作用,并以抗氧化剂VC为对照,结果表明西南委陵菜黄酮是一种优良的天然抗氧化剂,西南委陵菜黄酮清除羟自由基抑制能力和对卵黄脂蛋白过氧化的抑制作用明显高于VC。此外,西南委陵菜黄酮在HT-29和RAW264.7两种细胞中表现出明显的抗氧化性,其抗氧化性随浓度增加递增。
[1]闵运江,杜忠笔. 安徽产委陵菜属四种可食用野菜的成分分析[J]. 中国林副特产,2008(4):4-6.
[2]郑光海,朴惠顺. 朝天委陵菜化学成分研究[J]. 中草药,2012,43(7):1285-1288.
[3]钟颖,瞿显友,张永东. 湘西委陵菜属药用植物资源[J]. 中国民族民间医药杂志,2004,71:344-345.
[4]翁贵英,李金辉. 不同溶剂法对西南委陵菜根、叶的总黄酮含量测定[J]. 六盘水师范高等专科学校学报,2005,17(6):8-9.
[5]Jaitak V,Kaul VK,Himlata,etal. New hopane triterpenes and antioxidant constituents fromPotentillafulgens[J]. Nat Prod Commun,2010,5(10):1561-1566.
[6]Jaitak V,Sharma K,Kalia K,etal. Antioxidant activity ofPotentillafulgens:an alpine plant of western Himalaya[J]. J Food Compos Anal,2010,23:142-147.
[7]Radhika M,Ghoshal N,Chatterjee A. Comparison of effectiveness in antitumor activity between flavonoids and polyphenols of the methanolic extract of roots ofPotentillafulgensin breast cancer cells[J]. J Complement Integr Med,2012,9(1):1-11.
[8]周媛,李荣,姜子涛. 食用委陵菜黄酮的抗氧化性及清除自由基能力研究[J]. 食品工业科技,2012,33(17):102-105.
[9]Pellati F,Prencipe FP,Bertelli D,etal. An efficient chemical analysis of phenolic acids and flavonoids in raw propolis by microwave-assisted extraction combined with high-performance liquid chromatography using the fused-core technology[J]. J Pharmaceut Biomed,2013,81-82:126-132.
[10]Prieto P,Pineda M,Aguilar M. Spectrophotometric quantitation of antioxidant capacity through the formation of a phosphomolybdenum complex:specific application to the determination of vitamin E[J]. Anal Biochem,1999,269(2):337-341.
[11]刘骏. 结晶紫分光光度法测定Fenton反应产生的羟自由基[J]. 武汉工业学院学报,2005,24(2):53-55.
[12]赫春香,卢丽男,曹璨,等. 荧光动力学分析新方法测定超氧自由基抑制剂的抗氧活性[J]. 辽宁师范大学学报:自然科学版,2005,28(1):73-75.
[13]Ahmad N,Fazal H,Abbasi BH,etal. DPPH free radical scavenging activity and phenotypic difference in hepatoprotective plant(Silybum marianum L.)[J]. Toxicol Ind Health,2012,29:460-467.
[14]张尔贤,俞丽君,周意琳,等. Fe2+诱发脂蛋白PUFA过氧化体系及对若干天然产物抗氧化作用的评价[J]. 生物化学与生物物理学报,1996,28(2):218-222.
[15]Hamid R,Rotshteyn Y,Rabadi L,etal. Comparison of alamar blue and MTT assays for high through-put screening[J]. Toxicol in Vitro,2004,18:703-710.
[16]Yang LC,Li R,Tan J,etal. Polyphenolics Composition of the leaves of Zanthoxylum bungeanum Maxim. grown in Hebei,China,and their radical scavenging activities[J]. J Agric Food Chem,2013,61:1772-1778.
[17]Xiao W,Han L,Shi B. Microwave-assisted extraction of flavonoids from Radix Astragali[J]. Sep Purif Technol,2008,62:614-618.
[18]Biesaga M. Influence of extraction methods on stability of flavonoids[J]. J Chromatogr A,2011,1218:2505-2512.
[19]盛祎祎,朱云龙. 分光光度法测定杭白菊中总黄酮的含量[J]. 海峡药学,2009,21(12):99-100.
[20]Hossain MA,Rahman SMM. Total phenolics,flavonoids and antioxidant activity of tropical fruit pineapple[J]. Food Res Int,2011,44:672-676.
[21]Li YH,Jiang B,Zhang T,etal. Antioxidant and free radical-scavenging activities of chickpea protein hydrolysate(CPH)[J]. Food Chem,2008,106:444-450.
[22]Ma S,Mu W,Gao J,etal. Spectroscopic study of 2-(2-pyridyliminomethyl)phenol as a novel fluorescent probe for superoxide anion radicals and superoxide dismutase activity[J]. J Fluoresc,2009,19:487-493.
[23]Bors W,Heller W,Michel C,etal. Flavonoids as antioxidants:determination of radical-scavenging efficiencies[J]. Methods Enzymol,1990,186:343-354.
[24]Cazzola R,Cestaro B. Red wine polyphenols protect n-3 more than n-6 polyunsaturated fatty acid from lipid peroxidation[J]. Food Res Int,2011,44:3065-3071.
[25]Stockert JC,Blazquez-Castro A,Canete M,etal. MTT assay for cell viability:Intracellular localization of the formazan product is in lipid droplets[J]. Acta Histochem,2012,114(8):785-796.
[26]Labieniec M,Gabryelak T. Antioxidative and oxidative changes in digestive gland cells of freshwater mussels Unio tumidus caused by selected phenolic compounds in the presence of H2O2or Cu2+ions[J]. Toxicol In Vitro,2007,21:146-156.
