青藏高原自然发酵牦牛酸奶中乳酸菌的抗氧化能力的研究
2014-03-22,,,,,,*
, ,,,,,*
(1.西南大学食品科学学院,重庆 400715;2.重庆第二师范学院生物与化学工程系,食品安全与营养研究所,重庆 400067)
生物氧化作用对生物有机体而言是一个重要的生理过程,但当机体受到外界环境的不利影响或出现病变时,就会导致体内的活性氧(ROS)及其它自由基不能被有效地清除,影响细胞活性,对机体产生毒害,最终导致衰老、肿瘤等病症[1-2]。因此为了更好的加强机体的抗氧化能力,且从食品安全性上考虑,开发天然抗氧化剂具有非常重要的意义,现已成为当今研究热点[3]。近年来,一些发酵乳制品,因为具有独特的口感和较强的抗氧化活性而受到越来越多人的关注[4],而经过体内外实验证明,部分乳酸菌具有良好的抗氧化活性,如黄珊珊等[5]研究发现植物乳杆菌的抗氧化活性优于保加利亚乳杆菌。张江魏等[6]通过抗亚油酸过氧化能力和清除DPPH自由基实验,从30株乳酸菌中筛选出抗氧化活性较强的2种乳酸菌株。Lin等[7-8]研究了嗜酸乳杆菌清除羟自由基和抗脂质过氧化的能力。Verena等[9]研究发现服用含有一定剂量乳酸菌的牛乳后乳酸菌可以保护肠道细胞DNA免受氧化损伤。青藏高原自然发酵牦牛酸奶作为藏区人民特色食品和生活必需品,以其丰富的营养,独特的风味和抗氧化、调节机体免疫能力等保健功能,受到了越来越多的人的关注[10]。研究表明,牦牛酸奶的保健功能与其中含有的优势乳酸菌有密切的关系,这些乳酸菌具有抑菌、增强机体免疫力、抗衰老和抗癌等生理功能。因此,无论从营养保健还是安全性方面考虑,牦牛酸奶中的乳酸菌作为天然抗氧化物质吸引了众多学者的研究兴趣,成为近年来食品研究的新兴领域。
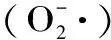
1 材料与方法
1.1 材料与仪器
实验菌株 将本实验室采至从西藏及川西青藏高原牧民家庭的10份自然发酵牦牛酸奶中分离纯化得到的15株乳酸菌菌株,编号为:La1~La15;MRS培养基、脱脂乳培养基:北京索莱宝生物科技有限公司;PBS缓冲液(pH7.4)、Tris-HCl(pH8.2)、氢氧化钠、过氧化氢(H2O2)、过氧化氢酶、抗坏血酸、三氯甲烷、邻苯三酚、二乙三胺五乙酸、硫酸亚铁(FeSO4)、硫代巴比妥酸(TBA)、O-菲罗啉、三氯乙酸(TCA)、亚油酸、亚油酸乳化液、二苯代苦味肼基自由基(DPPH)等试剂均为国产分析纯。
紫外可见分光光度计-2450 SHIMADZU日本岛津公司;高压灭菌锅 上海三申医疗器械厂;SW-CJ-IFD型洁净工作台 苏州安泰空气技术有限公司;DHG-9240型电热恒温鼓风干燥箱 上海一恒科学仪器有限公司;电热恒温培养箱 上海跃进医疗器械厂;笔型pH计 上海宇隆仪器有限公司;HZ-9211K恒温振荡器 太仓市科教器材厂;台式冷冻离心机 美国SIGMA公司。
1.2 实验方法
1.2.1 乳酸菌株的活化培养 将15株已纯化保存的乳酸菌株样品分别接种于脱脂乳培养基中,置30℃活化培养24h,然后划线接种于MRS平板,30℃培养48h。
1.2.2 乳酸菌无细胞提取物的制备 分别挑取活化后的15株乳酸菌株于MRS液体培养基30℃培养24h,发酵液于4000×g离心15min,收集菌体,并用PBS(pH7.4)缓冲液洗涤3次,将菌数调整为1010cfu/mL,重悬于PBS中,在冰浴中超声波破碎菌体,破碎液于4℃,12000×g离心30min,取上清液,即为所需待测样品[6,11]。
1.2.3 乳酸菌抗氧化活性的检测
1.2.3.1 对H2O2的耐受能力的实验 将活化后的菌株离心收集菌体,用PBS缓冲液洗涤,制备成108cfu/mL的菌液,在5mL H2O2浓度为0%、0.2%、0.3%、0.5%、1%的PBS溶液中分别加入0.5mL菌液,37℃处理1min,再分别加入0.2mg/mL过氧化氢酶;涂布于MRS固体培养基,30℃培养48h,计数并计算其存活率[6,11],并重复实验3 次。
存活率(%)=(AX-APBS)/(A0-APBS)×100
式中:AX为各浓度H2O2时计数结果;APBS为PBS计数结果;A0为不加H2O2时计数结果。
清除率(%)=[1-(A11-A10)/(A01-A00)]×100
式中:A11为含样品和邻苯三酚;A10为含样品,不含邻苯三酚;A00为不含样品和邻苯三酚;A01为不含样品,含邻苯三酚。
1.2.3.3 螯合Fe2+能力的实验 参照文献[12]中的方法,略有改进(空白对照为PBS):在0.5mL乳酸菌无细胞提取物中依次加入1%的抗坏血酸0.1mL,0.4%的FeSO40.1mL和0.2mol/L的NaOH 1mL;将混合液在30℃水浴20min,三氯乙酸沉淀蛋白,于4℃ 4500g/min离心10min;取上清液0.2mL,加入0.1%的O-菲罗啉(质量分数)2mL,反应10min,记录其在510nm波长处的吸光值(A),并重复实验3次。
1.2.3.4 抗脂质过氧化能力的实验 参照文献[12],用硫代巴比妥酸(TBA)法,通过检测脂质过氧化反应的最终产物丙二醛(MDA)的含量从而得知脂质过氧化的情况,这是目前公认的反映脂质过氧化的指标[13-15]。MDA在酸性条件下可以与TBA发生反应生成3,5,5-三甲基恶唑2,4-二酮,在532nm波长处有吸收峰,且吸收程度与抗氧化活性呈线性关系,通过下面的公式计算出抗脂质过氧化率(空白对照为PBS),并重复实验3次。
抗脂质过氧化率(%)=[1-A(样品)/A(空白)]×100
1.2.3.5 清除DPPH自由基能力的实验 参照文献[6,12]的方法,略作改动如下:取1mL乳酸菌无细胞提取物,加入1mL 0.2mmol/L的DPPH自由基甲醇溶液,室温、黑暗中反应30min;用三氯甲烷抽提反应液,记录其在517nm波长处的吸光值(A),并重复实验3次。
DPPH自由基清除率(%)=[1-A(样品)/A(空白)]×100
式中:A(空白):空白对照为去离子水。
1.3 实验数据处理方法
实验数据分析采用IBM SPSS 19.0软件,所有实验数据均表示为平均值±SD值,差异显著性分析采用一维方差分析(One-Way ANOVA),显著性水平设为0.05。
2 结果与分析
2.1 对H2O2的耐受能力实验
以0% H2O2中乳酸菌的存活率为100%计算。如图1所示,15株乳酸菌均对H2O2有不同程度的耐受能力。当H2O2浓度为0.2%时,乳酸菌的存活率为85%~94%之间,最高为菌株La2,达到93.5%,菌株La1和 La10的存活率也均超过93%。当H2O2浓度为0.3%时,乳酸菌的存活率为70%~85%之间,最高为菌株La5,菌株La10和La1的存活率也均超过84%。当H2O2浓度为0.5%时,乳酸菌的存活率45%~66%之间,最高为菌株La15,达到65.2%,菌株La1和La5的存活率也均超过62%。当H2O2浓度达到1%时,乳酸菌的存活率为10%~33%之间。其中菌株La15存活率最高,达到32.9%;其次为菌株La6,达到30.6%;菌株La4、La10和La11也显示了较高的耐受能力,乳酸菌的存活率分别达到了27.8%、25.9%和25.4%。
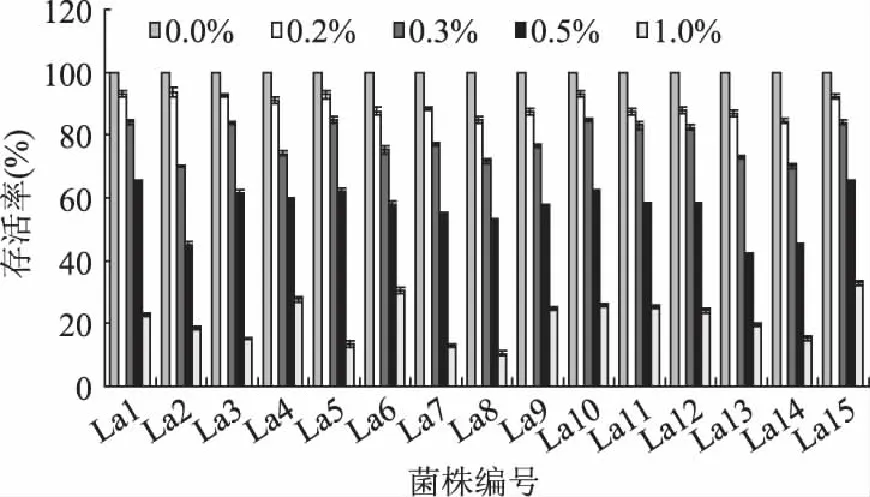
图1 乳酸菌在不同浓度H2O2中的存活率(n=3) Fig.1 Survival of Lactobacillus in different concentrations of H2O2(n=3)
实验数据表明,15株乳酸菌的存活率均随着H2O2浓度的增高而减低;当H2O2浓度达到1%时,乳酸菌的存活率较高的菌株为La15、La6、La4、La10和La11这五株菌。
2.2 清除超氧自由基的能力实验
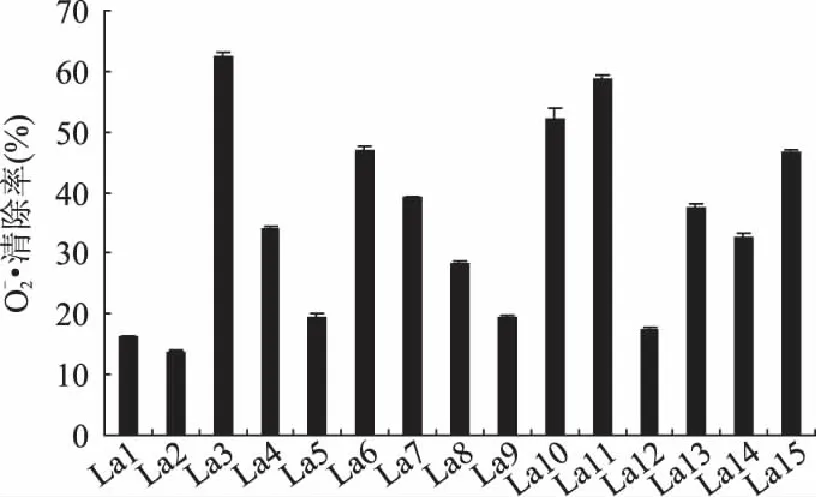
图2 乳酸菌无细胞提取物的清除超氧自由基的能力(n=3) Fig.2 Scavenging rates of cell-free extracts of Lactobacillus against superoxide anion free radicals(n=3)
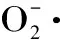
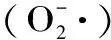
2.3 螯合Fe2+能力的实验
由图3可知,15株乳酸菌均对Fe2+有一定的螯合能力,每1010个乳酸菌的无细胞提取物可螯合Fe2+的量在5.3×10-6~62.7×10-6。其中螯合能力较高的有3株菌,分别为La3、La10和La11,其中螯合能力最强的为La10,达62.7×10-6。
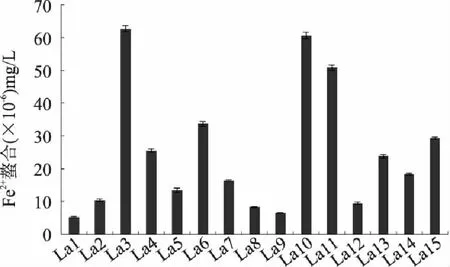
图3 乳酸菌无细胞提取物的螯合Fe2+能力(n=3) Fig.3 The ability of Fe2+ chelating of cell-free extracts of Lactobacillus(n=3)
机体内许多氧化过程都需要铜、铁等金属离子的参与,故这些过渡金属离子是导致氧化损伤的一种重要原因。当金属离子被螯合后,便不能启动多不饱和脂肪酸发生脂质过氧化,从而减缓了脂类化合物氧化的速度,阻止其对机体生物膜和核酸的伤害。因此,对Fe2+的螯合能力对抑制氧化具有非常重要的意义。
实验数据表明,La3、La10和La11这三株乳酸菌对Fe2+的螯合能力优于其他菌株,具有更强的抗氧化能力。这与Kai等[17]研究乳酸菌对肠黏膜的抗氧化作用时发现的乳酸菌菌株通过减少金属离子和脂质过氧化作用来提高整体抗氧化水平的,Lee等研究发现乳酸菌的抗氧化效果是通过螯合铜离子和亚铁离子来实现的[18]是一致的。
2.4 抗脂质过氧化能力的实验
由图4可知,在抗亚油酸过氧化实验中,15株乳酸菌对亚油酸过氧化均有不同程度的抑制作用,抑制率的范围在5%~71%之间。其中抑制率较高的有三株菌,分别是La3、La10和La11,其中La3的抑制率最高,达到70.8%。
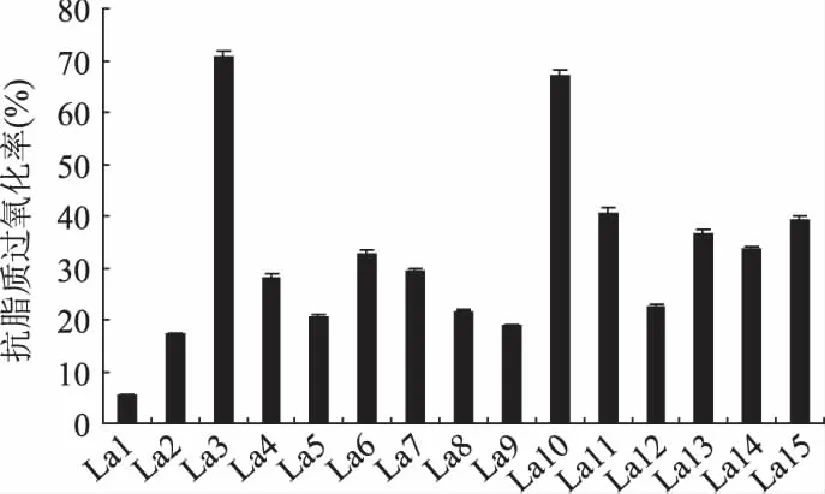
图4 乳酸菌无细胞提取物的抗脂质过氧化的能力(n=3) Fig.4 The ability of anti-lipid peroxidation of cell-free extracts of Lactobacillus(n=3)
自由基攻击细胞膜上的多聚不饱和脂肪酸而触发脂质过氧化等一系列链式反应叫脂质过氧化反应。脂质过氧化反应在机体的新陈代谢过程中起着重要的作用,如果失调,就会引起氧自由基连锁反应,损害机体的生物膜及其功能,使细胞发生病变及纤维化,造成机体神经、组织、器官等损伤。
实验数据表明,La3、La10和La11这三株乳酸菌的抗脂质过氧化的能力优于其他菌株,具有更强的抗氧化能力。
2.5 清除DPPH自由基能力的实验
由图5可知,15株乳酸菌对DPPH自由基均有一定的清除作用,清除率的范围在8%~49%之间。其中清除率较高的有3株菌,分别是La3、La10和La11,清除率最高的是La10,达到48.6%。
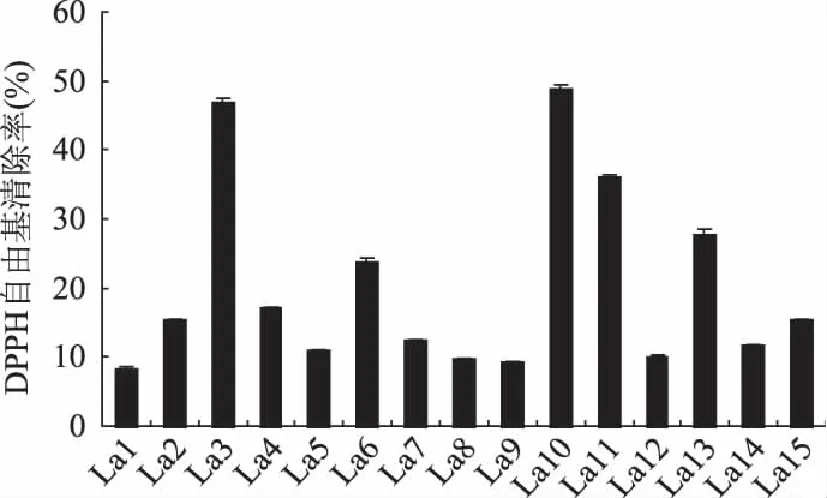
图5 乳酸菌无细胞提取物清除DPPH自由基的能力(n=3) Fig.5 Scavenging rates of cell-free extracts of Lactobacillus against DPPH free radicals(n=3)
DPPH自由基是一种以氮为中心的,很稳定的自由基,乳酸菌能清除它,说明其具有降低羟基等自由基和打断脂质过氧化链反应的作用。通过检测乳酸菌对DPPH自由基清除能力的高低可以表示其抗氧化能力的强弱[19]。
实验数据表明,La3、La10和La11这三株乳酸菌的对DPPH自由基清除能力优于其他菌株,具有更强的抗氧化能力。
3 结论
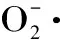
在本研究的基础上,我们准备将筛选出的菌株La3、La10和La11做体内抗氧化实验,进一步验证其抗氧化能力,为合理利用开发乳酸菌抗氧化制剂提供理论参考。
[1]Ji X Y,Tan B K,ZHU Y C,etal.Comparison of Cardioprotective Effects Using Ramipril and Danshen for the Treatment of Acute Myocardial Infarction in Rats[J].Life Sciences,2003,73(11):1413-1426.
[2]Agerholm-Larsen L,Raben A,Haulrik Netal.Effect of 8 weeks intake of probiotic milk products on risk factors for cardiovascular diseases[J].European Journal of Clinical Nutition,2000,54(4):288-297.
[3]彭新颜,于海洋,李杰,等. 乳酸菌抗氧化作用研究进展[J].食品科学,2012,33(23):370-374.
[4]张江魏,曹郁生.乳酸菌抗氧化活性的研究进展[J].中国乳品工业,2005,33(1):34-36.
[5]黄珊珊,刘晶,赵征. 植物乳杆菌和德氏乳杆菌保加利亚亚种菌体外抗氧化活性的对比研究[J].中国乳品工业,2010,38(10):8-10.
[6]张江巍,曹郁生,李海星,等.乳酸菌抗氧化活性及检测方法[J].中国乳品工业,2005,33(9):53-56.
[7]Lin M Y,Chang F Y. Antioxidative effect of intestinal bacteria Bifidobacterium longum ATCC 15708 andLactobacillusacidophilus ATCC4356[J]. Digestive Diseases and Sciences,2000,45(8):1617-1622.
[8]Lin M Y,Yen C L. Antioxidative ability of lactic acid bacteria[J]. Journal of Agriculture and Food Chemistry,1999,47(4):1460-1466.
[9]Verena J K,Brigitte M,Reinhard S,etal. Impact of lacticacid bacteria on oxidative DNA damage in human derived coloncells[J]. Food and Chemical Toxicology,2008,46(4):1221-1229.
[10]张丽.传统发酵牦牛奶中益生乳杆菌筛选及其免疫调节功能研究[D].甘肃:甘肃农业大学,2011.
[11]郭兴华,曹郁生,东秀珠,等.益生乳酸细菌-分子生物学与生物技术[M].北京:科学出版社,2008:358-360.
[12]张江魏,曹郁生,刘晓华,等.抗氧化乳酸菌L4的SOD活性及其发酵乳的抗氧化作用[J].中国乳品工业,2006,34(11):12-15.
[13]高玫梅,刘燕,燕启江,等.多棘海盘车AST抗氧化作用的研究[J].现代临床医学生物工程学杂志,2001,7(1):7-8.
[14]Bilici M,Efe H,Koroglu Ma,etal.Antioxidative Enzyme Activities and Lipid Peroxidation in Major Depression:Alterations by Antidepressant treatments[J]. Journal of Affective Disorders,2001,64(1):43-51.
[15]Ge B,Chen L,Zhang Z M,etal. Antioxidativeactivity of 4-sulfonate-2,2,6,6-Tetramethylpiperidi-neoxyl in Tissues and Erythrocytes from Rats[J].Chinese Journal of Pharmacology and Toxicology,2001,15(1):47-50.
[16]Liu Chinfeng,PAN T M.Invitroeffects of lactic acid bacteria on cancer cell viability and antioxidant activity[J]. Journal of Food and Drug Analysis,2010,18(2):77-86.
[17]Kai T,Paul N,Tiiu K,etal. The influence of antibacterial and antioxidative probiotic Lactobacilli on gut mucosa in a mouse model of Salmonella infection[J]. Microbial Ecology in Health and Disease,2004,16(4):180-187.
[18]Lee J,HWang K,Chung M Y,etal. Resistance of Lactobacillus casei KCTC 3260 to reactive oxygen species(ROS):role for a metalion chelating effect[J]. Journal of Food Science,2005,70(8):388-391.
[19]郑晶泉.抗氧化剂抗氧化实验研究进展[J].国外医学:卫生学分册,2000,27(1):37-40.
[20]张凤敏,田丰伟,陈卫,等.具抗氧化活性乳酸菌的筛选[J].中国乳品工业,2007,35(2):4-7.
[21]刘天祎,潘道东.抗氧化活性乳酸菌的筛选[J].食品科学,2011,31(9):125-129.
