樟子松树皮多酚二次纯化及成分分析
2014-03-22,,,,,*
,,,,,*
(1.东北林业大学林学院,黑龙江哈尔滨 150040;2.哈尔滨工业大学食品科学与工程学院,黑龙江哈尔滨 150090)
植物多酚是一类广泛存在于植物体内的植物次生代谢物质,近年来,因其具有抑制心血管疾病、抗菌、抗病毒、抗氧化、抗肿瘤以及抗辐射等活性而备受关注[1]。最近研究发现松科植物体内含有大量的具有一系列独特的生物活性的多酚类化合物,这类物质统称为松多酚。松多酚的独特结构赋予了它一系列独特的化学性质,不仅使其成为一种色素类天然抗氧化剂[2],还使其具有抗肿瘤[3]、防治冠心病与中风等心脑血管疾病[4]、抗动脉硬化、降血脂降血糖[5-6]以及抗菌等多种生理功能。但由于松多酚难以实现大批量、高纯度的工业化生产,因此使其虽具有广阔的市场前景但不易实现市场化。
大孔树脂作为一类不溶于酸、碱和各种有机溶剂,具有较好吸附性的有机高分子聚合物,具有物理化学稳定性高、比表面积大、吸附量大、选择性好、吸附解析速度快、易于再生等优点[7-8],近年来被广泛用于多酚类以及黄酮类物质分离与富集[9-10]。目前,以大孔吸附树脂为固相介质的色谱分离纯化技术在植物功能性化学成分的分离、纯化以及富集中的应用日趋广泛[11-12]。
本研究对不同的树脂进行多酚静态吸附解析实验,选出最优树脂进行柱层析,建立樟子松树皮多酚二级纯化方法;并用HPLC-DAD-ESI-MS分析方法对纯化后的多酚成分进行了初步分析,为樟子松树皮多酚的开发利用提供实验基础。
1 材料与方法
1.1 材料与仪器
樟子松(PinussylvestrisL.)树皮收集于黑龙江哈尔滨,收集时间为2012年10月份,自然烘干至恒重后粉碎过40目筛,备用。
甲醇(色谱纯) 天津科密欧化学试剂有限公司;娃哈哈纯净水;大孔树脂D101、X-5、D3520、ADS-7、S-8、ADS-17、NKA-9、NKA-2、AB-8 天津海光试剂公司;其它所用化学试剂均为国产分析纯。
三孔电热恒温水槽DK-8D型 上海一恒科学有限公司;电子天平JA2003型 上海良平仪器仪表有限公司;可见分光光度计722型 上海光谱仪器有限公司;循环水式多用真空泵SHB-Ⅲ型 郑州长城科工贸有限公司;中药粉碎机FW135型 天津市泰斯特仪器有限公司;玻璃层析柱(2.5cm×70cm) 上海沪西分析仪器厂。安捷伦1200-6520高精度四级杆-飞行时间液质联用仪 美国安捷伦公司,配有四元泵、在线脱气机、自动进样器、紫外检测器和Chemstation数据工作站;Sino Chrom ODS-BP 反向色谱柱(5μm、4.6mm×150mm) 大连依利特。
1.2 实验方法
1.2.1 原料的制备 参考文献[13],称取一定质量的樟子松树皮粉末,以体积分数50%的乙醇作为溶剂,按料液比1∶25进行水浴浸提,水浴温度为50℃,浸提时间4h,将浸提液在4000r/min的条件下离心分离15min后减压浓缩蒸去乙醇,得到多酚粗提物;将上述粗提物在上样浓度3mg/mL,上样体积30mL,洗脱剂乙醇浓度为53%条件下进行一次纯化,控制上样流速5BV/h,洗脱流速4.25BV/h;收集纯化物,减压浓缩蒸去乙醇,得到樟子松树皮多酚一级纯化产物。
1.2.2 Folin-Ciocalteu法测定多酚
1.2.2.1 标准曲线的绘制 参考文献[14],精确称取(0.100±0.01)g没食子酸溶解并定容于100mL容量瓶中,配制成1000μg/mL的标准储备溶液;用移液管分别移取1.0、2.0、3.0、4.0、5.0、6.0、7.0mL的没食子酸标准储备溶液于100mL容量瓶中,用水定容至刻度,配制成浓度分别为10、20、30、40、50、60、70μg/mL的工作溶液。分别移取不同浓度的工作液各1mL于10mL棕色容量瓶中,分别加入5.0mL 10%福林酚试剂,摇匀,反应5min后加入4.0mL 7.5%的Na2CO3溶液并定容;置于25℃恒温水浴中反应1h,以蒸馏水作空白对照于765mm波长下测定吸光值。以没食子酸的质量浓度为横坐标,765nm波长下吸光值为纵坐标绘制标准曲线。
1.2.2.2 样品的测定 精确移取1mL样品溶液于10mL棕色容量瓶中,加入5.0mL 10%福林酚试剂,摇匀,反应5min后加入4.0mL 7.5%的Na2CO3溶液并定容;置于25℃恒温水浴中反应1h,以蒸馏水作空白对照于765mm波长下测定吸光值。根据标准曲线计算样品含量。
1.2.3 大孔树脂静态吸附解析筛选
1.2.3.1 大孔树脂预处理 将9种不同的大孔吸附树脂分别用无水乙醇浸泡24h后用蒸馏水冲洗至无醇味,再用质量分数4%的NaOH溶液浸泡24h,蒸馏水冲洗至中性后,用体积分数10%的HCl溶液浸泡24h,蒸馏水冲洗至中性备用。不同大孔树脂基本理化性质如表1所示。
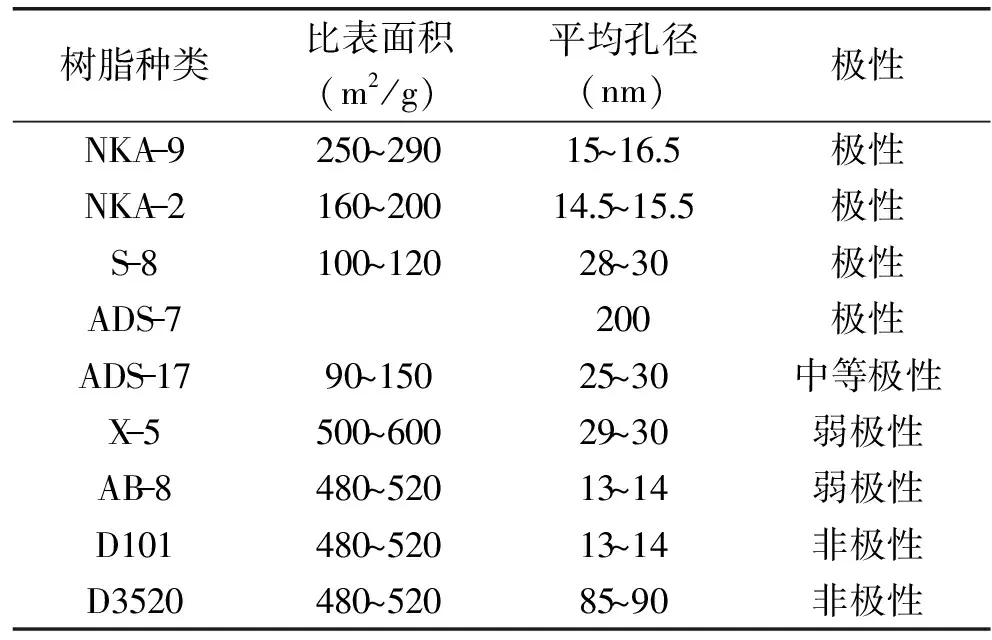
表1 9种大孔树脂理化性质Table 1 The physical and chemical properties of macroporous resins
1.2.3.2 树脂的静态吸附解析 根据李波等实验方法并加以改进[15]:分别取自然干燥的树脂每种5份,每份各2.0g于100mL锥形瓶中,加入50mL 2mg/mL的一级纯化液并于室温条件下恒温振荡器振荡吸附12h,吸取上清液测定多酚含量,并计算吸附率;将吸附后的树脂过滤,用蒸馏水冲洗后滤干,置于100mL锥形瓶中,向每种树脂的5份试样中分别加入体积分数40%、50%、60%、70%、80%的乙醇溶液50mL恒温振荡解析12h,吸取解析液测定多酚含量,计算解析率。比较不同大孔树脂的吸附率以及不同乙醇浓度下的解析率,确定柱层析最优树脂以及解析剂乙醇的浓度。
吸附率公式:E1(%)=(C0-C1)/C0×100
解析率公式:E2(%)=C2×V2/(C0-C1)V1×100
式中,E1-吸附率(%);E2-解析率(%);C0-起始多酚质量浓度(mg/mL);C1-达到吸附平衡时溶液中多酚质量浓度(mg/mL);C2-解析液中多酚质量浓度(mg/mL);V1-吸附液体积(mL);V2-解吸液体积(mL)。
1.2.4 柱层析二级纯化单因素工艺实验 玻璃层析柱内(2.5cm×70cm)按照不同径高比加入一定量筛选出的最优树脂,湿法装柱,于柱顶端以一定速度滴加入不同体积以及不同浓度的一级纯化液,吸附6h后,先用两倍柱体积的蒸馏水清洗,除去水溶性杂质,再用上述筛选出的最优浓度乙醇进行洗脱,控制不同流速于柱末端收集流出液,每5mL收集1管,测定每管中多酚的浓度(mg/mL)。绘制洗脱曲线,收集浓度最大的60mL。通过计算多酚回收率,并于40℃烘干后复溶,测定多酚含量,计算纯度,确定上样浓度、径高比、上样体积以及洗脱流速四个单因素对多酚二级纯化效果的影响,并确定最适宜纯化条件。
回收率公式:R(%)=C0V0/C1×V1×100
纯度公式:P(%)=C2×V2/W×100
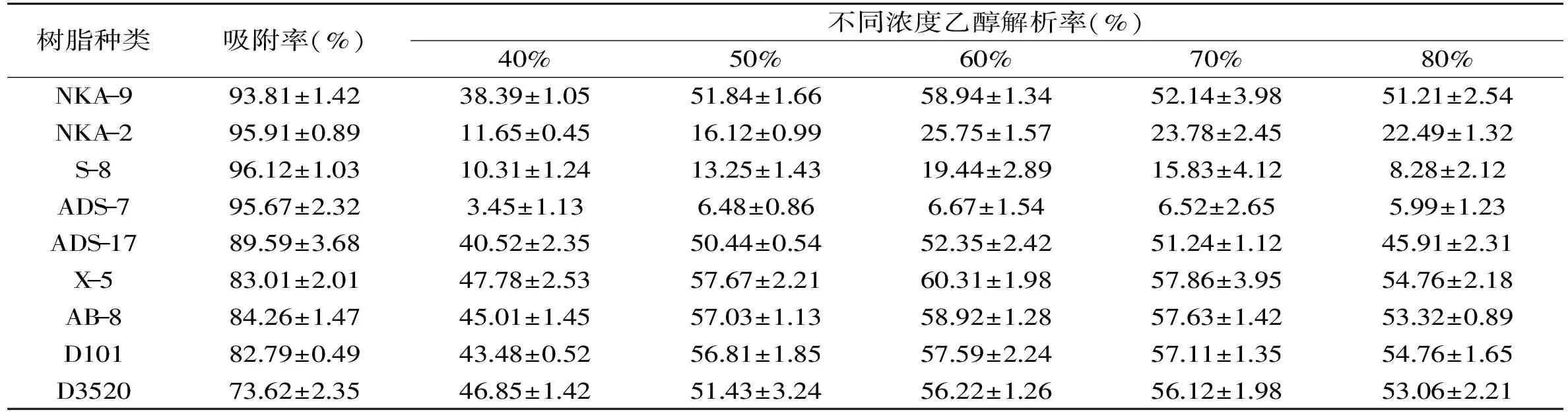
表3 9种大孔树脂对多酚的吸附解析率Table 3 The adsorption and resolution rate of macroporous resins
其中,R-多酚回收率(%);C1-上样的浓度;V1-上样的体积;C0-收集液体多酚的浓度(mg/mL);V0-收集液体的体积(30mL);P-多酚纯度(%);C2-复溶后多酚的浓度(mg/mL);V2-复溶时定容的体积(mL);W-烘干后的干物质重(mg)。
1.2.5 HPLC-DAD-ESI-MS法分析多酚二级纯化物成分
1.2.5.1 样品准备 取6mg烘干后的多酚粉末用2mL甲醇复溶,配制成浓度为3mg/mL的样品液,过0.45μm有机微滤膜,备用。
1.2.5.2 高效液相色谱条件 洗脱流动相组成为:溶剂A:水,溶剂B:甲醇溶液;流速为0.400mL/min;进样量为10μL;检测器为紫外检测器,检测波长为280nm;流动相洗脱程序采用混合溶剂梯度洗脱的方式见表2。
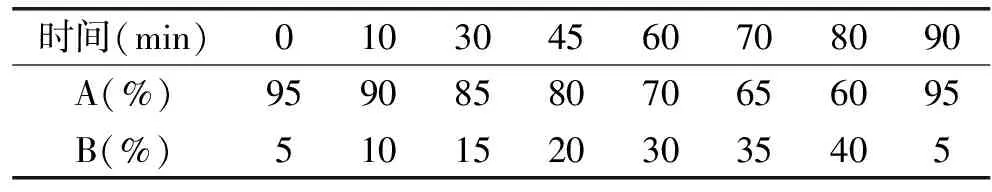
表2 流动相系统配比及梯度洗脱程序Table 2 Ratio of mobile phase and program of gradient elution
1.2.5.3 质谱分析条件 电喷雾电离源(ESI);离子源喷射电压3.5kV;离子源温度30℃;负离子检测模式;氮气为雾化气;载气流速11L/min;紫外检测器(DAD),检测波长280nm;全离子扫描方式,质量扫描范围100~3000amu;破碎电压100V。
1.2.6 数据分析 本研究所有进行实验均平行三次,数据表示为:结果±标准差;图像及图表分析均采用Excel(2007)、Design-expert(7.0)以及SAS(9.1)软件进行处理。
2 结果与分析
2.1 标准曲线的绘制
根据1.2.2方法测得没食子酸标准工作曲线方程为:y=0.01056x+0.0099,其中横坐标x为没食子酸质量浓度,纵坐标y为765nm下的吸光值。没食子酸质量浓度在0~70μg/mL内与其吸光值呈线性关系,相关系数R2=0.9997,表明线性关系良好。根据标准曲线方程按照1.2.4中纯度计算公式进行计算,得樟子松树皮多酚一级纯化产物纯度为62.06%±1.67%。
2.2 树脂的静态吸附解析
由于大孔树脂的极性、比表面积、平均孔径等理化性质的不同,其分离目标物质的效果也不同[16]。大孔树脂的吸附性能取决于吸附剂与吸附物质之间的氢键和范德华力,与其被吸附物的溶解度表面性质和孔结构等特性有关[17-18];9种树脂对树皮多酚的吸附率如表3所示:吸附效果较好的为极性以及中等极性的树脂,其中以S-8树脂为最好,吸附效果达到96.12%±1.03%;弱极性以及非极性的树脂吸附效果较差,其中以D3520树脂为最差,吸附效果仅有73.62%±2.35%;这可能是由于树皮多酚中含有较多的亲水酚羟基,但是含有一些疏水性结构,从而使其成为中等极性物质,易于被极性、中等极性树脂吸附[19]。
9种树脂对树皮多酚的解析率如表3所示:在相同乙醇浓度下,X-5树脂对多酚的解析效果最佳,这可能是与其具有较大的比表面积以及平均孔径有关;虽然NKA-2、S-8以及ADS-7三种树脂对于多酚吸附效果较好,但是解析效果却很差,分别仅达到11.65%±0.45%、10.31%±1.24%以及3.45%±1.13%,故考虑不适合做纯化树脂。9种树脂解析率均随着乙醇浓度的增加先增大后减小,当乙醇浓度为60%时解析率同时达到各自最大值,这可能是由于多酚类物质在植物体内通常与蛋白质、多糖等以氢键和疏水键形成稳定的物质,乙醇浓度较低时不足以破坏多酚类物质与其它物质的连接,导致洗脱下来的多酚较少;而乙醇浓度过高会溶出较多的亲脂性较强的杂质成分,这些成分会与多酚类化合物竞争同一乙醇水分子[20]。由于X-5树脂在不同浓度乙醇下对多酚的解析效果均优于其它树脂,且在乙醇浓度为60%时达到最佳为60.31%±1.98%,因此,选择X-5作为多酚二级纯化树脂,洗脱剂为60%乙醇。
2.3 动态洗脱曲线的绘制
根据1.2.4方法测得每管流出液多酚浓度,绘制洗脱曲线如图1所示:开始时流出液中多酚含量随着洗脱体积的增加而缓慢增大,当洗脱至第17管时,含量显著增大,当收集到第21管时流出液中多酚含量达到最大值4.57mg/mL,之后随着洗脱体积的增加,每管中多酚含量相对之前逐渐下降,28管后多酚含量相对较少,所以本实验收集17管到28管的60mL樟子松树皮多酚纯化液溶液进行后续实验。

图1 樟子松树皮多酚动态洗脱曲线 Fig.1 Dynamic desorption curve of Pinus sylvestris L. bark polyphenols
2.4 上样浓度对纯化效果的影响
当选定洗脱条件上样体积为40mL、径高比为1∶25以及洗脱流速为2BV/h时,上样浓度对樟子松树皮多酚纯度以及回收率的影响如图2所示:多酚的纯度随着上样浓度的增加先增大后减小,当上样浓度为4mg/mL时,多酚纯度达到最大值71.21%±1.97%,之后开始逐渐减小,这是由于当样品浓度较低时树脂主要吸附多酚类物质,随着浓度的增加,树脂的吸附量逐渐增大并趋于吸附平衡;当样品浓度再增大,树脂对与多酚竞争吸附的杂质的吸附也随之增加,因而使解析下来的物质中含有部分醇溶性杂质,导致纯度下降;回收率随着上样浓度的增加逐渐增大,当上样浓度为4mg/mL时,回收率达到78.12%±1.57%,之后随着浓度增加逐渐趋于平缓,因此确定4mg/mL为最适宜上样浓度。

图2 上样浓度对樟子松皮多酚纯度和回收率的影响 Fig.2 Effect of sample solution concentration on purity and recovery rate of Pinus sylvestris L. bark polyphenols
2.5 吸附柱径高比对纯化效果的影响
当选定洗脱条件为上样体积为40mL、上样浓度为4mg/mL以及洗脱流速为2BV/h时,径高比对樟子松树皮多酚纯度以及回收率的影响如图3所示:多酚的纯度随着径高比的增加先增大后减小,当径高比为1∶30时,多酚纯度达到最大值71.35%±2.22%,之后开始逐渐减小,这可能是由于随着径高比的增大,树脂与洗脱剂的相对接触面积增大,被吸附的多酚类物质与洗脱剂能够充分接触,洗脱效果逐渐增加,而当径高比过大时,洗脱剂在层析柱中流动时间过久,被解析的多酚类物质易于再次被树脂吸附,同时部分洗脱剂亦会对被吸附上的醇溶性杂质进行解析,从而降低了多酚类物质的纯度;而回收率随着径高比的增加变化不大,因此确定1∶30为最适宜径高比。
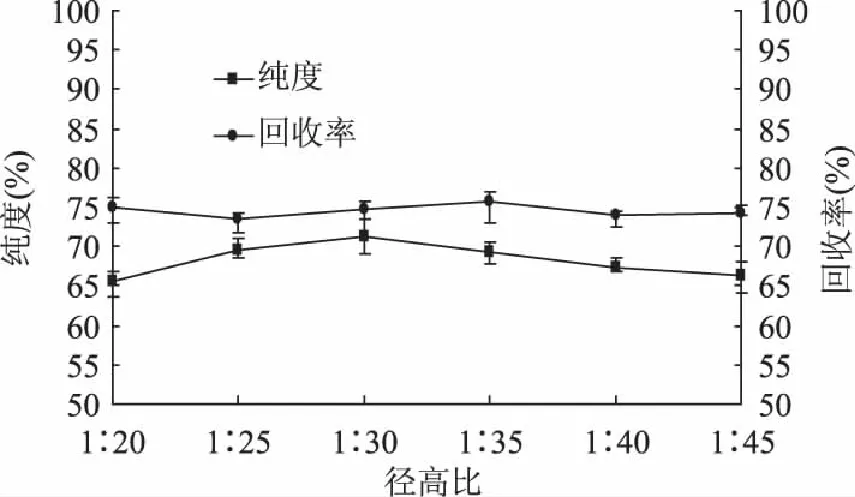
图3 径高比对樟子松皮多酚纯度和回收率的影响 Fig.3 Effect of diameter hight ratio on purity and recovery rate of Pinus sylvestris L. bark polyphenols
2.6 上样体积对纯化效果的影响
当选定洗脱条件为上样浓度为4mg/mL、径高比为1∶30以及洗脱流速为2BV/h时,上样体积对樟子松树皮多酚纯度以及回收率的影响如图4所示:多酚纯度随着上样体积的增加先增大后减小,当上样体积达到60mL时,多酚纯度达到最大值72.76%±1.53%;之后开始逐渐减小;当上样体积为60mL时,回收率达到最大值87.37%±1.18%,之后开始大幅度减小,这是因为随着上样体积的增加,树脂对多酚吸附逐渐达到饱和,当再增加上样体积时,会超过泄露点,部分溶液漏出,造成吸附不完全,因此确定60mL为最适宜上样体积。
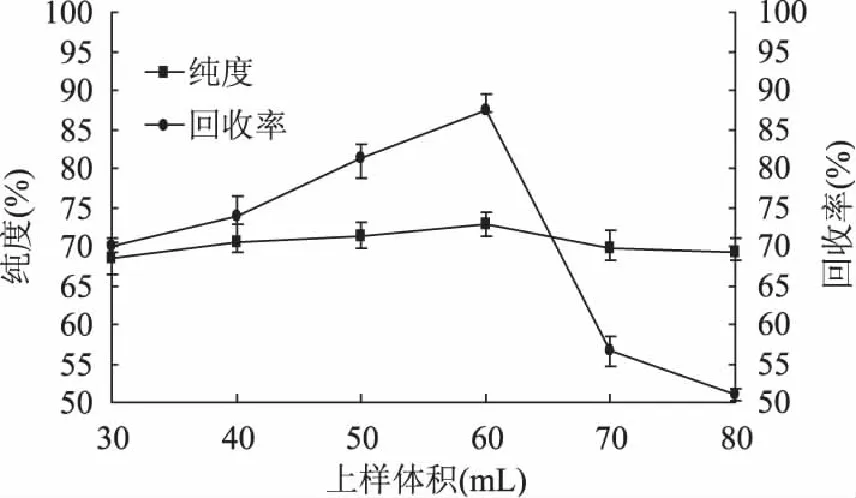
图4 上样体积对樟子松皮多酚纯度和回收率的影响 Fig.4 Effect of sample volume on purity and recovery rate of Pinus sylvestris L. bark polyphenols
2.7 洗脱流速对纯化效果的影响
当选定洗脱条件为上样体积为60mL、上样浓度为4mg/mL以及径高比为1∶30时,洗脱流速对樟子松树皮多酚纯度以及回收率的影响如图5所示:多酚纯度以及回收率随着洗脱流速的增加,变化趋势不明显,说明洗脱流速对于二者影响甚小;从节约试剂的角度考虑,选择2BV/h作为最适宜洗脱流速。
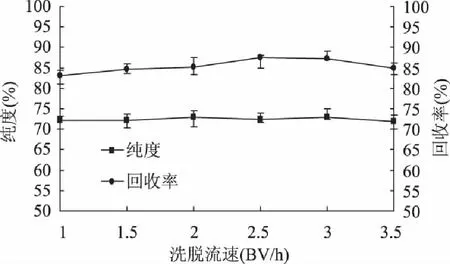
图5 洗脱流速对樟子松皮多酚纯度和回收率的影响 Fig.5 Effect of eluting speed on purity and recovery rate of Pinus sylvestris L. bark polyphenols
经过单因素实验分析比较,以多酚纯度以及回收率为指标得到的樟子松树皮多酚纯化最适宜条件为:上样浓度4mg/mL、径高比1∶30、上样体积60mL以及洗脱流速2.0BV/h,在此工艺条件下得到的树皮多酚纯度为72.99%±0.98%,回收率达到87.26%±2.42%。
2.8 二级纯化物主要成分的鉴定
按照1.2.4方法中最适宜条件得到的二级纯化物主要成分总离子流色谱图以及质谱图如图6、图7所示,通过质谱信息与国内外相关文献进行比较初步鉴定,得出物质信息见表4。
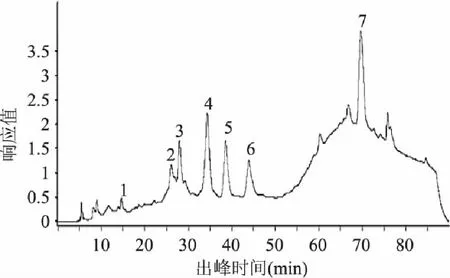
图6 二级纯化物主要成分色谱图 Fig.6 The chromatogram of main composition of secondary purification product
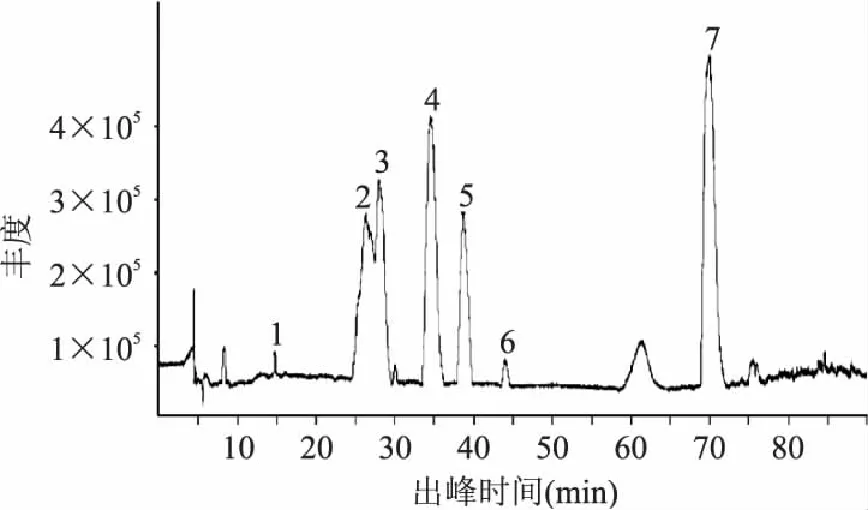
图7 二级纯化物主要成分总离子质谱图 Fig.7 The mass spectra of main composition of secondary purification product
如表4所示:1号峰的分子离子峰是865,该质谱信息与Laura M.Bystrom[21]研究的montgomery水果中含有的原花青素三聚体的信息是一致的。在苹果[22]中也发现过这种原花青素的三聚体;2号峰的分子离子峰是577,该质谱信息与原花青素二聚体B2是相同的[23-25],因此可以初步确定2号峰是原花青素二聚体B2;3号峰的分子离子峰是349,Dongmei Wang等人[26]研究的桂花香茶叶子中发现过类似信号峰;4号峰的分子离子峰是289,是典型的的表儿茶素信号峰,这与文献报道在原花青素二聚体被洗脱后,出现表儿茶素的情况是类似的[27]。7号峰的分子离子峰是303,初步判定为鞣花酸,这与M.C. Díaz-García等人[28]通过研究果汁建立的多酚类物质质谱库中出现的信息是一样的。
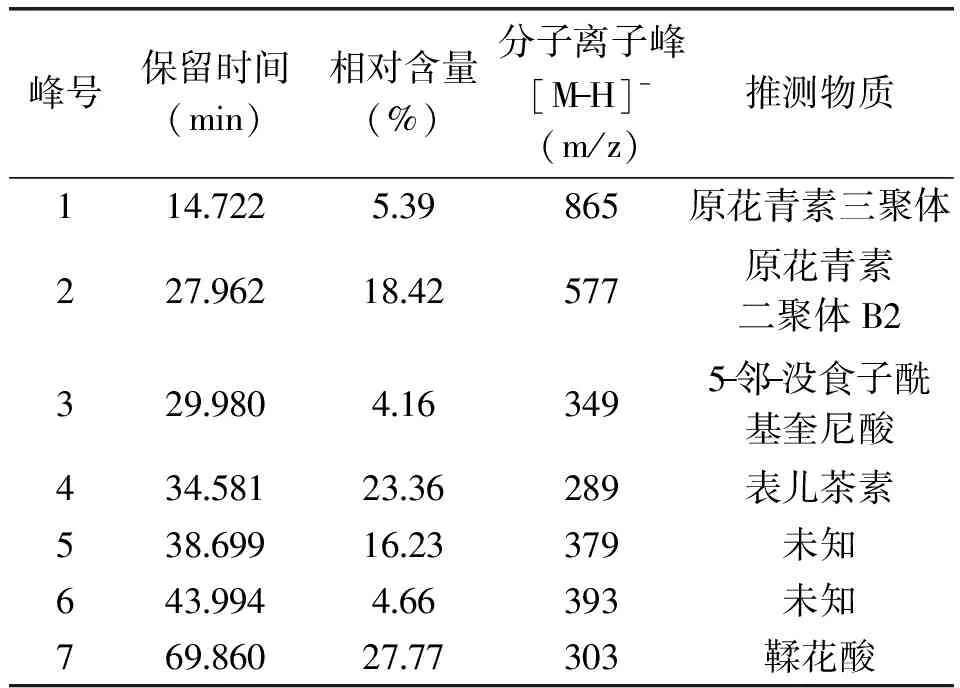
表4 二级纯化物主要成分质谱分析Table 4 The Mass spectrogram analysis of main composition of secondary purification product
3 结论
在溶液混合组分共存的体系中,X-5大孔树脂对樟子松树皮多酚吸附解析效果较好,当洗脱剂乙醇浓度达到60%时,解析率达到最佳60.31%±1.98%。
通过单因素实验得到最适宜条件为上样浓度4.0mg/mL,径高比1∶30,上样体积60mL,洗脱流速2BV/h。经X-5大孔树脂纯化,樟子松树皮多酚纯度由62.06%±1.67%提升到72.99%±0.98%。
通过HPLC-DAD-ESI-MS分析法初步确定樟子松树皮二级纯化物中主要成分可能为:原花青素三聚体、原花青素二聚体B2、5-邻-没食子酰基奎尼酸、表儿茶素以及鞣花酸。说明二级纯化物中主要为多酚以及原花青素类物质。
[1]林樱姬,赵萍,王雅.植物多酚的提取方法和生物活性研究进展[J]. 陕西农业科学,2009,55(6):105-107.
[2]赵海田,王振宇,程翠林,等. 松多酚类活性物质抗氧化构效关系与作用机制研究进展[J]. 食品工业科技,2012,33(2):458-461.
[3]T Y Hsu,S C Sheu,E T Liaw,etal.Anti-oxidant activity and effect of Pinus morrisonicola Hay.on the survival of leukemia cell line U937[J].Phytomedicine,2005,12(9):663-669.
[4]李健,杨昌鹏,李群梅. 植物多酚的应用研究进展[J].广西轻工业,2008(12):1-3.
[5]Ali Liazid,Monica Schwarz,Rosa M Varela,etal.Evaluation of various extraction techniques for obtaining bioactive extracts from pine seeds[J].Food and Bioproducts Processing,2010,88(2-3):247-252.
[6]M Pinelo,M Rubilar,J Sineiro,etal.Extraction of antioxidant phenolics from almond hulls(Prunes amygdalus)and pine sawdust(Pines pinaster)[J].Food Chemistry,2004,85(2):267-273.
[7]徐青,陆莹莹,辛健美,等. 大孔树脂吸附分离海芦笋中黄酮类化合物工艺[J]. 食品科学,2011,32(2):115-119.
[8]杜晓.大孔树脂技术在中草药分离纯化中的应用[J].青海大学学报,2012(1):62-65.
[9]熊何健,吴国宏.大孔树脂分离纯化葡萄多酚的研究[J].食品研究与开发,2007,128(11):74-77.
[10]周文亮,孙蕴哲,唐星.大孔树脂纯化柿叶总黄酮工艺考察[J].中国药剂学杂志,2008,6(5):276-282.
[11]H Li,J Liu,D Li,etal.Study on Separation and Purification of Genistein in the Soybean Residue Using Macroporous Resin Adsorption[J].Industrial & Engineering Chemistry Research,2012,51(1):44-49.
[12]X L Chang,D Wang,B Y Chen,etal.Adsorption and Desorption Properties of Macroporous Resins for Anthocyanins from the Calyx Extract of Roselle(Hibiscus sabdariffa L.)[J].Journal of Agricultural and Food Chemistry,2012,60(9):2368-2376.
[13]刘荣,何娇,王振宇.大孔树脂对樟子松树皮多酚纯化工艺的研究[J].食品工业科技,2013,34(11):201-205.
[14]赵玉红,翟亚楠,王振宇.樟子松树皮中松多酚的提取工艺研究及提取方法比较[J].食品工业科技,2013,34(4):304-309.
[15]李波,包怡红,王振宇.大孔树脂纯化红松松球鳞片多酚及其抗氧化活性研究[J].食品工业科技,2012,33(22):251-255.
[16]白夺龙,杨开华.大孔吸附树脂分离纯化技术及应用[J].海峡药学,2007,92(9):96-99.
[17]刘子放,王振江,唐翠明,等.桑根花青素的大孔树脂分离纯化[J].广东蚕业,2008,4(4):31-33.
[l8]何炳林,黄文强.离子交换与吸附树脂[M].上海:上海科技教育出版社,1995.
[19]朱静,陆晶晶,袁其朋.大孔吸附树脂对石榴皮多酚的分离纯化[J].食品科技,2010,35(l):188-193.
[20]耿中华,秦卫东,马利华,等. 梨皮多酚的提取工艺优化的研究[J]. 食品工艺科技,2009,30(12):233-238.
[21]Laura M Bystrom,Betty A LEWIS,Dan L Brown,etal.Characterisation of phenolics by LC-UV/Vis,LC-MS/MS and sugers by GC in Melicoccus bijugatus Jacq. ‘Montgomery’fruits[J].Food Chemistry,2008,111:1017-1024.
[22]Toshihiko Shoji,Saeko Masumoto,Nina Moriichi,etal. Apple(Malus pumila)procyanidins fractionated according to the degree of polymerization using normal-phase chromatography and characterized by HPLC-ESI/MS and MALDI-TOF/MS[J].Journal of chromatography A,2006,1102:206-213.
[23]Maarit K,Jyrki L,Vladimir O,etal.Analysis of procyanidins in pine bark with reversed-phase and normal -phase highperformance liquid chromatography-electrospray ionization mass spectrometry[J].Analytica ChimicaActa,2004,522:105-112.
[24]Oischlacer C,Regos I,Zeller F J.etal.Identification of galloylated propelargonidins andprocyanidins in buckwheat grain and quantification of rutin and flavanols homostylous hybrids originating from F.esculentum×F.homotropicum[J]. Phytochemistry,2008,69:1389-1397.
[25]Laurent Hollecker,Maurizio Pinna,Gioraia Filippino,etal. Simultaneous determination of polyphenolic compounds in red and white grapes grown in Sardinia by high performance liquid chromatography-electron spray ionization-mass spectrometry[J].Journal of Chromatography A,2009(2):10-12.
[26]Dongmei Wang,Jiali Liu,Aiqing Miao,etal.HPLC-DAD-ESI-MS/MS analysis of polyphenols and purine alkaloidsin leaves of 22 tea cultivars in China[J]. Journal of Food Composition and Analysis,2008(21):361-369.
[27]Marin Prodanoy,Ignacio Garrido,Visitacion Vacas,etal. Ultrafiltration as alternative purification procedure for the characterization of low and high molecular-mass phenolics from lmond skins[J]. Analytica Chimica Acta,2008,609:241-251.
[28]M C Díaz-García,J M Obón,M R Castellar,etal.Quantification by UHPLC of total individual polyphenols in fruit juices[J]. Food Chemistry,2013(138):938-949.
