南极磷虾抗氧化多肽制备的研究
2014-03-22,,,
,, ,
(上海海洋大学食品学院,上海 201306)
南极磷虾是一个巨大的蛋白资源,并且被认为具有很大的药用前景,波兰和前苏联有文献称磷虾为健康食品,并且用南极磷虾来治疗动脉硬化和降低血液中胆固醇的含量。在磷虾体内发现了各种有用的化学物质,有几种经研究被认为具有商业开发的价值[1]。对于我国这样一个自然资源相对贫乏的人口大国来讲,对南极磷虾的综合开发利用具有重要的战略意义。
抗氧化肽属生物活性肽的一种。不仅具有多肽产品的营养作用,而且具有抗氧化和清除自由基的功能,可增强人体抗衰老、抗疾病能力。目前市场上的抗氧化剂大多为人工合成的,例如维生素C、维生素E,作用效果好,但化学合成物质存在着安全隐患,它在清除自由基的同时也对人体的组织或器官产生副作用。研究表明,许多动植物的水解蛋白和氨基酸都有抗氧化性[2]。分子量在3~10ku的磷虾多肽比天然抗氧化剂维生素E的清除自由基能力强[3]。南极磷虾多肽不仅可以加工成营养补充剂,而且也可以作为制备抗氧化、抗衰老的保健品或化妆品的原料,具备广阔的开发利用潜力[4]。因此,无副作用的生物活性肽更具优势。然而,南极磷虾抗氧化多肽的生产缺乏技术基础,抗氧化多肽提取耗时久、得率低、效果差、成本高,导致现在市场上抗氧化多肽产品处于初级开发阶段[5]。本实验旨在基于国内外对抗氧化性多肽分子结构、分子大小与抗氧化生理功能联系的研究,达到短时、高产率、低成本水解出具有较强抗氧化功能的南极磷虾多肽,为抗氧化南极磷虾多肽产品的进一步开发、生产奠定基础。
1 材料与方法
1.1材料与仪器
冷冻的南极磷虾 2012年3月捕于南极FAO 48.2区;中性蛋白酶 19630U/g,上海源叶生物科技有限公司;胰蛋白酶 174850U/g,上海生物技术公司;三氯化铁 天津市博迪化工有限公司;水杨酸 天津市博迪化工有限公司;硫酸亚铁 上海第二钢铁厂;DPPH自由基 Sigma公司;抗超氧阴离子自由基与产生超氧阴离子自由基测试盒 南京建成生物科技研究所;SDS-聚丙烯酰胺凝胶电泳低分子量标准蛋白质 上海源叶生物科技有限公司;三羟甲基氨基甲烷 上海维编科贸有限公司;SDS sino-American biotechnology公司;碳酸钠、氢氧化钠、三氯乙酸(TCA)、四甲基乙二胺、过硫酸铵、丙烯酰胺等 国药集团,分析纯。
RO-NF-UF-4100型膜分离装置、中空纤维式超滤组件:外压式PS-5,内压式PS-10,PES-3 卷式超滤组件 上海摩速科学器材有限公司;GL-20G-II冷冻离心机 上海安亭科学仪器厂;UNICO UV-2000紫外可见分光光度计 北京谱析通用仪器有限责任公司;真空冷冻干燥器 CHRIST ALPHA1-2,北京博劢行仪器有限公司;DYCZ-24D垂直板电泳槽 北京市六一仪器厂;DYY-III稳压稳流电泳仪 北京市六一仪器厂。
1.2实验方法
1.2.1 南极磷虾蛋白水解物的制备 参照迟海[6]等方法,将冷冻的南极磷虾装入保鲜袋封口,用冷水解冻,称取一定量解冻的南极磷虾于Tris-缓冲液(0.05mol/L,pH7.5)中,料液比(w/v)为1∶2[3],均质1min,加入复合酶(中性蛋白酶∶胰蛋白酶=1∶1)[7],置于45℃恒温水浴保温6h,酶解结束后,100℃灭酶10min。冷却后,4℃ 11000r/min离心20min,取上清液测其抗氧化活性。
1.2.2 抗氧化能力的测定
1.2.2.1 样品的抗超氧阴离子自由基能力 方法参照测试盒说明书。
1.2.2.2 样品清除DPPH自由基的能力参考文献[9] 取0.2mL待测液和1.8mL无水乙醇于10mL试管中,然后加入2.0mL浓度为0.2mmol/L的DPPH·无水乙醇溶液,手振荡使其混合均匀,室温下反应20min,在4℃、转速为5000r/min离心10min,然后在517nm波长处用分光光度计测上清液的吸光值为Ai;取0.2mL待测液和1.8mL无水乙醇于10mL试管中,加入2.0mL无水乙醇,手振荡使其混合均匀,室温下反应20min,在4℃、转速为5000r/min离心10min,然后在517nm波长处用分光光度计测上清液的吸光值为Aj;参比为2.0mL浓度为0.2mmol/L的DPPH·无水乙醇溶液和2.0mL无水乙醇的混合反应液,手振荡使其混合均匀,室温下反应20min,在4℃、转速为5000r/min离心10min,然后在517nm波长处用分光光度计测上清液的吸光值A0。
待测液对DPPH自由基的清除率的计算公式为:
K(%)=[1-(Ai-Aj)/A0]×100
1.2.2.3 样品清除羟基自由基能力 在10mL试管中加入1.5mL的待测液,然后依次加入0.3mL浓度为 6mmol/L的FeSO4,1.5mL浓度为6mmol/L的水杨酸,用蒸馏水补齐至4.8mL,摇匀,最后加入0.3mL浓度为6mmol/L的H2O2启动反应,静置10min后于510nm处测定吸光度。考虑到提取液本身的吸光值,做试样空白,测出扣除试样空白的吸光度,同时测定空白对照液的吸光度。
清除率(%)=(A0-A1+A2)/A0×100
其中:A0为未加提取液时溶液的吸光度;A1为加提取液后溶液的吸光度;A2为提取液的吸光度。
1.2.3 超滤分离 将南极磷虾蛋白酶解液离心,取上清液,经10ku超滤膜(PS-10中空纤维组件)截流分离,保留浓缩液;将滤液再经5ku超滤膜(PS-5中空纤维组件)截流分离,保留浓缩液;将滤液再经3ku超滤膜(PES-3 卷式超滤组件)截离,保留浓缩液;将滤液再经0.5ku纳滤膜(卷式组件)截离,保留浓缩液和滤液。超滤过程保持组件最大工作压力不超过0.15MPa,纳滤不要超过0.4MPa,依次制备分子量为10ku以上、5~10、3~5、0.5~3、0.5ku以下的南极磷虾多肽溶液。然后将各部分溶液进行真空冷冻干燥,分别测定其抗氧化活性。
1.2.4 tricine-SDS-PAGE电泳 配制15.5%的分离胶、10%的夹层胶和4%的浓缩胶。制作凝胶板,先制备分离胶,聚合后,再制备夹层胶,最后制备浓缩胶,三种胶长度比例为4∶1.5∶1,上样量:浓度为300mg/mL的样品8、12μL,打开电源,将电压调至30V电泳1h,待样品进入分离胶后,将电压调至100V,待染料前沿迁移至距硅胶框底1~1.5cm处,停止电泳,一般需要4~6h,电泳结束后,剥胶,将胶放在大培养皿内,用固定液固定20min,染色20~30min,漂洗。
2 结果与讨论
2.1酶解条件的筛选
本实验选用复合酶在pH7.5,温度45℃,料液比(m/v)为1∶2的条件下,改变时间,对南极磷虾蛋白进行酶解。采用抗氧化活性大小为指标,确定最适合的酶解时间,改变了以往国内在活性肽生产工艺上先测水解度,再做常规活性测定[12]的方法。
2.1.1 清除超氧阴离子自由基能力的测定 超氧阴离子自由基是生命代谢中对生物体危害很严重的一种自由基,清除超氧阴离子自由基的能力是检测样品抗氧化性的重要指标。
图1显示,南极磷虾蛋白酶解液清除超氧阴离子自由基的能力大于未经酶解的南极磷虾蛋白的清除能力,且在1、4h时酶解液清除超氧阴离子自由基的能力达到较大值,约为未酶解南极磷虾蛋白的1.71倍,之后逐渐变小,但在2h时清除率下降,可能是蛋白酶解得到多肽,随着酶解时间的增加,其肽段断裂,产生氨基酸残基,掩盖了具有清除超氧阴离子自由基的某些氨基酸末端的活性基团或活性位点,使其清除率突然下降。因此经1或4h酶解,可得到对超氧阴离子自由基有较强清除能力的南极磷虾多肽。
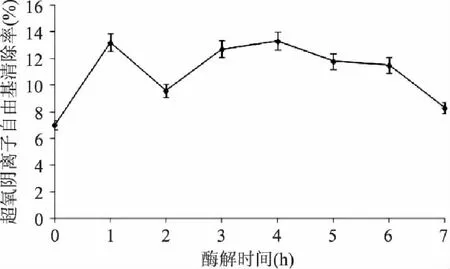
图1 酶解物的超氧阴离子自由基清除能力 Fig.1 The scavenging effects of zymolyte on superoxide anion free radical
2.1.2 清除DPPH自由基能力的测定 DPPH·是一种很稳定的氮中心的自由基,它的稳定性主要来自3个苯环的共振稳定作用及空间障碍,使夹在中间的氮原子上不成对的电子不能发挥其应有的电子成对作用。作为一种稳定的自由基,DPPH·可以捕获其他的自由基。有自由基清除剂存在时,DPPH·的单电子被捕捉而使其颜色变浅,在最大光吸收波长处的吸光值下降,且下降程度呈线性关系,从而以评价实验样品的抗氧化能力[11]。
图2表明,南极磷虾蛋白酶解液清除DPPH自由基的能力大于未经酶解的南极磷虾蛋白清除能力,且在酶解6h时酶解液清除DPPH自由基的能力达到最大,为未酶解南极磷虾蛋白的3.17倍,之后逐渐变小。因此经6h酶解,可得到对DPPH自由基有较强清除能力的南极磷虾多肽。
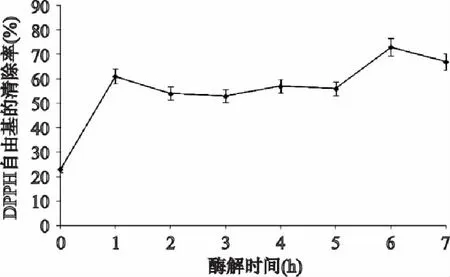
图2 酶解物的清除DPPH·能力 Fig.2 The scavenging effects of zymolyte on DPPH·
2.1.3 清除羟基自由基能力的测定 自由基是引起人类衰老和许多疾病的重要因素,例如癌症、多发性硬化症、帕金森疾病、免疫系统疾病等,羟基自由基是人体内最主要的自由基,其消除率是反映药物抗氧作用的重要指标[10]。
图3显示,南极磷虾蛋白酶解液清除羟基自由基的能力大于未经酶解的南极磷虾蛋白清除能力,且在酶解6h时酶解液清除羟基自由基的能力达到最大,为未酶解南极磷虾蛋白的1.57倍,之后逐渐变小。因此经6h酶解,可得到对羟基自由基有较强清除能力的南极磷虾多肽。
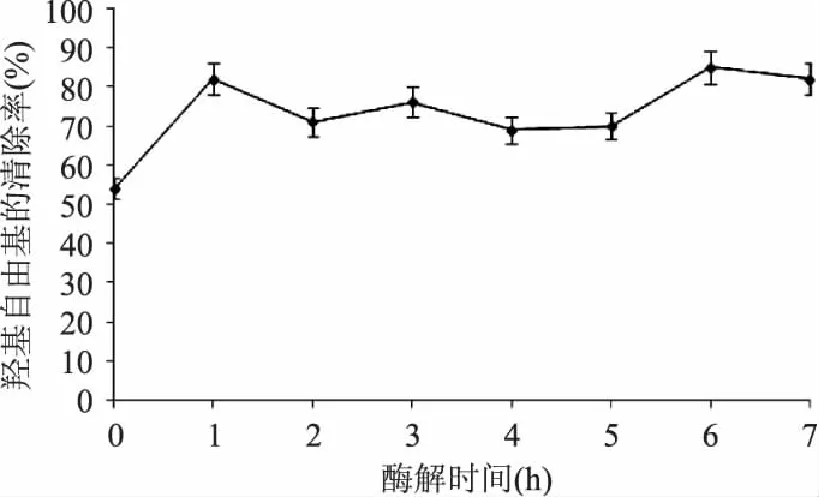
图3 酶解物的清除羟基自由基能力 Fig.3 The scavenging effects of zymolyte on hydroxyl free radical
以清除超氧阴离子自由基、DPPH自由基和羟基自由基为指标,在复合酶的最适酶解条件下,南极磷虾蛋白经1h或6h酶解,制得的多肽表现出的清除自由基的能力较强,但在确定的pH、温度、酶量、底物的条件下,增加酶解时间,减少原料浪费,底物酶解的较充分,多肽的产率也增高,满足实际生产的要求;蛋白酶解6h,多肽表现出最强的清除三种自由基的能力。对超氧阴离子自由基的清除率达到11.5%,对DPPH·的清除率达到72.7%,对羟基自由基的清除率达到84.8%。
2.2超滤分离
对分子量为10ku以上、5~10、3~5、0.5~3、0.5ku以下5部分的南极磷虾多肽分别取相同体积8mL(浓度均为20mg/mL),进行抗氧化能力测定。
由图4可以看出,超滤分离的样品中,随着分子量从大到小的变化,样品的清除超氧阴离子自由基的能力、DPPH自由基的能力、羟基自由基的能力都是先增大后减小,在样品浓度相同的情况下,超氧阴离子自由基清除率最低,羟基自由基清除率高于DPPH自由基清除率,但分子量在5~10ku部分的DPPH自由基清除率达到最高;分子量在5~10ku部分对DPPH自由基的清除能力、羟基自由基的清除能力、超氧阴离子清除能力都高于其他部分,对DPPH自由基的清除率达到95%,羟基自由基的清除率达到89%,超氧阴离子自由基的清除率达到53.5%。
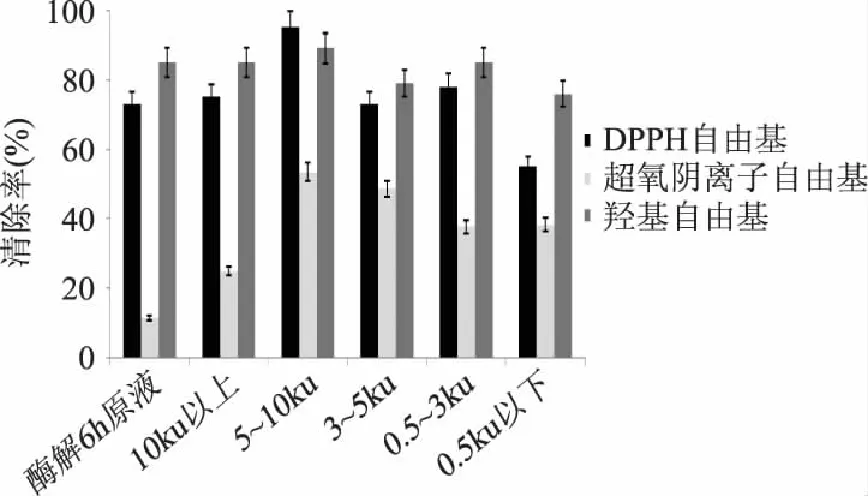
图4 不同分子量南极磷虾多肽的抗氧化能力 Fig.4 The antioxidant ability of antarctic krillpolypeptide with different molecular weight
王立才[15]等人研究了小麦胚芽多肽,其抗氧化活性随分子量的降低而升高,分子量在2ku以下肽段的生物活性较高。而南极磷虾多肽分子量在5~10ku部分的抗氧化活性最高,取4mg测其对DPPH自由基的清除率,比李明杰[3]等人的研究结果高约28%。一般情况下,物质的抗氧化能力与其供氢体有关,关于多肽的抗氧化活性可能与组氨酸有关[16]。
2.3tricine-SDS-PAGE电泳
图5为取截留在5~10ku后南极磷虾多肽tricine-SDS-PAGE电泳图谱,结果出现了两个条带,分子量约为12250ku和4609ku,其未分布在膜的分子量范围内,主要是不同厂家生产的标示相同的截留分子质量的膜,对同一溶质的截留率不一定相同,选择膜不能只看分子质量,还要根据实践确定[17];另外,膜的寿命有限,而且在一定情况下随着操作的选择性不断下降,其处理能力也不断地、缓慢地下降。这被认为是膜分离方法的致命弱点[18]。要获得高效的南极磷虾抗氧化活性多肽,需对截留后样品进一步分离纯化。

图5 5-10ku南极磷虾多肽tricine-SDS-PAGE电泳结果 Fig.5 The tricine-SDS-PAGE electrophoresis results of antarctic krillpolypeptide of 5~10ku
3 结论
3.1选择复合酶(中性蛋白酶∶胰蛋白酶=1∶1),在pH7.5,温度45℃,料液比(m/v)为1∶2的条件下,酶解6h,得到具有较高抗氧化活性的南极磷虾多肽。
3.2南极磷虾蛋白酶解液的抗氧化能力大于未经酶解的南极磷虾蛋白的抗氧化能力,抗超氧阴离子清除率为1.71倍,DPPH自由基的清除率为3.17倍,羟基自由基的清除率为1.57倍。
3.3抗氧化的南极磷虾多肽经截流处理后,分子量在5~10ku部分表现出较强的抗氧化能力。对抗超氧阴离子的自由基的清除率达到53.5%,对DPPH自由基的清除率达到95%,对羟基自由基的清除率达到89%。
3.4由于超低分子量多肽,极易从凝胶上侵出,因此染色及脱色时间不宜太长,脱色后凝胶也不宜在水中浸泡保存过久,否则条带会消失。
3.55~10ku部分的南极磷虾多肽,对其进行tricine-SDS-PAGE电泳,结果出现两个条带。主要由分子量为12250ku和4609ku的多肽组成。
[1]孙松,严小军.开发南极磷虾生物资源[C]. 2002年中国·青岛海洋科技与经济发展国际论坛.青岛:2002.254-258.
[2]冯永财,赵晓丹,刘涛.大豆肽的生理及加工特性分析[J].哈尔滨商业大学学报:自然科学版,2003,19(1):90-92.
[3]李明杰,姜国良,赫佳明.南极磷虾肽制备工艺优化及抗氧化测定[J].食品工业科技,2012,33(3):279-301.
[4]王亚恩.南极磷虾油脂降血脂、抗氧化力及其改善记忆力功能实验研究[D].青岛:中国海洋大学,2011.
[5]郑建仙.活性肽和蛋白质生产-关键技术与典型范例[M].北京:科学技术文献出版社,2006:60-62.
[6]迟海,杨峰,李学英,等.不同解冻方式对南极磷虾品质的影响[J].现代食品科技,2011,27(11):1291-1295.
[7]赵玲,曹荣,刘淇,等.南极磷虾酶解多肽的抑菌活性[J].渔业科学进展,2011,32(4):112-116.
[8]Oyaizu M.Studies on products of browning reaction:Antioxidative activities of products of browning reaction prepared from glucosamine[J].Jap J Nutr,1986,44:307.
[9]郭雪峰,岳永德,汤峰,等.用清除有机自由基DPPH法评价竹叶提取物抗氧化能力[J].光谱学与光谱分析,2008,28(7):1578-1582.
[10]颜军,苟小军,纪小明,等.分光光度法测定Fenton反应产生的羟基自由基[J].成都大学学报,2009,28(2):91-93.
[11]柳爱莲,刘绣华.天然产物抗DPPH自由基活性研究[J].周口师范学院学报,2007,24(5):80-82.
[12]宋金翠,孟宪军,陕方,等.关于蛋白质水解生产活性肽物质的思考[J].食品工业科技,2005,26(11):185-187.
[13]刘欣.食品酶学[M].北京:中国轻工业出版社,2006.53-64.
[14]冮洁,王文侠,栾广忠.大豆深加工技术[M].北京:中国轻工业出版社,2004.358-376.
[15]王才立,张志国,王成忠,等.不同分子质量小麦胚芽多肽的体内抗氧化活性[J].食品科学,2013,34(7):275-278.
[16]Chen H M,Muramoto K,Yamaguehi F,etal.Antioxi-dative Properties of histidined from peptide fragments found in the digests of a soybean protein[J].Journalof Agriculturaland Food Chemistry,1998,46:49-53.
[17]杨义芳.中药与天然活性产物分离纯化和制备[M]. 北京:中国轻科学出版社,2011:434-458.
[18]刘茉娥.膜分离技术应用手册[M]. 北京:化学工业出版社,2001.2-28.
