不同干燥方法对山银花促褐变酶活性和活性成分的影响
2014-03-22建华
,, , ,建华,, ,*
(1.食品科学与工程学院,山东农业大学,山东泰安 271018;2.山东省分析测试中心,山东省科学院,山东济南 250014;3.贵州省理化测试分析研究中心,贵州省科学院,贵州贵阳 550002)
山银花(LoniceraeConfusae)为忍冬科植物灰毡毛忍冬(LoniceramacranthoidesHand.-Mazz.)、红腺忍冬(LonicerahypoglaucaMiq.)、华南忍冬(LoniceraconfusaDC.)或黄褐毛忍冬(LonicerafulvotomentosaHsuet et S.C.Cheng)的干燥花蕾或初开的花,夏初花开放前采收、干燥[1]。山银花具有清热解毒和凉风散热的作用,是重要的饮品原料[2]。山银花在医药、保健、食品等领域的消费量逐年增加,市场供不应求。通过近年来实验研究,山银花主要活性成分为黄酮类、有机酸、挥发油、皂苷类等多个种类化学成分[3],在褐变相关酶的作用下,干燥过程中极易发生褐变,其中不同的干燥加工工艺也可直接影响山银花的外观和质量[4]。常用的干燥方法有阴干法、烘干法、微波干燥法等,通常以绿原酸、木犀草苷含量作为山银花干燥加工方法的评价指标[5-6]。
植物酶促褐变现象的产生主要是由于其所含的酚类化合物等在多酚氧化酶(Polyphenol Oxidase,PPO)和过氧化物酶(Peroxidase,POD)的催化条件下进行醌式化反应,再进一步聚合生成黑色素造成的[7-8]。褐变相关酶广泛分布于各种生物体中,它引起褐变,造成品质降低,影响营养成分及利用价值。因此,干燥过程中的褐变,对产品外观和活性成分的含量都有着重要影响。然而,目前针对不同干燥方法对山银花褐变相关酶学活性及活性成分含量变化的影响尚未见报道。
本研究通过不同干燥方式处理后的山银花酶活性及总黄酮、总酚、绿原酸、木犀草苷含量的测定,探讨了干燥方式对山银花酶活性和活性成分的影响,为选择适宜的加工干燥方法,避免山银花干燥过程中的褐变和活性成分损失,提高山银花品质提供依据。
1 材料与方法
1.1 材料与仪器
山银花 2013年6月份采自山东省临沂市平邑县,为灰毡毛忍冬(LoniceramacranthoidesHand.-Mazz.),用不同方法进行干燥,备用;绿原酸、木犀草苷 由山东省分析测试中心自制,纯度大于99%;乙腈(色谱纯) 购自美国TEDIA试剂公司;芦丁、没食子酸、愈创木酚 购自国药集团化学试剂有限公司;L-dopa、TritonX-100 购自上海源叶生物有限公司;Tris、PVP 购自美国sigma公司;实验用水 为娃哈哈纯净水。
Agilent 1120型高效液相色谱仪 美国Agilent公司;722E型紫外可见分光光度计 上海光谱仪器有限公司;GZX-9140数显鼓风干燥箱 上海博讯实业有限公司;YZWZ-3型真空微波干燥仪 南京研正微波设备厂。
1.2 实验方法
1.2.1 山银花不同干燥方法 分别取10.00g鲜样山银花,通过不同干燥方法处理后,观察外观性状及干燥后重量变化,实验均重复三次。
1.2.1.1 阴干 将山银花平铺于纸上,放在室内通风处阴干76h,样品恒重。
1.2.1.2 恒温鼓风干燥 将山银花均匀放在电热恒温鼓风干燥箱中,35℃下鼓风干燥处理24h,样品恒重。
1.2.1.3 真空微波干燥 将山银花均匀铺在真空微波干燥箱中,设定微波功率3kW,70℃条件下干燥10min。
1.2.2 多酚氧化酶(PPO)活性测定 称取不同干燥方法处理后样品各1.00g,用10mL 20mmol/L Tris-HCl缓冲液(pH 7.5)冰浴研磨提取,其中包含3%(w/v)TritonX-100 和 1%(w/v)PVP。提取物在4℃条件下以10000×g离心10min,收集上清液作为粗酶液待测。酶学反应以L-dopa为底物,反应体系中包括2.95mL 5mmol/L L-dopa(20mmol/L Tris-HCl缓冲液配制)和0.05mL粗酶液。室温下反应20min后,紫外分光光度仪测定在475nm吸光度A的变化,以每分钟变化0.01为1个酶活性单位。所有实验均重复三次,结果取平均值[9]。
1.2.3 过氧化物酶(POD)活性测定 称取不同干燥方法山银花各1.00g,粗酶液提取方法同1.2.2,得粗酶液待测。酶学反应以愈创木酚为底物,反应体系中包括2.95mL 10mmol/L 愈创木酚及10mmol/L H2O2溶液(20mmol/L Tris-HCl缓冲液配制,pH 7.5)和0.03mL粗酶液。室温下反应20min后,紫外分光光度仪在470nm下比色,测定吸光度A值的变化,以每分钟A470变化0.01为1个酶活性单位。所有实验均重复三次,结果取平均值[10]。
1.2.4 总酚含量测定 精密称取不同干燥方法处理后样品各1.00g,加40mL 50%乙醇研磨提取后,置于50mL离心管中,超声提取30min后,提取液在10000×g离心10min,过滤后定容250mL容量瓶中,取上清液作为待测液[11]。
测定方法:定量移取0.1mL上述提取液于5mL比色管中,加入500μL福林酚试剂,反应3min后,加入3mL 6% Na2CO3溶液,用蒸馏水稀释至5mL,摇匀、避光保存2h。以试剂为空白,在760nm测定吸光度值,所有实验均重复三次,结果取平均值。
标准曲线的建立:精密称取0.0100g没食子酸,溶解定容于100mL的容量瓶中,得0.1mg/mL的没食子酸标准溶液。分别移取0.10、0.15、0.20、0.25、0.30、0.4、0.5mL没食子酸标准溶液于5mL的比色管中,使用上述测定方法测定没食子酸标样的标准曲线。
1.2.5 总黄酮含量测定[12]提取方法同1.2.4。
测定方法:移取0.25mL上述提取液于5mL比色管中,分别加入1.5mL 30%乙醇和0.15mL 5% NaNO2溶液,摇匀放置5min;然后加0.15mL 10% Al(NO3)3溶液,摇匀放置6min;后加入1mL 4% NaOH溶液,混匀,用30%乙醇稀释至刻度。以试剂为空白,用1cm比色皿于510nm处测定吸光度值A,依据标准曲线方程计算出不同干燥方法中样品黄酮含量。所有实验均重复三次,结果取平均值。
标准曲线的建立:以芦丁标样进行总黄酮含量的测定,精确称取0.0100g芦丁标样,溶解定容于100mL的容量瓶,得0.1mg/mL芦丁标准溶液。按上述方法测定,移取标准样品1.00、2.00、2.50、3.00、3.50、4.00、4.50mL测芦丁标准曲线。
1.2.6 绿原酸与木犀草苷含量测定 提取方法同1.2.4,取上清液过0.45μm滤膜。采用HPLC检测绿原酸和木犀草苷含量。色谱柱:Agilent TC C18(4.6mm×250mm,5μm);流动相:A为0.2%甲酸溶液,B为乙腈;柱温:25℃;流速:1.0mL min-1;检测波长:280nm;进样量:20μL;洗脱梯度为:0~10min,8%~10% B;10~20min,10%~15% B;20~30min,15%~15% B;30~40min,15%~25% B;40~50min,25%~30% B;50~55min,30%~100% B;55~65min,100% B。
绿原酸、木犀草苷标准曲线的建立:配制绿原酸、木犀草苷浓度分别为0.50mg/mL和0.24mg/mL的对照品混合溶液。进样量分别为2、4、6、8、10μL,按上述HPLC条件进行分析。
1.2.7 数据处理 结果采用“SPSS 13.0”统计软件进行数据相关性分析,Excel软件绘图制表。
2 结果与讨论
2.1 不同干燥方法对山银花外观性状的影响
分别采用真空微波干燥、恒温鼓风干燥、阴干干燥方法干燥处理山银花,样品外观性状见表1。未干燥之前鲜样外观呈绿色,通过不同的干燥方法对其处理后外观性状显现不同。真空微波干燥进行速度快,干燥后呈绿色,干燥对其外观性状几乎没有影响;35℃鼓风干燥对山银花有一些影响,山银花两端有少许变为灰色,但大部分仍保留其原绿色;阴干影响较大,山银花外观大部分偏灰色,少许绿色。采用三种干燥方法处理后,样品干燥后重量(如表1)相差不大。从山银花外观性状上看,真空微波干燥处理的效果最佳,其次为35℃鼓风干燥,阴干最差。

表1 山银花不同干燥方法的外观性状Table 1 External characters and dry weight of Lonicerae Confusae dried by different drying methods
2.2 不同干燥方法对山银花相关酶活性的影响
多酚氧化酶(PPO)是一种氧化酶,在氧的参与下使酚类物质氧化成醌,进行一系列的脱水、聚合反应,最后形成黑褐色物质[13-14],是造成植物褐变的最主要原因之一。不同干燥方法处理后的山银花样品,多酚氧化酶活性呈现较大差异,结果见图1a。经真空微波干燥处理后的样品,高温微波瞬间灭酶,使多酚氧化酶酶活性迅速降低,酶活力为14U,仅为未干燥处理鲜样的30%左右;其次为恒温鼓风干燥样品,多酚氧化酶酶活性为原未干燥样品的57%,酶活力为26U;阴干处理山银花,样品多酚氧化酶变化不大,仍保留原样酶活性的80%以上。
过氧化物酶(POD)在H2O2存在时能催化酚类、类黄酮的氧化和聚合,参与酚类物质的代谢[15],可与PPO协同作用引起褐变,造成山银花营养成分损失及品质降低。不同干燥方法对山银花中过氧化物酶剩余酶活性影响见图1b。对过氧化物酶活性影响趋势与多酚氧化酶基本一致,真空微波干燥后样品过氧化物酶活性最低且仅为未干燥原样的13%,酶活力为24.4U;鼓风干燥后样品剩余酶活力为108.5U,为原样的51%左右;阴干处理过程中对酶活性影响较小,酶活力为198.3U。
由此可见,样品真空微波干燥处理时,温度迅速升高,蛋白质变性,促使大部分PPO、POD被灭活,显示低酶活性,鼓风干燥和阴干干燥样品由于温度较低,失水速度较慢,PPO、POD仍保留较高酶活性。
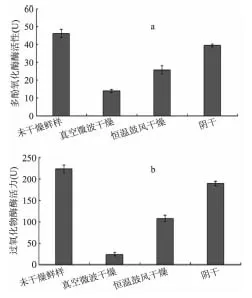
图1 山银花不同干燥方法对酶活性影响 Fig.1 The changes of enzymes activities in Lonicerae Confusae dried by different drying methods
2.3 线性关系考察
通过实验得没食子酸标样的标准曲线为:Y(mg/mL)=0.0624A+0.0007,其中A为吸光度值,R2=0.9995,线性范围为:0.002~0.010mg/mL;芦丁标准曲线方程为:Y(mg/mL)=1.14075A-0.01847,R2=0.9996,线性范围为:0.02~0.09mg/mL;绿原酸含量(mg)线性回归方程为:Y=1.55291×106X+90.13,R2=0.9994,线性范围为:0.001~0.005mg;木犀草苷含量(mg)线性回归方程为:Y=2.04998×106X+27.28108,R2=0.9993,线性范围为:0.00048~0.0024mg。
2.4 不同干燥方法对山银花活性成分的影响
经不同方法干燥的山银花,其主要成分基本一致,但其成分含量变化较大,活性成分含量如图2(鲜样各成分浓度为折合干基后含量)。在真空微波干燥后,山银花提取液中总酚、总黄酮含量最高,分别为85.97±0.98、(230.83±1.20)mg/g;恒温鼓风干燥样品,活性成分含量均较真空微波干燥后有所降低;而在自然阴干的条件下,活性成分含量依次为34.20±0.33、(65.93±2.41)mg/g,含量最低。
绿原酸等酚酸成分具有显著的抗病毒、调节糖脂代谢等作用,木犀草苷等黄酮具有抗菌活性[16],为山银花中重要的药效成分。不同干燥方法处理后的山银花,高效液相色谱图测定其主要成分,结果如图3。在真空微波干燥处理后,绿原酸峰面积最大,35℃恒温鼓风干燥峰面积有所降低,阴干处理后最小;木犀草苷峰面积于鼓风干燥后最小。据此,真空微波干燥后,绿原酸含量最高,为(42.4±0.25)mg/g,阴干含量最低。绿原酸的分子结构中具邻位酚羟基是多酚的一种,易在多酚氧化酶和过氧化物酶的作用下氧化缩合成高分子有色物质,真空微波干燥中温度瞬间升高,造成多酚氧化酶及过氧化物酶高温失活,绿原酸损耗较少,含量最高。而阴干处理过程中,褐变相关酶活性最高,绿原酸酶解损耗较高,同时,由于干燥速度较慢,样品长时间暴露于空气中绿原酸被氧化,因此含量最低。木犀草苷含量与图2b中总黄酮含量变化不尽相同,鼓风干燥法的木犀草苷含量最低,为(0.13±0.0053)mg/g,仅为鲜样的50%。
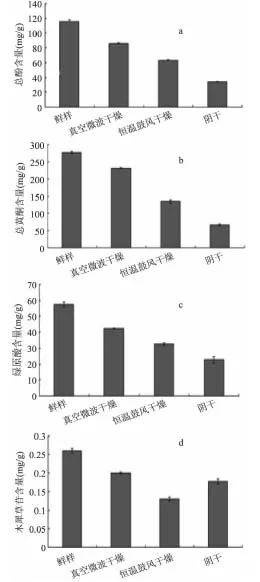
图2 不同干燥方法处理后山银花中活性成分含量 Fig.2 The dynamic changes of,total phenol,total flavonoids,chlorogenic acid and galuteolin in Lonicerae Confusae dried by different drying methods
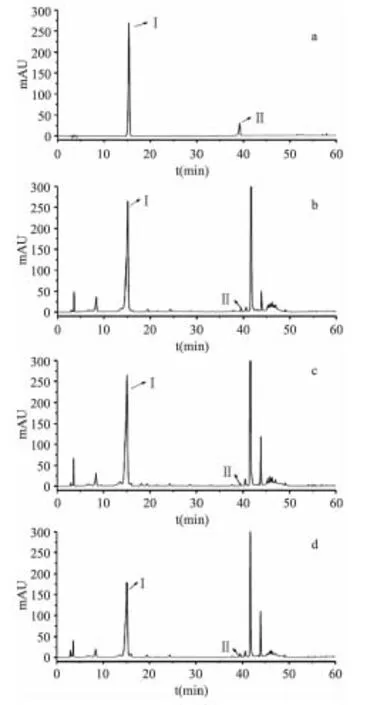
图3 不同干燥方法处理后山银花高效液相色谱图 Fig.3 HPLC chromatogram of Lonicerae Confusae dried by different drying methods
2.5 微波干燥后山银花活性成分含量同相关酶活性的相关分析
将微波干燥方法处理后的山银花活性成分含量同相关酶活性进行相关性分析,结果见表2。结果显示微波干燥处理后的山银花样品中总酚与PPO活性极显著相关,与POD活性显著相关。绿原酸与PPO活性显著相关,同POD极显著相关。PPO、POD活性与总黄酮、木犀草苷含量相关性不显著。相关性分析结论与文献记载[7-8]相一致,表明山银花的褐变主要与其中酚类物质相关。
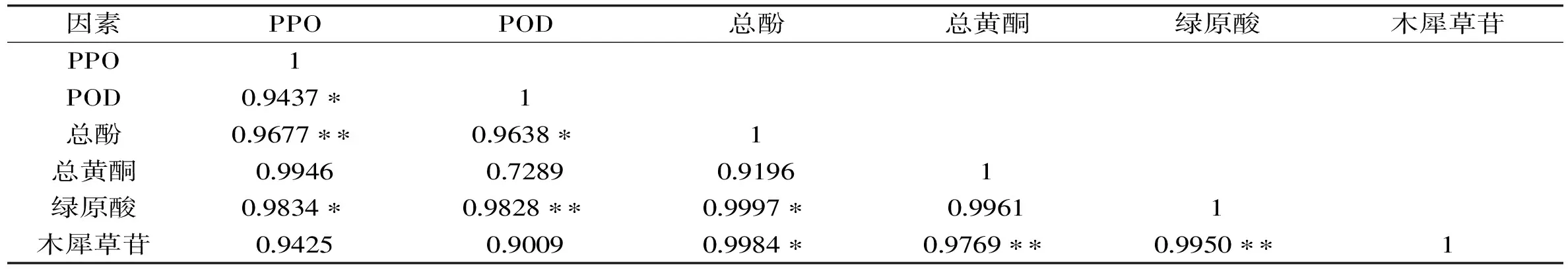
表2 微波干燥样品酶活性与活性成分含量相关系数Table 2 The correlation coefficients of enzyme activities and active component contents of Lonicerae Confusae dried by microwave drying methods
3 结论
不同干燥方法处理后的山银花样品中,真空微波干燥在短时间内将褐变相关酶活性降到最低,防止山银花与酚类物质等发生反应产生褐变,使山银花外观性状仍呈绿色,活性成分依然保留在高含量。数据分析结果表明,PPO活性与活性成分的相关性高于POD活性,说明在山银花干燥过程中,PPO是酚类物质氧化转变为醌的主要酶。同时,真空微波干燥后样品酶活性较低,更利于存储过程中药材色泽的保持和有效成分的保留。综合考虑,真空微波干燥为山银花最佳干燥方法。
[1]卫生部药典委员会. 中国药典[S]. 北京:中国医药科技出版社,2010:28-29.
[2]王燕,王智民,林丽美,等. 金银花及其同属植物化学成分研究进展[J]. 中国中药杂志,2008,33(8):969-972.
[3]陈亚,李小敏. 山银花研究进展[J]. 中国科技信息,2007(5):72-74.
[4]张玲容,周日宝. 产地加工方法对山银花药材品质的影响[J]. 湖南中医药大学学报,2011,31(3):42-44.
[5]陈言,周日宝,刘佳胜. HPLC法测定灰毡毛忍冬炮制品中绿原酸的含量[J].中国卫生产业,2011,8(11):23-24.
[6]姚正颖,张卫明,李春霞,等. 不同干燥方法对灰毡毛忍冬花蕾中活性成分含量的影响[J]. 中国野生植物资源,2013,32(2):8-11.
[7]Palma-Orozco G,Ortiz-Moreno A,Dorantes-Alvarez L,etal. Purification and partial biochemical characterization of Polyphenol oxidase from mamey(Pouteria sapota)[J]. Phytochemistry,2011,72:82.
[8]Cai F,Yang C O,Duan P P,etal. Purification and characterization of a novel thermal stable peroxidase from Jatropha curcas leaves[J]. Journal of Molecular Catalysis B Enzymatic,2012,77:59.
[9]Gao Z J,Han X H,Xiao X G. Purification and characterisation of polyphenol oxidase from red Swiss chard(Beta vulgaris subspecies cicla)leaves[J]. Food Chemistry,2009,342.
[10]陈贻竹,王以柔. 荔枝果实过氧化物酶(POD)的研究[J].中国科学院华南植物研究所集刊,1989(5):47-52.
[11]Singleton V L,Rossi J A. Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents[J]. American Journal of Enology and Viticulture,1965,16:144.
[12]郭兴峰,傅茂润,杜金华,等. 不同干燥方法对荷花花瓣抗氧化活性和化学成分的影响[J]. 食品与发酵工业,2010,36(2):146-149.
[13]王璋编. 食品酶学[M]. 北京:轻工业出版社,1992,254-278.
[14]宁正祥,赵谋明. 食品生物化学[M]. 广州:华南理工大学出版社,1995,298-301.
[15]Banci L. Structural properties of peroxidases[J]. Journal of Biotechnology,1997,53:253-263.
[16]宋伟峰,陶玲,钟鸣. 微波辅助萃取/高效液相色谱串联质谱法对山银花中活性成分含量的测定[J]. 分析测试学报,2012,31(7):810-815.
