七氟烷对内毒素致大鼠急性肺损伤氧合指数的影响
2014-03-22孙艳红崔涌李晓倩孙喜家
孙艳红,崔涌,李晓倩,孙喜家
(中国医科大学附属第一医院麻醉科,沈阳110001)
七氟烷对内毒素致大鼠急性肺损伤氧合指数的影响
孙艳红,崔涌,李晓倩,孙喜家
(中国医科大学附属第一医院麻醉科,沈阳110001)
Sevoflurane Protectsagainst Endotoxin-induced Acute Lung Injury in Ratthrough the Improvementin Oxygenation
选取40只Wistar大鼠,体质量220~260 g,随机均分为4组:对照组、内毒素组、1.0和1.5MAC七氟烷组。在实验开始前(0 h),实验1 h、2 h、3 h及4 h时采集大鼠动脉血行,血气分析并计算氧合指数(氧分压/吸入氧浓度,PaO2/FiO2)。结果发现0 h和1 h时各组间氧合指数无统计学差异(P>0.05),内毒素组2 h氧合指数明显低于本组0 h及对照组2 h指标(P<0.05);1.0和1.5MAC组2 h、3 h和4 h时氧合指数明显低于本组0 h及对照组同一时间指标(P<0.05),3 h和4 h高于同时间的内毒素组(P<0.05),但低于同时间的对照组(P<0.05),1.0和1.5MAC组间各时间段氧合指数无统计学差异(P>0.05)。因此认为吸入七氟烷可以改善内毒素致大鼠急性肺损伤肺脏氧合指数。
内毒素;七氟烷;急性肺损伤;氧合指数
急性肺损伤(acute lung injury,ALI)和急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是呼吸功能衰竭的主要原因,死亡率可达60%~70%[1]。ALI多由内毒素血症所致,临床表现为低氧血症,病理表现为肺中性粒细胞浸润、肺泡-毛细血管膜通透性增加,肺组织水肿。七氟烷可以有效抑制细胞因子的释放,抑制内毒素所致的肺泡上皮细胞释放炎性调节因子,在一定程度上可改善肺泡毛细血管膜的通透性,减轻肺损伤程度[2]。不同浓度不同作用时间的七氟烷抑制细胞因子释放的程度不同[3],本实验ALI后吸入1.0和1.5MAC的七氟烷4 h,与临床所用剂量和时间相符,在大鼠相当于2.4%及3.6%吸入浓度[4],观察不同浓度七氟烷对内毒素致大鼠急性肺损伤后肺脏氧合指数的影响,为临床麻醉用药提供理论基础。
1 材料与方法
1.1 实验动物与分组
清洁级Wistar大鼠40只,雌雄不限,体质量220~260 g,由中国医科大学实验动物中心提供。根据文献[5]确定每组10只,随机均分为4组:对照组、内毒素组、1.0肺泡气最低有效浓度(minimal alveolar concentration,MAC)和1.5MAC七氟烷组。
1.2 实验方法
1.2.1 动物模型制备及处理:大鼠腹腔注射异戊巴比妥钠(100 mg/kg),待大鼠对疼痛刺激不再有反应时气管切开,插管后接小动物呼吸机行机械通气,潮气量8 mL/kg,呼吸频率65~70次/min,气道压维持在3~10 cmH2O。左颈内动脉插管用于测定动脉压,左股静脉插管用于输液和给药,输注乳酸钠林格氏液(10 mL·kg-1·h-1),各项操作完毕稳定30 min后(0 h)采集动脉血(0.2 mL)进行血气分析后开始实验。对照组股静脉注射生理盐水(1.2 mL)后机械通气4 h,内毒素组股静脉注射LPS(5 mg/kg)后机械通气4 h,1.0和1.5MAC七氟烷组:股静脉注射LPS(5 mg/kg)后机械通气,分别吸入七氟烷1.0、1.5MAC 4 h。应用Datex麻醉气体监测仪监测七氟烷、吸入氧浓度和呼气末CO2分压(PETCO2),维持PETCO235~45 mmHg(1 kPa=7.5 mmHg),Ohmeda麻醉机供给氧气和七氟烷,调节吸入氧浓度为0.8,根据监测七氟烷的MAC值调节麻醉药挥发罐刻度,将其控制在所需的浓度。对照组和内毒素组每隔1 h腹腔注射异戊巴比妥钠(30 mg/kg)维持麻醉,实验中如大鼠自主呼吸同呼吸机抵抗,静脉注射维库溴铵(0.1 mg/kg)维持肌松。
1.2.2 氧合指数测定:实验进行前(0 h)、1 h、2 h、3 h及4 h时采集动脉血(0.2 mL)行血气分析并计算氧合指数(氧分压/吸入氧浓度,PaO2/FiO2)。
1.3 统计学方法
2 结果
各组0 h和1 h氧合指数比较无统计学差异(P>0.05),内毒素组2 h氧合指数明显低于0 h及对照组2 h(P<0.05);1.0和1.5MAC组2 h、3 h和4 h时氧合指数明显低于0 h及对照组同一时间指标(P<0.05),3 h和4 h氧合指数高于同时间的内毒素组(P<0.05),但低于同时间的对照组(P<0.05),1.0和1.5MAC组间各时间段指标比较没有统计学差异(P>0.05),见表1。
表1 各组不同时间点氧合指数比较
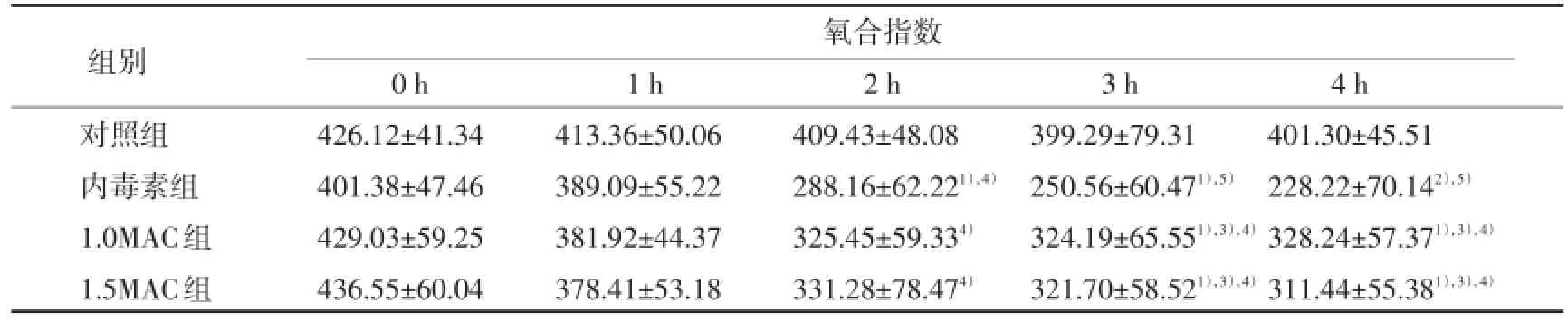
表1 各组不同时间点氧合指数比较
与对照组比较,1)P<0.05,2)P<0.01;3)与内毒素组比较P<0.05;与同组0 h比较,4)P<0.05,5)P<0.01.
3 讨论
内毒素所致的急性肺损伤临床表现之一是肺氧合障碍、氧合指数降低,主要是内毒素引起单核细胞和中性粒细胞浸润并释放大量的炎性介质导致上皮细胞损伤,引起肺泡毛细血管膜通透性升高、血浆蛋白渗出,肺水含量增加所致。氧合指数是反应肺脏氧合状态的简便可靠指标,降低肺脏的炎性反应,降低肺水的生成或促进肺水的吸收对改善氧合起到至关重要的作用,肺损伤时吸入麻醉药七氟烷或可改善肺脏的氧合状态。
本研究选择七氟烷的浓度为1.0和1.5MAC,大鼠相当于2.4%及3.6%吸入浓度,吸入时间为4 h,肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)是内毒素诱导急性肺损伤早期的重要标志物,七氟烷抑制TNF-α产生时间在4 h时最强,有效浓度自2.2%开始,最强浓度为3.3%[3],故本实验亦采取相近的七氟烷浓度,作用时间4 h。
本研究结果表明,肺损伤时吸入不同浓度的七氟烷4 h可明显改善内毒素致急性肺损伤后肺脏的氧合情况,与对照组比较,肺脏氧合指数明显升高。本文作者前期研究证实七氟烷可不同程度降低肺水含量和湿重/干重比,对损伤肺脏的病理形态学亦有明显的改善,包括炎性细胞浸润、肺泡出血等均明显减轻[6],说明七氟烷可减轻肺脏内炎性细胞浸润,减少肺水生成,减轻肺水肿,提高氧合指数。
七氟烷对内毒素致急性肺损伤肺氧合指数的改善机制复杂,研究表明七氟烷可降低细胞炎性因子产生及减少炎性细胞在肺组织中的聚集,降低肺泡毛细血管膜通透性,减轻血管损伤所致蛋白渗漏,降低肺水含量,提高氧合指数[5]。七氟烷对急性肺损伤后肺泡水的再吸收影响不明显,主要是通过抑制肺泡上皮细胞的炎性反应减轻肺脏的损伤,降低肺泡毛细血管膜的通透性,减轻肺损伤导致的血管渗漏,降低肺水的生成,从而提高肺脏的氧合[7]。内毒素所致急性肺损伤肺泡灌洗液中以中性粒细胞为主,七氟烷可减少肺泡灌洗液中细胞总数及蛋白含量,细胞因子诱导的中性粒细胞趋化因子1(cytokine-induced neutrophil chemoattractant-1,CINC-1)和单核细胞趋化蛋白1(monocyte chemoattractant protein-1,MCP-1)明显减少[8],减轻炎性细胞的聚集,抑制炎性细胞与内皮细胞的黏附[9],抑制炎性反应降低肺泡膜的高通透性。七氟烷可以激活肺泡上皮细胞上的γ-氨基丁酸(gammaaminobutyric acid,GABA)A受体信号通路,产生抑制炎性反应作用,保护肺脏,或者使肺泡巨噬细胞内CINC-1等炎性因子的表达降低[3,10],从而减轻肺脏的炎性反应。
提高氧合指数是内毒素所致急性肺损伤临床治疗手段之一,伴有ALI或ARDS的患者如需手术治疗,术中全身麻醉药物的选择及在ICU病房镇静药物的应用均可影响肺脏的病理生理,应用七氟烷麻醉或镇静治疗可改善ALI或ARDS患者气体交换,主要是依赖于七氟烷可以抑制肺脏炎性反应,减少肺泡内炎性细胞的聚集,降低肺泡毛细血管膜的通透性,减少肺水生成,减轻肺损伤,为临床上急性肺损伤机械呼吸时提供简便易行的治疗方式,也为此类患者麻醉中药物选择及ICU术后镇静提供理论依据。
七氟烷是目前临床上应用最广泛的吸入麻醉药,异氟烷诱导和苏醒慢,且对心血管有一定的影响,七氟烷诱导和苏醒快,但七氟烷对ALI后肺脏的保护作用何时开始、持续时间、最适宜的浓度仍然没有确切的结论,实验时的肺损伤模型并不完全和临床患者的ALI一致,因此不能将实验所得结论完全应用于临床,但现有研究仍然可以提示七氟烷可改善ALI肺脏的氧合指数。七氟烷抑制炎性反应的同时是否降低机体对感染的抵抗力并未确定,有待于进一步深入研究。
[1]Rubenfeld GD,Caldwell E,Peabody E,et al,Incidence and outcomes of acute lung injury[J].N Engl J Med,2005,353(16):1685-1693.
[2]Mitsuhata H,Shimizu R,Yokoyama MM.Suppressive effects of volatile anesthetics on cytokine release in human peripheral blood mononuclear cells[J].Int J Immunpharmacol,1995,17(6):529-534.
[3]Steurer M1,Schlapfer M,Steurer M,et al.The volatile anaesthetic sevoflurane attenuates lipopolysaccharide-induced injury in alveolar macrophages[J].Clin Exp Immunol,2009,155(2):224-230.
[4]Kashimoto S,Furuva A,Nonaka A,et al.The minimum alveolar concentration of sevoflurane in rats[J].Eur J Anaesthesiol,1997,14(4):359-361.
[5]Voigtsberger S,Lachmann RA,Leutert AC,et al.Sevoflurane ameliorates gas exchange and attenuates lung damage in experimental lipopolysaccharide-induced lung injury[J].Anesthesiology,2009,111(6):1238-1248.
[6]孙艳红,张倩,王俊科,等.七氟烷对内毒素致急性肺损伤鼠肺泡毛细血管膜通透性的影响[J].中华外科杂志,2004,42(16):1014-1017.
[7]Schlapher M,Leutert AC,Voigtsberger S,et al.Sevoflurane reduces severity of acute lung injury possibly by impairing formation of alveolar oedema[J].Clin Exp Immunol,2012,168(1):125-134.
[8]Suter D,Spahn DR,Blumenthal S,et al.The immunomodulatory effect of sevoflurane in endotoxin-injured alveolar epithelial cells[J]. Anesth Analg,2007,104(3):638-645.
[9]Yue T,Roth Z′graggen B,Blumenthal S,et al.Post-conditioning with a volatile anaesthetic in alveolar epithelial cells in vitro[J].Eur Respir J,2008,31(1),118-125.
[10]Fortis S,Spieth PM,Lu WY,et al.Effects of anesthetic regimes on inflammatory responses in a rat model of acute lung injury[J].Intensive Care Med,2012,38(9):1548-1555.
(编辑 武玉欣)
R614.2
A
0258-4646(2014)10-0950-03
辽宁省科学技术计划(2011225020)
孙艳红(1966-),女,副教授,博士. E-mail:yanhongsun518@aliyun.com
2014-03-21
网络出版时间:
