变性再复性方法提取高纯度Cav1.2片段GST-CT1及其生物活性的鉴定
2014-03-22孙宇封瑞孙威胡慧媛郝丽英
孙宇,封瑞,孙威,胡慧媛,郝丽英
(中国医科大学药学院药物毒理教研室,沈阳110001)
变性再复性方法提取高纯度Cav1.2片段GST-CT1及其生物活性的鉴定
孙宇,封瑞,孙威,胡慧媛,郝丽英
(中国医科大学药学院药物毒理教研室,沈阳110001)
目的探寻诱导谷胱甘肽转移酶(GST)与Cav1.2钙通道片段CT1重组的易形成包涵体的大分子融合蛋白的提取与纯化的方法。方法在E.coliBL21中转化入pGEX-6p-3/CT1重组质粒并诱导表达,采用GST包涵体变性复性试剂盒和非离子去污剂B-PER分离纯化GST-CT1融合蛋白,用Pull down assay方法鉴定GST-CT1融合蛋白及其生物活性。结果应用GST包涵体变性复性试剂盒和非离子去污剂B-PER能够分离得到高纯度的易形成包涵体的GST-CT1融合蛋白,且分离纯化的GST-CT1融合蛋白具有与钙调蛋白结合的生物活性。结论操作简易的GST包涵体变性复性法能够针对易形成包涵体的GST-CT1融合蛋白进行分离和纯化,且得到的蛋白具有生物学活性。
包涵体;变性再复性;钙离子通道
心肌细胞L型电压依赖性钙离子通道(L-type voltage-dependent calcium channel,LTCC)是钙离子(Ca2+)进入心肌细胞的主要途径,在维持细胞Ca2+平衡中起着至关重要的作用[1,2]。在生理情况下,LTCC介导的Ca2+内流在心肌细胞兴奋收缩耦联、钙触发钙释放及动作电位形成等过程中发挥着重要作用,另外,还参与可兴奋细胞神经递质的分泌、释放和自我调控转录[3~6]。心肌细胞LTCC调节的失衡会引发心律失常、心房颤动和心力衰竭等一系列病理过程。近年来,研究者对心肌LTCC的调节机制进行了广泛深入的研究。研究表明,LTCC可以被蛋白激酶A(proteinkinase A,PKA)、钙调蛋白(calmodulin,CaM)、钙结合蛋白1(Ca2+-bingding protein 1,CaBP1)、钙蛋白酶抑素(calpastatin,CS)、钙调蛋白激酶Ⅱ(Ca2+/calmodulin-dependent kinaseⅡ,CaMKⅡ)等多种细胞因子调节[7~11]。LTCC的C末端CT1(a.a.1509~1789)上有磷酸化和蛋白质结合位点,PKA能够通过CT1上的磷酸化位点使LTCC磷酸化,从而对心肌细胞LTCC进行调节;CaM、CaBP1、CS、CaMKⅡ等蛋白能够直接或间接与CT1上的蛋白结合位点结合,从而对LTCC进行调节。因此获得CT1片段对于研究LTCC具有重要的意义。
大肠埃希菌因其具有操作简单、成本低、生长快、产量高等优点而被广泛应用于重组蛋白的表达。GST标签的CT1重组蛋白(GST-CT1)在经大肠埃希菌诱导大量表达的情况下,通常会形成无活性的包涵体,在蛋白质提取纯化的过程中以难溶状态存在,大大降低了重组蛋白提取的产量。目前,包涵体形成的原因并不十分清楚,可能是易形成包涵体的蛋白部分错误折叠而导致。目前,针对包涵体蛋白的提取方法主要有亲和层析法、变性法等方法,上述方法因具有耗时、规模大、出现不可逆的变性等缺点而不能广泛应用。因此,本研究拟采用技术简单、操作方便的B-PER破膜[12],并针对GST-CT1蛋白提取纯化过程中易形成包涵体这一难题,运用包涵体变性再复性试剂盒有效地提取纯化高纯度、高产量的GST-CT1蛋白,并运用pull-down assay鉴定GST-CT1及其生物学活性。为今后LTCC的研究奠定基础。
1 材料与方法
1.1 材料
原核表达载体pGEX-6p-3和BL21菌种购自Amersham Pharmacia Biotech公司。B-PER购自Thermo Scientic公司,蛋白酶抑制剂购自Roche Applied Science公司,氨苄西林(ampicillin sodium)、IPTG、溶菌酶(lysozyme)、DTT均购自Wako公司,Glutathione-Sepharose 4B beads、PreScission Protease、Turbo Nuclease购自GE Healthcare公司,GST包涵体变性试剂盒(Rapid GST inclusion body solubilization and renaturation kit)购自Cell Biolabs,INC公司。
1.2 方法
1.2.1 重组质粒pGEX-6p-3/CT1的诱导及表达:将重组质粒pGEX-6p-3/CT1转化到BL21中,于含有0.1 mg/mL氨苄西林(AMP)的LB培养液中培养,37℃、100 r/min震荡过夜。将菌液稀释至OD值0.6~0.8之间,再加入终浓度为1 mmol/L的IPTG,37℃、100 r/min震荡5 h,诱导表达GST-CT1。
1.2.2 变性再复性方法提取与纯化GST-CT1:6 000 r/min离心菌液15 min,收集沉淀。将沉淀重悬[每克沉淀加入4 mL B-PER,0.2 mg/mL溶菌酶(lysozyme),1 μL DNA酶(Turbo nuclease)和蛋白酶抑制剂],室温振荡孵育30 min以促进细菌破膜、DNA溶解及GST-CT1蛋白的释放。16 000 r/min离心20 min,将上清置于冰上,留取少量标记为S,剩余的上清用300 μL STE缓冲液洗过的GS-4B beads 4℃孵育过夜。取少许沉淀,用Tris溶解标记为P。将S、P分别经1×loading缓冲液处理,80℃加热5 min,经12.5%SDS-PAGE电泳(上样量均为10 μg),以确定此时GST-CT1是主要存在于上清或沉淀中。
将上述离心后的沉淀用变性复性试剂盒的20 mL 1×STE缓冲液,1 mmol/L DTT,0.2 mg/mL溶菌酶和蛋白酶抑制剂重悬,加入变性试剂,4℃摇晃1 h,使错误折叠的包涵体蛋白结构打开而变为水溶性。再加入复性试剂,使GST-CT1按照正确的方式折叠而以可溶的形式存在。加入STE缓冲液洗过的300 μL GS-4B beads,4℃孵育过夜。将上清提取的GST-CT1与变性再复性方法提取的GST-CT1分别800 r/min离心3 min,弃上清。依次用5 mL PBS和Tris各洗2次,用含有蛋白酶抑制剂的Tris buffer稀释,4℃保存。牛血清蛋白为标准品,Bradford法测蛋白浓度。
1.2.3 变性再复性方法提取纯化的GST-CT1蛋白及纯度的鉴定:取上述方法制备的GST-CT1蛋白,经1×loading缓冲液处理后,80℃加热5 min,进行12.5%SDS-PAGE电泳(上样量均为10 μg),根据Marker检测CT1蛋白。
1.2.4 pull down assay鉴定GST-CT1蛋白生物学活性:检测当CaM的浓度分别为0.1、0.3、1、3和10 μmol/L时GST-CT1与CaM的结合情况。每400 μL体系包含10 μg GST-CT1蛋白,2 mmol/L CaCl2,蛋白酶抑制剂,不同浓度的CaM,溶于Tris buffer中。4℃摇晃孵育3 h。将孵育好的样品用含0.05% Tween-20、蛋白酶抑制剂和2 mmol/L CaCl2的Tris缓冲液500 μL洗2次后,用1×loading缓冲液处理,室温静置20 min,80℃加热5 min。12.5%聚丙烯酰胺凝胶电泳,按照CaM浓度由低到高的顺序依次上样。考马斯亮蓝染胶1 h后,脱色液脱色,照相。应用Image J软件分析灰度值。
2 结果
2.1 GST-CT1蛋白提取纯化过程中以不可溶的包涵体形式存在于沉淀之中
将B-PER破膜处理的菌液离心后的上清S和沉淀P(各10 μg)分别进行12.5%聚丙烯酰胺凝胶电泳,经考马斯亮蓝染色后,可见GST-CT1大部分存在于沉淀之中(图1)。说明GST-CT1作为大分子蛋白,在提取纯化过程中以不可溶的包涵体形式存在于沉淀中,上清中虽然也存在GST-CT1蛋白,但与沉淀相比所含有的GST-CT1蛋白含量非常少。
2.2 经变性再复性方法提取纯化的GST-CT1蛋白
采用变性再复性方法提取的GST-CT1蛋白及破膜离心后的上清提取的GST-CT1蛋白进行12.5%聚丙烯酰胺凝胶电泳(上样量10 μg),考马斯亮蓝染色。如图2所示:经变性再复性方法提取纯化的GST-CT1蛋白产量明显提高,且此方法提取的GSTCT1蛋白杂带较少,纯度较高。上清液中提取的GST-CT1蛋白非常少,且主要为GST蛋白。说明用该方法提取的GST-CT1蛋白遗失率少,能够尽可能多地将菌液中的GST-CT1提取出来。由此可见,变性再复性方法能够提取出高浓度、高产率、高纯度的GST-CT1蛋白。
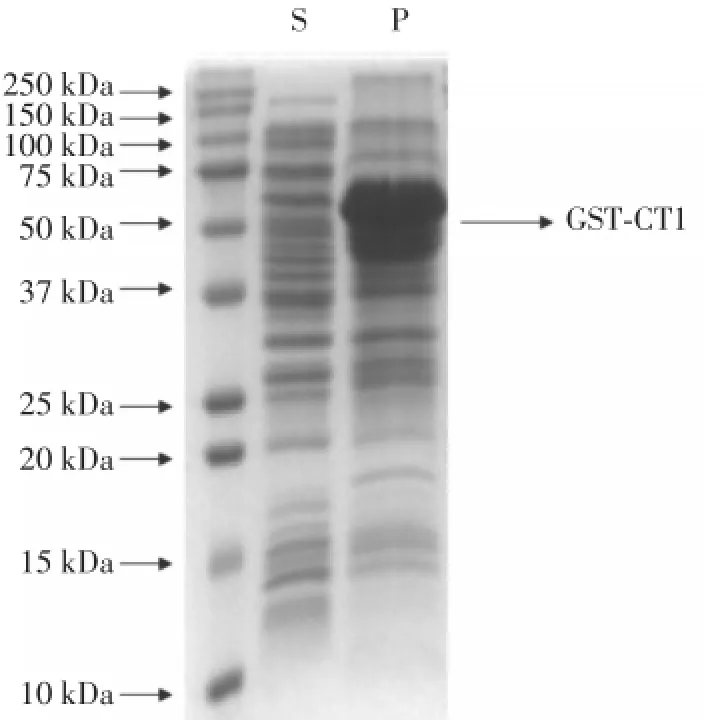
图1 GST-CT1蛋白的存在位置Fig.1 Location of the GST-CT1
2.3 经变性再复性试剂盒方法提取的GST-CT1蛋白生物活性的鉴定

图2 经变性再复性方法提取的GST-CT1蛋白Fig.2 Purification of GST-CT1 by denaturation and renaturation method
将变性再复性试剂盒方法提取的GST-CT1蛋白,与不同浓度的CaM蛋白孵育,进行12.5%聚丙烯酰胺凝胶电泳(GST-CT1上样量10 μg),经考马斯亮蓝染色、灰度值分析后,结果如图3所示:用变性复性方法提取的GST-CT1蛋白能够与CaM浓度依赖性的结合,表明GST-CT1具有正常的生物学活性。

图3 GST-CT1蛋白与CaM呈浓度依赖性结合Fig.3 GST-CT1 bind to CaM in concentration dependent manner
3 讨论
随着心肌LTCC研究的不断深入,CT1片段在LTCC调节过程中的重要性逐渐被人们所发现。CT1除了能与CaM、CaBP1、CS及CaMKII等经典的调节蛋白结合外,最新研究表明三磷酸腺苷(adenosine triphosphate,ATP)在豚鼠心肌细胞中也能以浓度依赖的方式与CT1片段结合从而对LTCC进行调节,并且这种结合也呈Ca2+和CaM依赖性[13]。CT1不仅能够与各种调节蛋白结合而改变LTCC的活性,而且H2O2和H2S等氧化还原剂也能够改变CT1片段上氨基酸残基的氧化还原状态,从而对LTCC的活性做出调节[1,14]。可见CT1片段在LTCC的调节过程中发挥着至关重要的作用。
GST-CT1易形成包涵体而以难溶的形式存在,因此较难提取纯化出高纯度、高产量蛋白,对于这一难题目前尚无良好的解决方法。变性方法作为一种改进方法,被应用于提取纯化GST-CT1蛋白,应用十二烷基肌胺酸钠(N-lauroylsarcosine sodium salt)阴离子表面活性剂作为变性剂,打开错误折叠的GST-CT1蛋白而使其以可溶形式存在,从而提高蛋白产量。该方法的优点在于提取出的蛋白浓度、纯度都相对较高,且经济成本较低、适合大规模生产操作[12,15]。变性剂虽然能打开错误折叠的GSTCT1蛋白结构而使其变为可溶,但是被打开的蛋白质失去了其原有的空间结构,在变性条件去除的情况下,GST-CT1蛋白会进行缓慢的自然复性过程,但是这一复性效率很低,不能完全恢复其原有的正常空间结构,因此会在一定程度上影响蛋白质的生物活性。
鉴于上述变性法的局限性,本研究在变性的基础上又对蛋白进行了复性,即应用变性再复性方法提取纯化GST-CT1蛋白。运用试剂盒中的变性试剂对形成包涵体的GST-CT1蛋白进行变性修饰,将错误折叠的蛋白质空间结构打开而变为线性可溶形式,随后又应用试剂盒中的复性试剂将变性后的GST-CT1蛋白按照正确的方式折叠恢复其正常的空间结构,在提取纯化过程中以可溶形式存在,大大提高了GST-CT1蛋白产量。本研究方法通过尿素等小分子添加剂阻止蛋白的聚集,稳定蛋白质的活性,使不正确折叠的蛋白质结构变得不稳定,而向正确的方向进行折叠,可大幅度提高包涵体蛋白质的折叠效率。该方法提取的蛋白不仅浓度高、纯度高、产率高,且pull-down方法显示该GST-CT1蛋白能够与CaM浓度依赖性的结合,具有正常的生物学活性。
综上所述,本研究方法操作简单、省时,而且没有pH值的变化和氧化还原对的参与,为LTCC的研究奠定了基础。虽然该方法具有诸多优点,但实验经济成本投入较高。因此,在实验研究中,应该根据具体需要选择合适的蛋白提取纯化方法。
[1]Zhang R,Sun Y,Tsai H,et al.Hydrogen sulfide inhibits L-type calcium currents depending upon the protein sulfhydryl state in rat cardiomyocytes[J].PLoS One,2012,7(5):e37073.
[2]Ge J,Ju Y,Xue Z,et al.Distal C terminus of CaV1.2 channels plays a crucial role in the neural differentiation of dental pulp stem cells[J].PLoS One,2013,8(11):e81332.
[3]Nystoriak M,Nieves-Cintron M,Navedo M.Capturing single L-type Ca(2+)channel function with optics[J].Biochim Biophys Acta,2013,1833(7):1657-1664.
[4]Satin J,Schroder E,Crump S.L-type calcium channel auto-regulation of transcription[J].Cell Calcium,2011,49(5):306-313.
[5]Schroder E,Byse M,Satin J.L-type calcium channel C terminus autoregulates transcription[J].Circ Res,2009,104(12):1373-1381.
[6]Magyar J,Jenes A,Kistamas K,et al.Long term regulation of cardiac L-type calcium channel by small G proteins[J].Curr Med Chem,2011,18(24):3714-3719.
[7]Sag C,Wagner S,Maier L.Role of oxidants on calcium and sodium movement in healthy and diseased cardiac myocytes[J].Free Radic Biol Med,2013,63:338-349.
[8]Asmara H,Minobe E,Saud ZA,et al.Interactions of calmodulin with the multiple binding sites of Cav1.2 Ca2+channels[J].J Pharmacol Sci,2010,112(4):397-404.
[9]Findeisen F,Rumpf C,Minor D.Apo states of calmodulin and CaBP1 control CaV1 voltage-gated calcium channel function through direct competition for the IQ domain[J].J Mol Biol,2013,425(17):3217-3234.
[10]Sun W,Feng R,Hu H,et al.The Ca(2+)-dependent interaction of calpastatin domain L with the C-terminal tail of the Cav1.2 channel[J].FEBS Lett,2014,588(5):665-671.
[11]Zhao Y,Hu HY,Sun DR,et al.Dynamic alterations in the CaV1.2/ CaM/CaMKII signaling pathway in the left ventricular myocardium of ischemic rat hearts[J].DNA Cell Biol,2014,33(5):282-290.
[12]封瑞,胡慧媛,郭凤,等.Cav1.2钙通道片段CT1融合蛋白的制备及生物学活性鉴定[J].中国医科大学学报,2013,42(11):970-973.
[13]Feng R,Xu J,Minobe E,et al.Adenosine triphosphate regulates the activity of guinea pig Cav1.2 channel by direct binding to the channel in a dose-dependent manner[J].Am J Physiol Cell Physiol,2014,306(9):C856-C863.
[14]Yang L,Xu J,Minobe E,et al.Mechanisms underlying the modulation of L-type Ca2+channel by hydrogen peroxide in guinea pig ventricular myocytes[J].J Physiol Sci,2013,63(6):419-426.
[15]何桂林,邵冬雪,印丹丹,等.体外重组CaV1.2不同蛋白片段纯化及其与CaM相互作用的研究[J].中国医科大学学报,2013,42(9):773-776.
(编辑 王又冬)
The Method ofDenaturation and Renaturation for Purifying CT1 FragmentofCav1.2 and the Identification ofIts Biologic Activity
SUNYu,FENGRui,SUNWei,HUHui-yuan,HAOLi-ying
(DepartmentofPharmaceuticalToxicology,SchoolofPharmacy,China MedicalUniversity,Shenyang 110001,China)
ObjectiveTo explore methods for the extraction and purification of the inclusion body of fusion protein of glutathione transferase(GST)and CT1 fragment of Cav1.2,and to investigate its biologic activity.MethodsPGEX-6p-3 recombinant plasmid was transfected intoE.coliBL21 to express.GST-CT1 fusion protein with GSTinclusion body waspurified by solubilization and renaturation kitand B-PER.The biologic activity of GST-CT1 fusion protein was identified by pull down assay.ResultsThe GST-CT1 fusion protein,which is easy to form inclusion body,was successfully purified by the established method and pull down assay showed that the purified protein can bind to calmodulin protein.ConclusionThe GST-CT1 fusion protein was successfully purified by denaturation and renaturation method and also showed its normalbiologic activity.
inclusion body;denaturation and renaturation;calcium channel
R96
A
0258-4646(2014)09-0777-04
国家自然科学基金(31071004,81100108)
孙宇(1989-),女,硕士研究生.
郝丽英,E-mail:haoliying2006@163.com
2014-06-04
网络出版时间:
