胶原蛋白片的毒理安全性研究
2014-03-21杨亚飞
杨亚飞
(汤臣倍健股份有限公司,广东广州510663)
胶原蛋白片的毒理安全性研究
杨亚飞
(汤臣倍健股份有限公司,广东广州510663)
为判定胶原蛋白片是否会对人体健康产生危害,进行了胶原蛋白片的安全性毒理学评价。采用急性毒性试验、Ames试验、小鼠骨髓微核试验、微小鼠精子畸形试验和30 d喂养试验对胶原蛋白片的急性毒性、致突变性及亚慢性毒性进行了研究。结果表明:胶原蛋白片小鼠急性毒性试验大于20 000mg/kg,属实际无毒;对基因、体细胞与生殖细胞无明显致突作用;分别按1.88、3.75、7.5g/kg的剂量用受试物喂养大鼠30d,结果表明动物未出现异常。
胶原蛋白片;急性毒性;微核;精子畸形;Ames试验
胶原蛋白片是以胶原蛋白粉、天然VE为主要原料,用以增强免疫力的保健食品。免疫是指机体狻触“抗原性异物”或“异己成分”的一种特异性生理反应[1]。免疫系统对维持机体正常生理功能具有重要意义。当人体营养素摄入不足(蛋白质、维生素、微量元素等缺乏)时会造成机体抵抗力下降,导致免疫活性降低,对免疫机制产生不良影响[2]。免疫活性的变化也影响其他器官的功能,如感染、癌症[3]、各类的慢性病、失眠症、抑郁症、慢性疲劳、以及免疫复合病等等[4-5]。胶原蛋白片是一种以提高免疫力为主要功效的保健食品。为了研究其安全性,特对其毒理安全性进行了研究,现报道如下。
1 材料与方法
1.1 样品
胶原蛋白片为白色至淡黄色片剂。人体推荐量为每日4.5 g/60 kg。
1.2 试验动物及试验条件
清洁级ICR小鼠,生产许可证号:SCXK(沪)2007-0005,体重19 g~35 g,由上海斯莱克试验动物有限责任公司提供。试验动物饲养室温度20℃~25℃,相对湿度40%~70%。试验动物使用许可证号:SYXK(沪)2007-0008,动物饲料由苏州双狮试验动物饮料科技服务有限公司提供,登记证号:苏E饲生字审(2002)006。
1.3 小鼠急性毒性试验
选用体重为19 g~22 g的昆明种小鼠20只,雌雄各半,分放于两鼠笼内,同性别小鼠之间体重之差不超过3 g。采用最大耐受量法将受试样品对试验动物经口灌胃染毒,灌胃容量按每次0.4mL/20 g体重计。24 h内2次对小鼠灌胃,灌胃间隔时间为6 h。染毒后,观察动物的一般状态、体重变化、中毒症状和死亡情况等,观察期为2周。试验末再次对动物称重,对死亡动物及到期处死动物进行尸体解剖,肉眼观察大体病理改变情况。
1.4 遗传毒性试验
1.4.1 Ames试验
测试菌株:TA97、TA98、TA100、TA102由美国加利福尼亚大学生物化学系提供,经鉴定测试菌株生物学特性符合标准要求。釆用平板掺入法,测试剂量为8、40、200、1 000、5 000μg/皿。样品处理方法为:取经121℃高压20min灭菌处理后的样品2.5 g加无菌蒸馏水至20mL混匀,缓慢加入经预处理好的XAD-II树脂柱,以20mL/h的流速进行吸附,以去除组氨酸,而后用洗耳球吹入空气以驱走水分,加入重蒸馏的丙酮50mL,以20mL/h的流速进行洗脱,收集洗脱液。洗脱液经60℃挥发尽丙酮后,加入DMSO 50mL混匀,此收集液中的样品含量即为50mg/mL。取收集液依次用DMS0按1∶4稀释,取得各测试剂量组受试物。《保徤食品检验与评价技术规范》(2003年版)中鼠伤寒沙门氏菌/哺乳动物微粒体酶试验中平板掺入法,在保温的45℃2mL顶层培养基中,依次加入0.1mL受试物、0.1mL菌株增菌液,需活化时加入0.5mLS9混合液,充分混匀迅速倾倒底层平板,做3个平行平板。37℃培养48 h,计数回变菌落数,试验重复一次。
1.4.2 小鼠骨髓嗜多染红细胞微核试验
试验选用清洁级昆明种小鼠50只,体重:25 g~30 g,雌雄各半。将动物随机分为5组,每组10只,雌雄各半,分别作为样品高中低3个剂量组(2.5、5、10 g/kg)及阴性对照组(蒸馏水20 g/kg)和阳性对照组(环磷酰胺40mg/kg)。釆用30 h两次灌胃法,将配制的不同浓度样品按0.4mL/20 g,分别对各组动物灌胃。于第二次灌胃后6 h,颈椎脱臼处死动物,取股骨骨髓加小牛血清混匀,常规涂片、固定,Giemsa.染色制片。镜捡观察,每鼠计数1 000个嗜多染红细胞(PCE)的微核数,微核率以千分率表示,在计数嗜多染红细胞(计数200个PCE)时同时计数成熟红细胞(MCE)数,并计算PCE/ NCE值,用spss11.0进行统计分析。
1.4.3 小鼠精子畸形试验
雄性昆明种小鼠25只,体重:25 g~35 g。将动物随机分为5组,每组5只,分别作为样品高中低3个剂量组(2.5、5、10g/kg)及阴性对照组(蒸馏水20g/kg)和阳性对照组(环磷酰胺40mg/kg)。将配制的不同浓度样品按0.4mL/20 g分别对各组动物灌胃。每日1次,连续5 d。于首次给样后第35天,颈椎脱臼处死动物,取二侧副睾放入生理盐水中,剪碎,四层过滤,取滤液涂片,固定,2%伊红染色制片。镜检观察,每鼠计数1 000个精子的畸形数,计算精子畸形发生率,并用spss11.0进行统计分析。
1.5 30 d喂养试验
1.5.1 剂量组选择与受试物给予方式
SD大白鼠80只,雌雄各半,体重60 g~80 g将动物随机分为4组,每组20只,雌雄各半,分别作为祥品3个剂量组(1.88、3.75、7.5 g/kg,相当于人体推荐剂量的25、50、100倍),另设空白对照组,连续喂养30 d。根据本实验剂量设计要求及动物饲料摄入情况(约10 g/100 gBW/d),分别将样品281、563、1 125 g掺入饲料至15 kg,拌匀,经饲料机制成颗粒饲料,即成低、中、高三种不同样品含量的饲料,分别给三组动物喂饲。空白对照组给予不含样品的同种饲料。在高剂量组饲料中掺入样品达7.5%,根据受试蛋白含量调整高剂量组饲料蛋白质含量与对照组饲料一致为20%。空白对照组给予不含样品的基础饲料。
1.5.2 观察指标
1)一般情况每天观察动物1次。
2)体重生长情况每周称重1次。
3)饮料消耗及利用率每周添加饮料2次,称重并记录,同时记录散失的饮料量。
4)血液学检查于试验第30天股动脉以血进行血红蛋白的测定,红细胞、白细胞、血小板、网织红细胞计数及白细胞分类测定。
5)血液生化检查于试验第30天股动脉取血,分离血清,使用日立-7150全自动生化仪进行总蛋白(TP)、白蛋白(ALB)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、葡萄糖(GLU)、肌酐(CR)、尿素氮(BUN)、胆固醇(T-CHE)及甘油三酯(TG)的测定。
6)脏器重量及病理组织学检查试验结束后,采用股动脉放血处死大鼠,立即解剖进行大体检查。称取肝、脾、双侧肾和睾丸,分别计算脏体比;以甲醛液固定肝、肾、十二指肠、卵巢、睾丸。石蜡包埋切片,H.E染色后进行病理组织学检查。
2 结果与分析
2.1 急性经口毒性试验
急性经口毒性试验,见表1。
试验期间各组动物活动正常,毛色光泽度好,未见任何中毒症状和死亡,到期处死动物,大体解剖肉眼观察各脏器情况,未见异常。胶原蛋白片对雌雄小白鼠急性经口毒性试验的最大耐受剂量MTD均大于20 000mg/kg。根据急性毒性(LD50)剂量的分级标准,胶原蛋白片属无毒级。

表1 雌雄小鼠急性经口毒性试验结果Table1 Resuts of acute toxcity to male&female mice by oral administration
2.2 遗传毒性试验
2.2.1 Ames试验
在本实验条件下的二次试验中,受试物每皿8μg至5 000μg,在加与不加S9活化系统平板掺入法检测的回复菌落数小于溶剂对照的2倍,也未呈现剂量反应关系,样品Ames试验结果为阴性。即胶原蛋白片未见致突变作用。两次试验结果分别见表2、表3。

表2 Ames试验第一次测试结果Table2 The results of the first Ames test

表3 Ames试验第二次测试结果Table3 The results of the second Ames test
2.2.2 骨髓细胞微核试验
骨髓细胞微核试验,见表4。
结果表明,试验组小鼠在各试验剂量下嗜多染红细胞(PCE)微核出现率、PCE/成熟红细胞与阴性对照组之间的差异均不显著,而阳性对照组表现出强烈的致突变作用。经统计学分析,胶原蛋白片未见致突变作用。
2.2.3 小鼠精子畸形试验
小鼠精子畸形试验,见表5。
由表5可知,各剂量组小鼠的精子畸形发生率在正常范围内,阳性对照组(环磷酰胺组)与阴性对照组之间的差异极显著(P<0.01)。

表4 动物骨髓嗜多染红细胞微核发生率Table4 The incidence of polychromatic crythrocyte micronucleus of animals'marrow
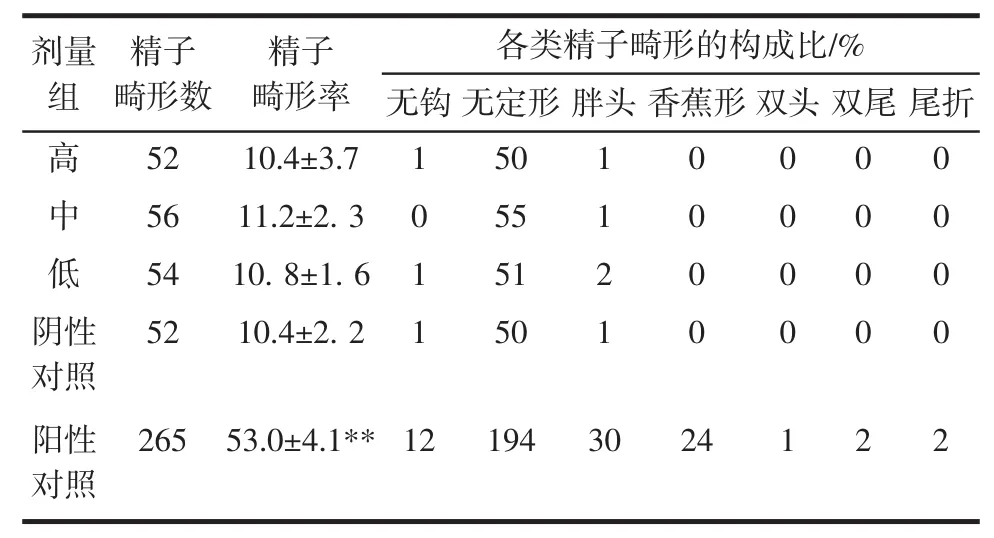
表5 胶原蛋白片对小鼠精子畸形发生率的影响Table5 The influence of collagen tablets on the incidence of the sperm deformity of mice
注:**表示与阴性对照组差异极显著(P<0.01)。
2.3 30 d喂养试验
2.3.1 一般情况
整个喂养期间,小鼠毛色正常,未见行为异常,无死亡发生。
2.3.2 食物利用率
以每100克饲料的大鼠增重克数计算食物利用率。由表6可知,各剂量组动物食物利用率与同性别对照组之间差异不显著(P>0.05)。

表6 胶原蛋白片30天喂养试验对大鼠总食物利用率的影响Table6 The effect of collagen tablets on the food utilization rate in the30 days feeding study
2.3.3 血常规及血生化指标
血常规及血生化指标,见表7、表8。
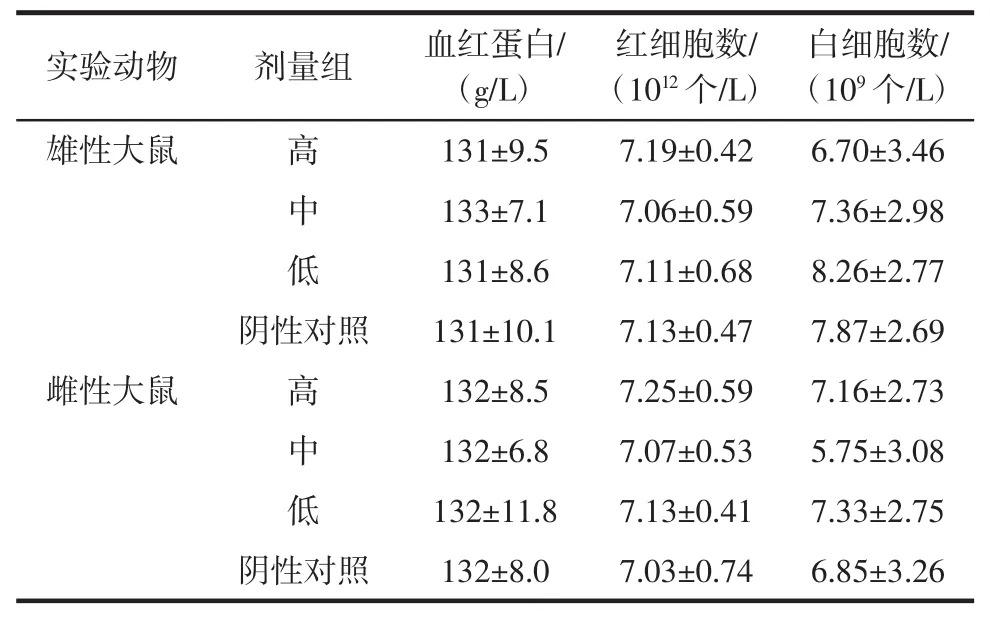
表7 胶原蛋白片30 d喂养试验大鼠血液学检查结果Table7 The results of collagen tablets on the blood test of the rats in the30 days feeding study
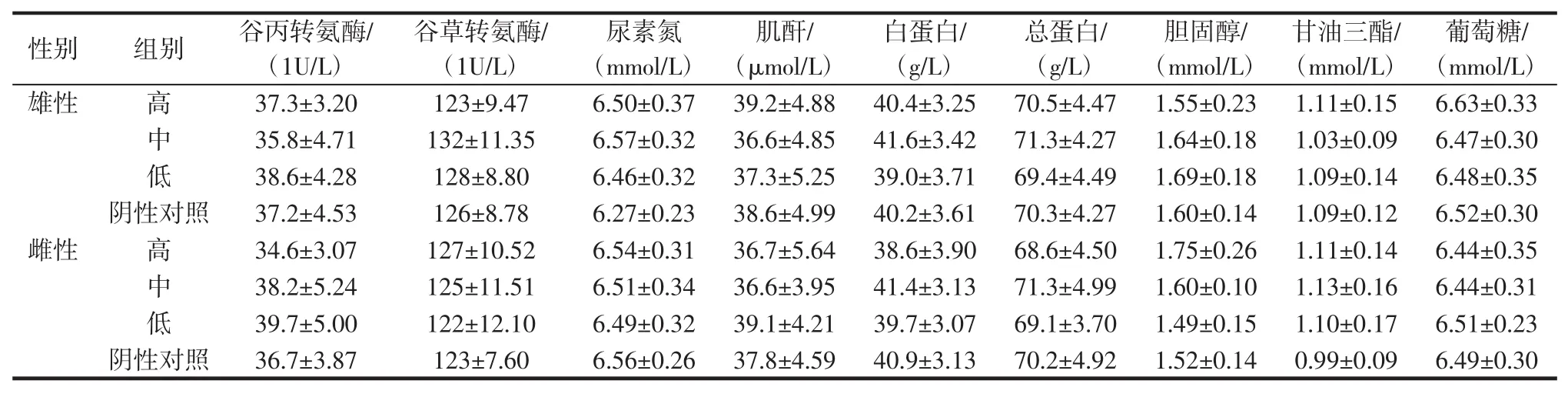
表8 胶原蛋白片30 d喂养试验大鼠的血清生化检验结果Table8 The results of collagen tablets on the Serum biochemical test in the30 days feeding study
由表7、表8可知,样品分别按高、中、低剂量给予各组大鼠30 d,对照组和各剂量组的白细胞计数及其分类均在正常值范围内。对照组和各剂量组的各项生化指标均在正常值范围内。用SPSS11.0对结果进行方差分析:样品各剂量组与对照组相比,均无显著性差异(P>0.05)。
2.3.4 脏体比
脏体比见表9。
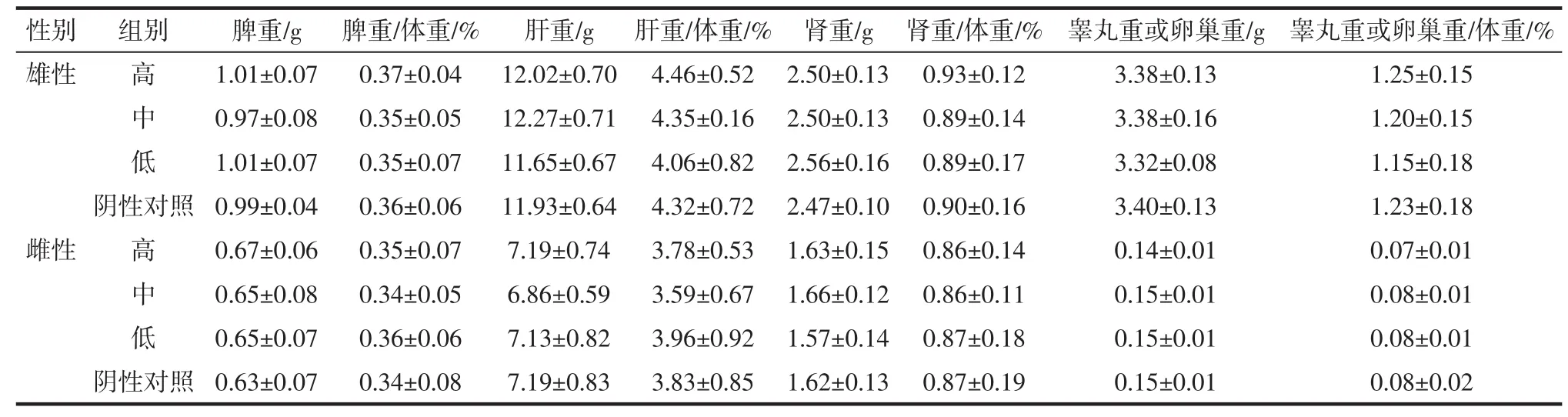
表9 胶原蛋白片30 d喂养试验对大鼠脏体比的影响Table9 The effet of collagen tablets on the Organ/body weight ratio in the30 days feeding study
由表9可知,各组的脏器绝对重量及其肝重/体重、脾重/体重、肾重/体重、睾丸重/体重比与对照组相比未见异常。
2.3.5 大体解剖及组织学检查结果
1)大体解剖检查样品喂养30 d后,对各组实验动物进行大体解剖,肉眼观察各组动物脏器未发现明显病变。
2)病理组织学检查,仅选高剂量组及正常对照组(每组20只,雌雄各半)作组织病理学检查。详细结果见下:①肝脏:对照组雌鼠见1例肝细胞轻度空泡变性、1例汇管区炎症细胞轻度浸润。雄鼠见.1例肝细胞轻度空泡变性、1例汇管区炎症细胞轻度浸润。高剂量组雌鼠见.2例有少量肝细胞嗜酸性变。雄鼠见2例肝细胞轻度空泡变性、1例肝细胞周围少量炎细胞浸润、1例肝细胞轻度嗜酸性变、1例汇管区轻度炎症细胞浸润。②肾脏:对照组雌鼠肾皮质部见4例肾小管上皮细胞轻度肿胀、1例上皮细胞轻度空泡变性、2例肾小管管腔内少量管型,以及肾髓质部1例曲细精管中少量管型、1例间质炎细胞浸润。雄鼠肾皮质部有2例肾小管管腔内少量管型。高剂量组雌鼠肾皮质部见3例肾小管上皮细胞轻度肿胀、2例轻度空泡变性、3例肾小管管腔内少量管型,以及肾髓质部1例间质炎细胞浸润。雄鼠肾皮质部见3例肾小管管腔内少量管型,以及肾髓质部1例曲细精管中少量管型。③脾脏:对照组雌鼠脾脏未见异常,雄鼠3例脾脏红髓轻度扩张。高剂量组见雌鼠2例、雄鼠3例脾脏红髓轻度扩张。此外雌鼠还有1例造血细胞轻度增生。④胃肠:对照组雌鼠见胃黏膜下3例轻度炎细胞浸润。雄鼠2例黏膜下少量炎细胞浸润、以及1例轻度水肿。高剂量组雌鼠胃粘膜下分别有3例轻度炎细胞浸润及水肿。雄鼠1例黏膜下少量炎细胞浸润。⑤睾丸:对照组雄鼠睾丸可见3例间质轻度水肿。高剂量组有1例间质轻度水肿。⑥卵巢:对照组与高剂量组雌鼠均有1例卵巢轻度囊肿改变,而且高剂量组还有1例少量卵巢细胞变性。
3 小结
研究结果表明,胶原蛋白片小鼠经口LD50>20.0 g/(kg·bw),属实际无毒;对基因、体细胞及生殖细胞无明显致突作用;受试物分别按照高、中、低剂量喂养大鼠30天,结果表明试验期间动物未出现拒食现象,动物生长活动正常,皮毛浓密有光泽。各剂量组动物体重、食物利用率、主要脏体比与对照组差异不显著。对照组和各剂量组的白细胞计数及其分类、红细胞计数、血红蛋白及各项生化指标均在正常值范围内。大体解剖及组织学检查未发现该受试物对各剂量组被检动物的受检脏器产生有意义的病理变化。
[1]刘波,章世元,姜德兴,等.蛋白质氨基酸营养免疫研究[J].动物医学与动物科学,2002,19(8):38-41
[2]王秋卓.论胶原蛋白对人类健康的特殊作用[J].价值工程,2012, 31(5):320-322
[3]郭爱平.免疫营养与抗肿瘤治疗的研究进展[J].临床肿瘤学杂志, 2006,11(4):314-316
[4]王洪荣,季昀.氨基酸的生物活性及其营养调控功能的研究进展[J].动物营养学报,2013,25(3):447-457
[5]武覆青.开发氨基酸营养保健制剂提高国民健康素质[J].中国制药信息,2010,26(6):38-40
Toxicological Safety Assessment on Collagen Tablet
YANG Ya-fei
(By-health Incorporated Company,Guangzhou 510663,Guangdong,China)
The toxicological safety assessment on collagen tablets was carried out in order to judge whether they do harm on human body.The acute toxicity,mutagenicity and subchronic toxicity were studied by using acute toxicity test,Ames test,mice marrow micronucleus experiment,mice sperm malformation experiment and 30-days feeding test.Results showed that the LD50 of acute toxicity test was over 20 000 mg/kg which signified harmlessness of the collagen tablets.
collagen talets;acute toxicity;micronucleus;sperm deformity;Ames test
10.3969/j.issn.1005-6521.2014.16.030
2013-05-26
杨亚飞(1979—),女(汉),硕士研究生,研究方向:药剂学。
