烟草中果胶分析的前处理方法研究
2014-03-21程志颖孔浩辉王佳珺胡漫妮郭璇华
程志颖,孔浩辉,*,王佳珺,胡漫妮,郭璇华
(1.广东中烟工业有限责任公司,广东广州510385;2.华南理工大学,广东广州510641)
烟草中果胶分析的前处理方法研究
程志颖1,孔浩辉1,*,王佳珺1,胡漫妮2,郭璇华2
(1.广东中烟工业有限责任公司,广东广州510385;2.华南理工大学,广东广州510641)
研究采用酸醇法快速萃取烟草及烟草制品中的糖和色素。以除糖液中糖含量和吸光度为指标,通过单因素试验和正交试验,考察萃取溶剂的酸度、乙醇浓度、萃取温度和萃取时间对除糖、除色素效果及果胶流失率的影响,开发出一种快速有效地除糖、除色素而果胶流失率低的果胶分析前处理方法。
酸醇;烟草;果胶;前处理
果胶是植物体中一类复杂的胶体性质糖类,主要存在于相邻细胞壁的中间层及细胞液中。果胶的分子量约为2万~40万,以α-1,4键合的半乳糖醛酸为基本结构,其中半乳糖醛酸的羧基可以不同程度地被酯化。酯化程度高的果胶物质是与纤维素等细胞壁组成结合在一起的多聚半乳糖醛酸,不溶于水,称为原果胶;酯化程度不高的果胶物质多存在于细胞汁液中,是水溶性的,称为水溶性果胶。烟叶中的果胶对烟叶的吸湿性[1-2]、卷烟香气[3]、烟草吸味[4]等有较大的影响,而来源和加工工艺不同的烟叶中果胶的含量有较大的差异。因此,测定烟草及烟草制品中的果胶含量对烟草和烟草制品的品质监控有重要意义。
果胶的测定方法有直接法和间接法。直接法是将果胶分离出来后,用重量法直接测定果胶的含量[5],其操作麻烦,费时久。目前使用较为广泛的方法是间接法,即首先采用酸解或酶解的方法将果胶分解成半乳糖醛酸,再通过测定半乳糖醛酸的含量来表征果胶的含量。测定半乳糖醛酸含量的方法有光学分析法[6]、色谱法[7-8]等。烟草中果胶的测定方法有比色法[9-10]、酶解-流动分析法[11]、酶解-离子色谱法[12]等。由于烟草中含有大量的水溶性糖和色素,它们对流动分析法和比色法的测定直接造成干扰,影响测定的准确性。对于酶解离子色谱法来说,由于可溶性糖对果胶酶活性有抑制作用,会造成测定结果偏低,而且大量的糖和色素如果直接上柱分析对色谱柱易造成污染,影响柱的寿命。因此,无论采用哪种方法分析,都必须先进行除糖、除色素的预处理。除糖、除色素的方法有的采用80%的乙醇先浸泡一夜后再回流1 h;也有直接采用80%的乙醇回流1次~2次,每次1 h,这些方法均耗时较长,操作也较麻烦。本文研究用酸醇法除糖和除色素,开发了一种快捷有效地除糖和除色素而果胶流失低的前处理方法。
1 材料与方法
1.1 主要仪器
连续流动分析仪:SKALAR SAN++SYSTEM;紫外分光光度计:PerkinElmer;离子色谱仪:戴安ICS3000;电子分析天平:SarforiusBP0210S;电热恒温水浴锅:上海精宏实验设备有限公司。
1.2 主要材料与试剂
半乳糖醛酸(AR):Sigma;果胶酶:和氏璧生物技术有限公司;乙醇(AR):广州化学试剂厂;盐酸(AR):衡阳市凯信化工试剂有限公司;醋酸钠:Dionex;氢氧化钠(50W/W)、苯甲酸:Sigma。
1.3 方法
1.3.1 样品的前处理
准确称取1 g(精确到0.000 1 g)样品于250mL的圆底烧瓶中,加入一定浓度的酸-醇溶液100mL,在一定温度的水浴锅中回流一定时间,然后用玻璃纤维滤纸抽滤,滤渣弃去,滤液定容到150mL,此为溶液A。
移取100.0mL溶液A于原来的圆底烧瓶中,在100℃水浴下浓缩至15mL左右,冷却后转移到100mL的容量瓶中,用一级水定容,此为溶液B。
1.3.2 基本分析方法
1.3.2.1 酸醇除糖液中色素的测定
取溶液A直接在520 nm波长处测定其吸光值,以吸光值为指标比较不同条件下除色素的效果。
1.3.2.2 酸醇除糖液中糖含量的测定
移取B溶液10.00mL,加入10%的醋酸溶液10.00mL,按照YC/T159-2002《烟草及烟草制品水溶性糖的测定连续流动法》[13]方法测定除糖液中糖的含量。
1.3.2.3 酸醇处理液中果胶的分析
移取B溶液10.00mL于100mL的磨口三角瓶中,依次加入pH=4.0的乙酸-乙酸钠的缓冲溶液20mL,果胶酶溶液5.0mL,在55℃水浴中震荡1 h。酶解液移入100mL的容量瓶中,用0.1%(质量分数)的苯甲酸溶液定容,此溶液经过0.45μm的针头式过滤器过滤后,按照YC/T346-2010《烟草及烟草制品果胶的测定离子色谱法》[14]方法进行离子色谱分析。
2 结果与讨论
2.1 单因素试验
2.1.1 乙醇浓度的影响
称取1 g(精确到0.000 1 g)样品14份于14个250mL的圆底烧瓶中,7份分别加入乙醇浓度为0%、20%、40%、60%、70%、80%、90%的乙醇-水溶液100mL;其余7份分别加入盐酸浓度为0.01mol/L,乙醇浓度为0%、20%、40%、60%、70%、80%、90%的酸醇-水溶液100mL,然后置于90℃水浴锅中回流20min,按照1.3方法测定除糖、除色素的效果以及果胶流失率,实验结果见图1~图3。

图1 乙醇浓度对除色素效果的影响Fig.1 Effect of ethanol concentration on pigment elimination
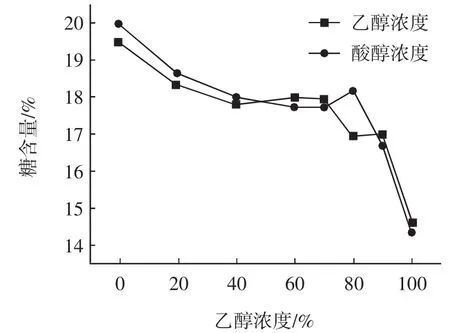
图2 乙醇浓度对除糖效果的影响Fig.2 Effect of ethanol concentration on sugar elimination

图3 乙醇浓度对果胶流失率的影响Fig.3 Effect of ethanol concentration on outflow rate of pectin
从以上的实验结果可见,在保证果胶流失率低的情况下,即乙醇浓度在60%~90%范围内,酸醇溶液的除糖、除色素的效果及果胶流失率均优于乙醇溶液。且以乙醇浓度为80%的酸醇溶液为最佳。
2.1.2 酸度的影响
称取1g(精确到0.0001g)样品8份于8个250mL的圆底烧瓶中,分别加入乙醇浓度为80%,盐酸浓度分别为0.000、0.001、0.005、0.010、0.015、0.020、0.025、0.030 mol/L的酸醇溶液,置于90℃水浴锅中回流20min,按照1.3方法测定除糖、除色素的效果以及果胶流失率,实验结果见图4~图6。
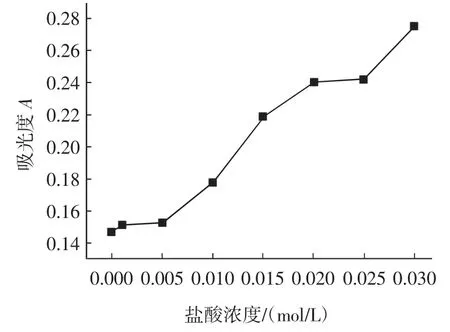
图4 盐酸浓度对色素去除效果的影响Fig.4 Effect of HCl concentration on pigment elimination
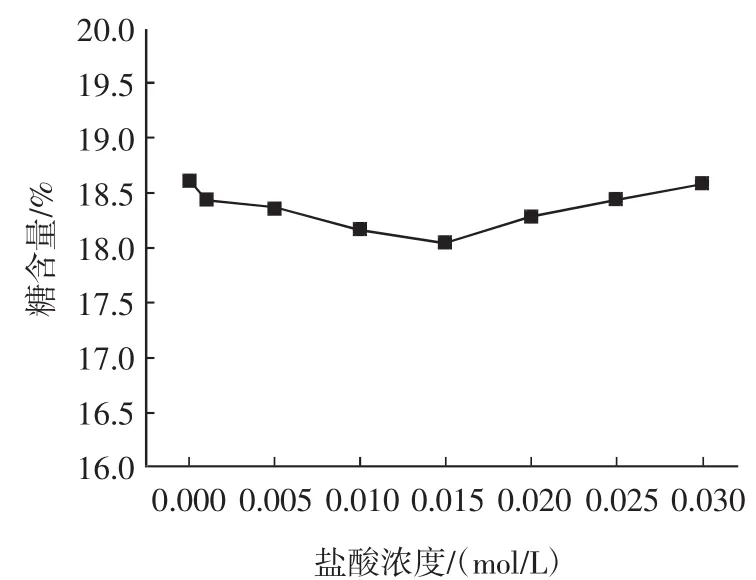
图5 盐酸浓度对除糖效果的影响Fig.5 Effect of HCl concentration on sugar elimination

图6 盐酸浓度对果胶流失率的影响Fig.6 Effect of HCl concentration on outflow rate of pectin
由图4~图6可见,色素的去除效果随着酸度增大而增加;糖的去除效果受酸度的影响较小;而果胶流失率在盐酸的浓度为0~0.015mol/L的范围内随着盐酸浓度的增大而减小,然后又逐渐上升。这是由于酸可以破坏薄壁细胞组织,使细胞中的色素溶于萃取剂中,而细胞壁上的原果胶也转化成水溶性的果胶,甚至分解成半乳糖醛酸。但由于萃取剂含有80%的乙醇,果胶不溶于醇而沉淀出来,据资料报道[15],乙醇对果胶的絮凝作用在痕量电解质存在的条件下会更加完全,在酸醇溶液中,盐酸起了酸和电解质的作用。且由实验得:0.015mol/L的盐酸能充分使果胶沉淀。
2.1.3 提取温度的影响
称取1g(精确到0.0001g)样品6份于6个250mL的圆底烧瓶中,加入盐酸浓度为0.010mol/L、乙醇浓度为80%的酸醇溶液100mL,分别置于50、60、70、80、90、100℃水浴中回流20min,然后按照1.3方法测定除糖、除色素的效果,实验结果见图7~图8。
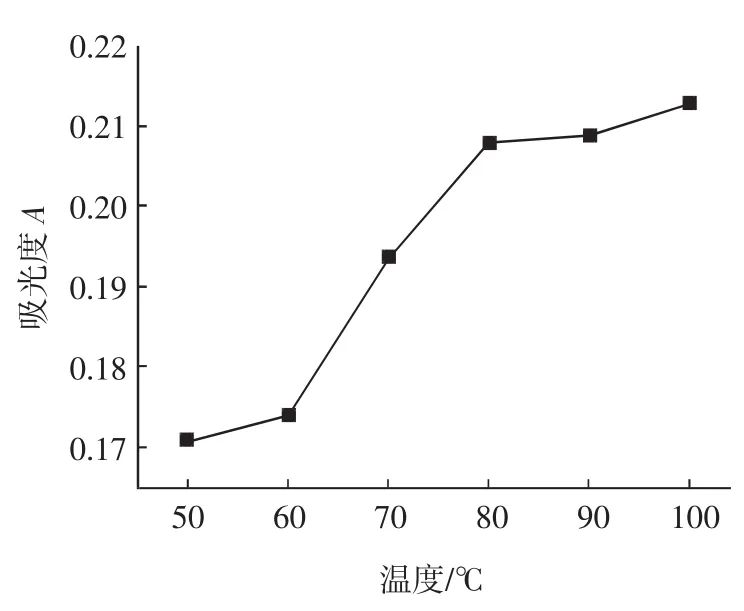
图7 温度对色素去除效果的影响Fig.7 Effect of temperature on pigment elimination

图8 温度对除糖效果的影响Fig.8 Effect of temperature on sugar elimination
从实验结果可知,色素的去除效果随着温度的上升而增加;而除糖效果则在80℃~100℃才随着温度的上升而上升,这是由于在50℃~80℃范围内,溶液尚未沸腾,而糖在低温下可溶解,但是色素是温度越高溶解度越大。由于乙醇的沸点较低,80%的乙醇在90℃时已处于沸腾的状态,对萃取体系起到搅拌的作用,温度越高,沸腾程度越激烈,因而溶剂与样品接触的越均匀。因此温度可以选择为90℃~100℃。
2.1.4 提取时间的影响
称取1g(精确到0.0001g)样品8份于8个250mL的圆底烧瓶中,加入盐酸浓度为0.010mol/L的80%的酸醇溶液,置于90℃水浴锅中回流10、15、20、25、30、40、50、60min,然后按照1.3方法测定除糖、除色素的效果,实验结果表明,回流时间10min~60min对除糖、除色素的效果差别不大,从节省时间上来说,20min已经足够。
2.2 除糖和除色素效果的正交试验
以除糖液中糖含量、除糖液吸光度和滤渣酶解液的吸光度为指标,对提取温度、酸度、乙醇浓度、提取时间4个主要因素采用L9(34)进行正交实验,正交实验的因素水平见表1。
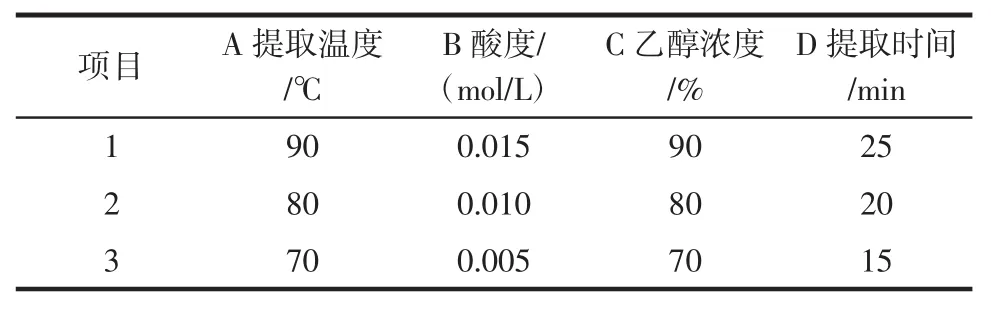
表1 正交实验因素与水平Table1 The factors and levels of orthogonal experiment
准确称取1g(精确到0.0001g)样品9份于250mL的烧瓶中进行实验,样品回流后过滤,滤液按照1.3方法测定除糖含量和除糖液的吸光度。滤渣放回原烧瓶中,加入100mL 2mol/L的盐酸水溶液,于90℃下回流1 h,用蒸馏水稀释至250mL。过滤后测定该溶液的吸光度,实验结果见表2~表4。

表2 样品中糖含量的正交试验结果Table2 The orthogonal results of sugar content
由极差分析可知,各因素的主次顺序为:乙醇浓度>酸度>提取时间>提取温度,最佳提取条件为A1B2C3D2,即提取温度为90℃,酸度为0.010mol/L,乙醇浓度为70%,提取时间为20min。
由以上极差分析可知,各因素主次顺序为:酸度>乙醇浓度>提取温度>提取时间。样品的最佳提取条件为A1B1C3D1,提取温度90℃,酸度0.015mol/L,使用70%乙醇提取25min。

表3 除糖液中吸光度的正交试验结果Table3 The orthogonal results of absorbance in the solution A
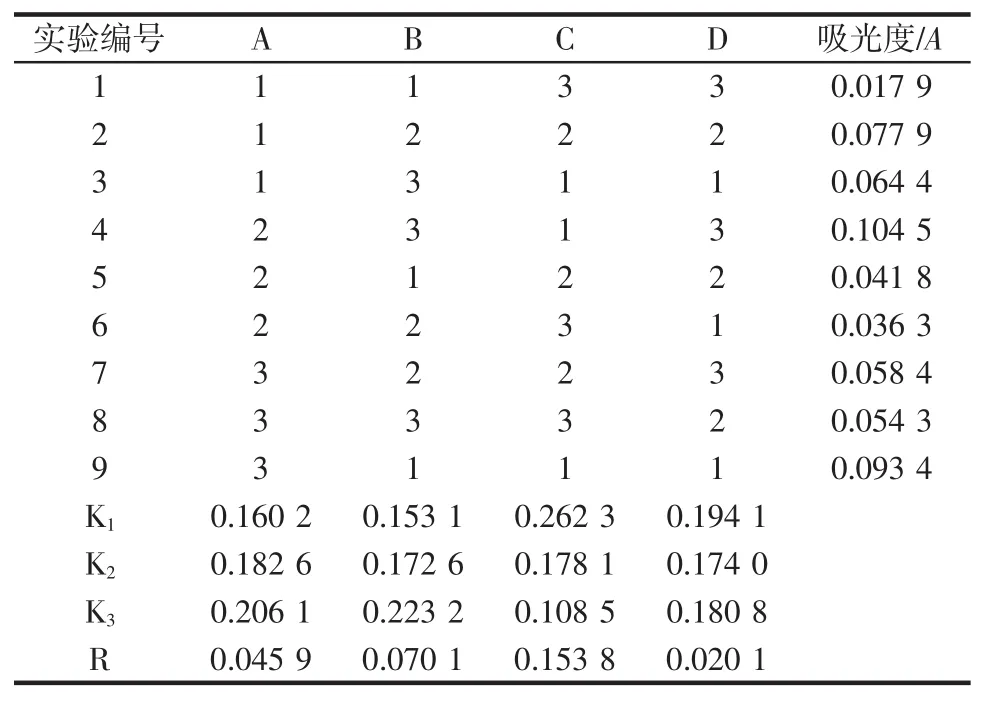
表4 滤渣酸解液吸光度的正交试验结果Table4 The orthogonal results of absorbance in the enzymolysis solution
由以上极差分析可知,各因素主次顺序为:乙醇浓度>酸度>提取温度>提取时间。由于分析的是滤渣酸解液的吸光度值,故其吸光度值越小,表明除糖、除色素越完全,故由实验得到滤渣酸解液的吸光度最低的提取条件为A1B1C3D2,提取温度90℃,酸度0.015mol/L,使用70%乙醇提取20min。
正交试验的结果与单因素试验结果基本相符,除糖液中的正交试验结果与滤渣酶解液中的实验结果也基本一致。故综合各方面的因素考虑,除糖、除色素的条件为:乙醇浓度为70%~80%,盐酸浓度为0.010mol/L~0.015mol/L,提取温度为90℃~100℃,提取时间为20min~25min。
2.3 不同前处理方法的对比实验
2.3.1 除糖除色素效果的对比实验
准确称取1 g(精确到0.000 1 g)样品6份于6个250mL的圆底烧瓶,1~3号样品加入含0.01mol/L盐酸的80%的乙醇-水溶液100mL,置于90℃水浴锅中回流20min,4~6号样品按YC/T346-2010[13]方法加入80%的乙醇-水溶液100mL,置于100℃水浴锅中回流1 h。冷却后过滤,滤液按照1.3方法测定糖含量,滤渣放回原烧瓶中,加入100mL 2mol/L的盐酸溶液,于90℃水浴锅中回流1 h,用蒸馏水稀释至250mL,过滤后测滤液的吸光度,结果见表5。

表5 不同前处理方法的对比实验Table5 The comparative experiments of different pretreatment methods
从以上实验结果可见,酸醇法的除糖效果与乙醇法基本相同,但除色素的效果明显优于乙醇法,而且时间可以节省三分之二。
2.3.2 果胶流失率的对比实验
准确称取1 g(精确到0.000 1 g)样品6份,1~4号置于4个250mL的圆底烧瓶,分别加入盐酸浓度为0.000、0.005、0.010、0.015mol/L的80%的用乙醇溶液100mL,置于90℃水浴锅中回流20min,过滤后将滤液移至原来的圆底烧瓶中,100℃下蒸去乙醇后过滤,滤液用一级水定容至150mL。5~6号样品按YC/T159-2002[14]方法,置于250mL的磨口三角瓶中,加入5%(体积分数)的醋酸溶液100mL,振荡30min后过滤,滤液用5%的醋酸定容至150mL。
各取上述溶液2.00mL置于150mL的磨口三角瓶中,依次加入20mL pH=4.0的乙酸-乙酸钠缓冲溶液,5mL果胶酶溶液,在55℃下恒温振荡1 h,然后转移到50mL的容量瓶中,用0.1%的苯甲酸定容。然后用经过0.45μm的过滤膜过滤后上离子色谱进行分析,结果见表6。

表6 不同前处理方法的果胶流失率Table6 The outflow rate of pectin with different pretreatment methods
从实验结果可见,在盐酸浓度为0.005mol/L~0.015mol/L的范围内,酸醇溶液作为萃取剂时果胶流失率明显低于80%的乙醇溶液,而采用5%的醋酸溶液作为萃取剂时,果胶流失严重。
3 结论
采用盐酸浓度为0.01mol/L、乙醇浓度为80%的酸醇溶液作为萃取剂,可以快捷、有效地去除烟草中的水溶性糖和色素,而且果胶的流失率最低。
[1]Körner R,Limberg G,Christensen TM,et al.Sequencing of Partially Methyl-Esterified Oligo gal acturo-nates by Tandem Mass Spectrometry and Its Use To Determine Pectinase Specificities.Anal. Chem.1999,71(7):1421-1427
[2]杜继煜,白岚,白宝璋.果胶的化学组成和基本特性[J].农业与技术,2002,22(5):72-76
[3]左天觉.烟草的生产、生理和生物化学[M].朱尊权,等,译.上海:上海远东出版社,1993:371-373
[4]王瑞新.烟草化学[M].北京:中国农业出版社,2003:44
[5]李登昌,刘步东.银耳和黑木耳中果胶含量测定方法的研究[J].考试周刊,2010(10):173-174
[6]饶巍,庹苏行,钟科军,等.烟草果胶的提取分析研究进展[J].广州化学,2009,34(1):71-76
[7]吴玉萍,杨光宇,王东丹.高效液相色谱法测定烟草中的果胶含量[J].光谱实验室,2004(1):183-185
[8]王岚,施红林,李忠,等.高效液相色谱法测定烟草中淀粉和果胶的含量[J].理化检验-化学分册,2006(3):174-175
[9]张小玲.果胶的咔唑硫酸分光光度测定法研究[J].甘肃农业大学学报,1999(1):75-78
[10]马东萍,刘维涓,卫青,等.3,5-二硝基水杨酸显色法测定烟草中的果胶[J].烟草科技,2006(8):38-41
[11]徐志强,陈开波,蔡兵,等.酶解-流动分析法测定烟草中的果胶含量[J].烟草科技,2005(9):26-28
[12]饶巍,庹苏行,钟科军,等.酶解-离子色谱法法测定烟草中的果胶[J].化学研究,2010,21(3):72-74
[13]国家烟草专卖局.YC/T346-2010烟草及烟草制品果胶的测定离子色谱法[S].中国标准出版社,2010-11-01
[14]国家烟草专卖局.YC/T159-2002烟草及烟草制品水溶性糖的测定连续流动法[S].中国标准出版社,2002-12-01
[15]陈熠,熊远福,文祝友,等.果胶提取技术研究进展[J].中国食品添加剂,2009(3):80-84
The Research on Pretreatment Methods of Pectin in The Tobacco
CHENG Zhi-ying1,KONG Hao-hui1,*,WANG Jia-jun1,HU Man-ni2,GUO Xuan-hua2
(1.China Tobacco Guangdong Industrial Co.,Ltd,Guangzhou 510385,Guangdong,China;2.South China University of Technology,Guangzhou 510641,Guangdong,China)
In this paper,we extracted the sugar and pigment quickly in tobacco and tobacco products by acidethanol solvent.Utilizing the sugar content and absorbance as index,we investigated the effects of acidity,ethanol concentration,extraction temperature and time on the elimination of sugar,pigment and the out flow rate of pectin by the single factor tests and orthogonal experiments.We developed a pretreatment method of getting rid of the sugar and pigment fast with low out flow rate of pectin.
Acid-methanol solvent;tobacco;pectin;pretreatment
10.3969/j.issn.1005-6521.2014.16.004
2013-07-02
广东中烟工业有限责任公司科技项目“连续流动法测定烟草及烟草制品中的果胶含量”(粤烟工[2011]科字第014号)
程志颖(1974—),女(汉),工程师,硕士,研究方向:烟草化学。
*通信作者:孔浩辉(1974—),高工,硕士,研究方向:烟草、烟用材料和香精香料分析与研究。
