乌鸡肽免疫调节作用的研究
2014-03-21魏颖谷瑞增林峰刘艳张海欣蔡木易
魏颖,谷瑞增,林峰,刘艳,张海欣,蔡木易,*
(1.中国食品发酵工业研究院,北京100027;2.北京市蛋白功能肽工程技术研究中心,北京100027)
乌鸡肽免疫调节作用的研究
魏颖1,2,谷瑞增1,2,林峰1,2,刘艳1,2,张海欣1,2,蔡木易1,2,*
(1.中国食品发酵工业研究院,北京100027;2.北京市蛋白功能肽工程技术研究中心,北京100027)
对乌鸡肽的基本理化指标进行了测定,并对其免疫调节活性进行研究。应用WST-8法检测不同浓度乌鸡肽对小鼠脾淋巴细胞增殖的影响,以吞噬能力和NO的生成量为指标评价乌鸡肽对小鼠腹腔巨噬细胞活力的影响。乌鸡肽主要含有相对分子量低于1 000U的短肽,对ConA诱导的T-淋巴细胞增殖和LPS诱导的B-淋巴细胞增殖均有显著的促进作用。浓度为100μg/mL时,显著促进小鼠腹腔巨噬细胞吞噬能中性红的能力和NO生成。乌鸡肽具有较好的增强免疫调节的能力。
乌鸡肽;淋巴细胞;巨噬细胞;免疫调节
乌鸡又称乌骨鸡(Gallus gallus dome sticus Brisson),是一种具有特殊经济价值的珍禽[1-2]。乌鸡的皮肤、肌肉、骨头等部位都呈现乌黑色。现代医学研究,乌鸡内含丰富的黑色素,蛋白质,B族维生素等18种氨基酸和18种微量元素,胆固醇和脂肪含量却很低。乌鸡肉中粗蛋白含量高达63.79%,比普通大黄鸡高1.52倍,鲜肉中氨基酸含量较高,必需氨基酸齐全,且第一、二、三限制性氨基酸含量较高[3-4],是营养价值极高的滋补品,被人们称作“名贵食疗珍禽”。
中医认为:乌鸡气味甘、微温、无毒,有补中止痛、滋补肝肾、益气补血、滋阴清热、调经活血、止崩治带等功效,是补虚劳、养身体的上好佳品。现代医学研究发现:乌鸡含有人体不可缺少的赖氨酸、蛋氨酸和组氨酸,食用乌鸡可以明显调节人体免疫功能、延缓衰老、强筋健骨。
民间常将乌鸡煮之,饮汤食肉。因此,乌鸡的水溶成分是最为广泛的服用形式,是主要的滋补药效成分。本研究选取乌鸡蛋白为研究对象,将其酶解制备成易于人体吸收、利用的短肽,相对分子量低于1000U。采用体外细胞模型,研究不同浓度的乌鸡肽对小鼠脾淋巴细胞增殖和小鼠腹腔巨噬细胞活力的影响,旨在为乌鸡的开发、利用以及精深加工奠定理论基础。
1 材料与方法
1.1 材料与试剂
乌鸡肽干粉:北京中食海氏生物技术有限公司;小鼠(Balb/c,6~8周龄):北京维通利华实验动物技术有限公司。刀豆蛋白、脂多糖:Sigma公司;RPMI-1640干粉培养基和胎牛血清:Gibco公司;胰蛋白酶和中性红:Amresco公司;台盼蓝、红细胞裂解液、Hepes、NO试剂盒和CCK-8:碧云天生物技术研究所。缓冲液PBS在实验室配置,装瓶灭菌后待用。
1.2 仪器与设备
Spectra MR多功能酶标仪:美国dynex;DL-CJ-IND医用型洁净工作台:北京东联哈仪制造有限公司;HF90CO2培养箱:上海力申科学仪器有限公司。
1.3 试验方法
1.3.1 基础理化分析
1.3.1.1 水分测定[5]
采用常压干燥法测定乌鸡肽水分含量。
1.3.1.2 灰分的测定[6]
采用灼烧法测定乌鸡肽灰分含量。
1.3.1.3 脂肪含量测定[7]
采用索式提取法测定乌鸡肽脂肪含量。
1.3.1.4 蛋白质含量的测定[8]
采用凯氏定氮法测定乌鸡肽蛋白质含量。
1.3.1.5 分子量分布
1)液相色谱条件
色谱柱:TSKgelG2000 SWXL 300mm×7.8mm(日本TOSOH公司);流动相:V(乙腈):V(水):V(三氟乙酸)=45:55:0.1;检测器:PDA检测器;检测波长:UV220 nm;流速:0.5mL/min;柱温:30℃;进样体积:10μL。
2)相对分子量校正曲线制作
四种不同相对分子质量的肽标准品为:细胞色素C(MW12500),杆菌酶(MW1450),乙氨酸-乙氨酸-酪氨酸-精氨酸(MW451),乙氨酸-乙氨酸-乙氨酸(MW 189)。
分别用流动相配制成0.1%(W/V)不同相对分子质量的肽标准品溶液,用孔径为0.2μm聚四氟乙烯过滤膜过滤后分别进样,得到系列标准品的色谱图。以相对分子质量的对数(lgMW)对保留时间作图得到相对分子质量校正曲线及其方程。
3)样品的制备
称取样品20.0mg于10mL容量瓶中,用流动相定容至刻度,超声振荡10min,使样品充分溶解混匀,用孔径为0.2μm聚四氟乙烯过滤膜过滤后,上机进样。
4)实验数据分析与处理
将制备的样品溶液在上述色谱条件下分析,然后用数据处理软件将样品的色谱数据代入校正曲线方程中进行计算,即可得到样品的肽的相对分子质量及其分布范围。用峰面积归一化法计算相对分子质量分布范围[9]。
1.3.2 乌鸡肽对小鼠淋巴细胞增殖的影响
1.3.2.1 小鼠脾细胞悬液的制备
将小鼠(Balb/c)拉颈处死,于75%乙醇中浸泡5min进行消毒处理,无菌分离完整脾脏,用PBS冲去浮血,剥除结缔组织及脂肪成分。注射器吸取约5mL PBS,轻轻插入脾内吹出细胞,重复操作数次至脾外膜透明,剩余脾组织剪成大小1mm3小块,剪碎后置于小烧杯上的200目不锈钢滤网上,用注射器针芯研磨,PBS液洗涤,收集冲洗液至离心管,1 200 r/min离心5 min,弃上清液,加入3 mL红细胞裂解液,静置2 min,加入10mL PBS终止反应,离心(1 200 r/min,5 min)弃上清,用PBS液洗两次,离心(1 200 r/min,5 min),用RPMI-1640不完全培养基洗一次,离心(1 200 r/min,5min),弃上清。加适量RPMI-1640完全培养基(含10%胎牛血清、100U/mL青霉素、100μg/mL链霉素和10mmol/LHepes)。调整细胞浓度至2×106个细胞/mL,台盼兰染色检测细胞存活率大于95%。
1.3.2.2 乌鸡肽对脾淋巴细胞增殖的影响
将脾细胞悬液(2×106个细胞/mL)按100μL/孔加入到96孔培养板中,再添加10μLConA/LPS(5μg/mL)和10μL不同浓度的样品溶液,每个浓度做6次重复,将培养板置于37℃、5%CO2的培养箱中培养72 h。
将脾细胞悬液(2×106个细胞/mL)按100μL/孔加入到96孔培养板中,再添加10μLConA/LPS(终浓度为5μg/mL)或不添加ConA,10μL样品溶液(终浓度为1、10、50、100、200和400μg/mL),设置对照组、模型组和样品组,每组做6次重复,将培养板置于37°C、5% CO2的培养箱中培养72 h。
选用CCK-8试剂盒反映样品对脾细胞和淋巴细胞增殖能力,结果用刺激指数(SI)表示,计算如下:

1.3.3 乌鸡肽对小鼠腹腔巨噬细胞活性的影响
1.3.3.1 小鼠腹腔巨噬细胞的制备
Balb/c小鼠,于实验前3天腹腔注射1.5mL 4%肉汤淀粉溶液。拉颈处死小鼠,于无菌工作台上将其腹部皮肤剥离,用一次性注射器向腹腔内注入RPMI-1640不完全培养液4mL,轻柔腹部2min~3min,用一次性注射器取其腹部液体,反复2次~3次。1 200 r/min离心8min收集细胞,洗涤2次,在倒置显微镜下进行细胞计数,用含10%灭活胎牛血清的RPMI-1640培养液调整细胞密度达1×106个/mL,加入96孔细胞培养板中,每孔100μL,将细胞培养板放入37℃、5% CO2饱和湿度培养箱中培养2.5 h,吸弃上清,用预温培养基洗去未贴壁细胞,再加入含10%灭活胎牛血清的RPMI-1640培养液,制备96孔板巨噬细胞单层。每只小鼠可产生2×106~3×106细胞,其中90%为巨噬细胞。
1.3.3.2 乌鸡肽对小鼠腹腔巨噬细胞吞噬活性的测定
阳性对照组每孔加入10μLLPS(浓度30μg/mL),试验组每孔加入10μL样品,试验组分为LPS与提取物共同作用组和提取物单独添加组两种。阴性对照组、阳性对照组和试验组各设6个复孔,于37℃、5% CO2饱和湿度培养箱内培养。
培养24 h后,用预温的无血清培养液洗涤细胞3次,每孔加入200μL预温的0.1%中性红溶液,于37℃,5%CO2培养箱内继续培养1 h;倾去上清液,用预温RPMI-1640培养液清洗三遍,洗去未被吞噬的中性红;每孔加入200μL细胞溶解液(含1%(体积分数)乙酸的50%(体积分数)乙醇溶液),室温下放置2h~3 h,待细胞溶解后,用酶标仪测定OD550值。吞噬指数(Pinocytosis index,PI)计算如下:

1.3.3.3 乌鸡肽对巨噬细胞NO生成量的影响
小鼠腹腔巨噬细胞经样品24 h干预后,收集上清液,依据NO试剂盒说明书测定NO生成量。
1.3.4 统计学处理
采用SPSS13.0统计软件对数据进行处理,实验结果以均值±标准偏差(Mean±SD)表示,并采用组间t检验,P<0.05具有显著性差异,P<0.01具有极显著性差异。
2 结果与分析
2.1 乌鸡肽基础理化性质分析
由实验得出的乌鸡肽基础理化指标结果见表1。乌鸡肽中87.69%以上为蛋白,相对分子量低于1 000U的组分总共占96.88%。研究表明,肽的生物活性与分子量大小有关,能在体内起活性作用的肽大多是1000U以下的小肽[10]。如果按氨基酸的平均分子量137 U来计算,本研究选取的乌鸡肽多是八肽以下的低聚肽。

表1 乌鸡肽基础理化成分含量Table1 Data of compositions analysis for Black-bone chicken peptide
2.2 乌鸡肽对小鼠脾淋巴细胞增殖的影响
乌鸡肽对小鼠脾淋巴细胞增殖的影响见图1。
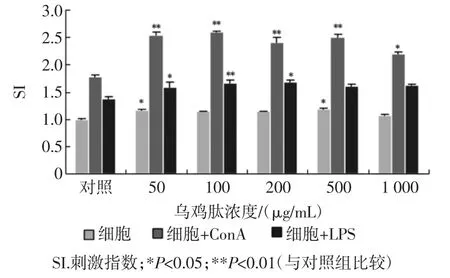
图1 乌鸡肽对小鼠脾细胞增殖的影响Fig.1 Effect of oligopeptides from Black-bone chicken on the proliferation of murine splenocytes.
如图1所示,乌鸡肽单独作用能够刺激小鼠脾细胞增殖。与对照组相比,乌鸡肽在作用浓度50μg/mL~1 000μg/mL之间时,其SI值为1.08~1.19。浓度为500μg/mL时,SI值达到最大1.19。
淋巴细胞在有丝分裂原如ConA、LPS等的刺激下,其形态和代谢会发生一系列的改变,转化为母细胞并分化增殖。其中ConA刺激T细胞增殖,LPS刺激B细胞增殖。因此根据非特异性促有丝分裂原激活T、B细胞增殖反应的程度,可推测T、B细胞识别特异性抗原增殖反应。乌鸡肽对ConA诱导的T淋巴细胞增殖见图3。与对照组相比,乌鸡肽对小鼠脾T淋巴细胞增殖有促进作用,并呈量效关系(r=0.867 4,P<0.01),在五个作用浓度范围内,除1 000μg/mL外均有极显著差异(P<0.05)。对照组和乌鸡肽(100μg/mL)组的SI值分别为1.78和2.59。乌鸡肽(100μg/mL)使ConA诱导的小鼠T淋巴细胞增殖上升了46%。
乌鸡肽对LPS诱导的B淋巴细胞增殖见图1,乌鸡肽对LPS诱导的B淋巴细胞增殖具有促进作用,但是量效关系不明显。在浓度为100μg/mL时,SI值为1.22。
2.3 乌鸡肽对小鼠腹腔巨噬细胞活力的影响
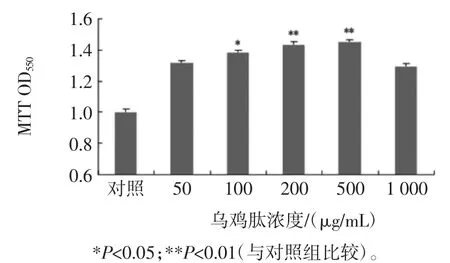
图2 乌鸡肽对小鼠脾细胞增殖的影响Fig.2 Effect of oligopeptides from Black-bone chicken on the proliferation of murine peritoneal macrophages
乌鸡肽对小鼠腹腔巨噬细胞增殖的影响见图2。与对照组相比,乌鸡肽在50μg/mL~1 000μg/mL之间具有显著的促进小鼠腹腔巨噬细胞的增殖,呈U-型量效关系(r=0.96,P<0.01)。
巨噬细胞有3种活化状态,静息状态、致敏状态和亢奋(活化)状态。当机体或局部未受到病原体等的刺激时,巨噬细胞等常处于静息状态,胞体较小,细胞器较不发达,几乎不运动,但寿命较长而更新率低。在LPS的刺激下,巨噬细胞从静息转向活化,细胞增大,代谢增强,溶酶体增多,细胞的变形运动及吞噬能力均增强[11-12]。如图3A所示,随着作用浓度的增加,乌鸡肽对活化的小鼠腹腔巨噬细胞吞噬能力的影响变化不明显。当浓度为1000μg/mL时,吞噬指数PI达到最高为1.42。
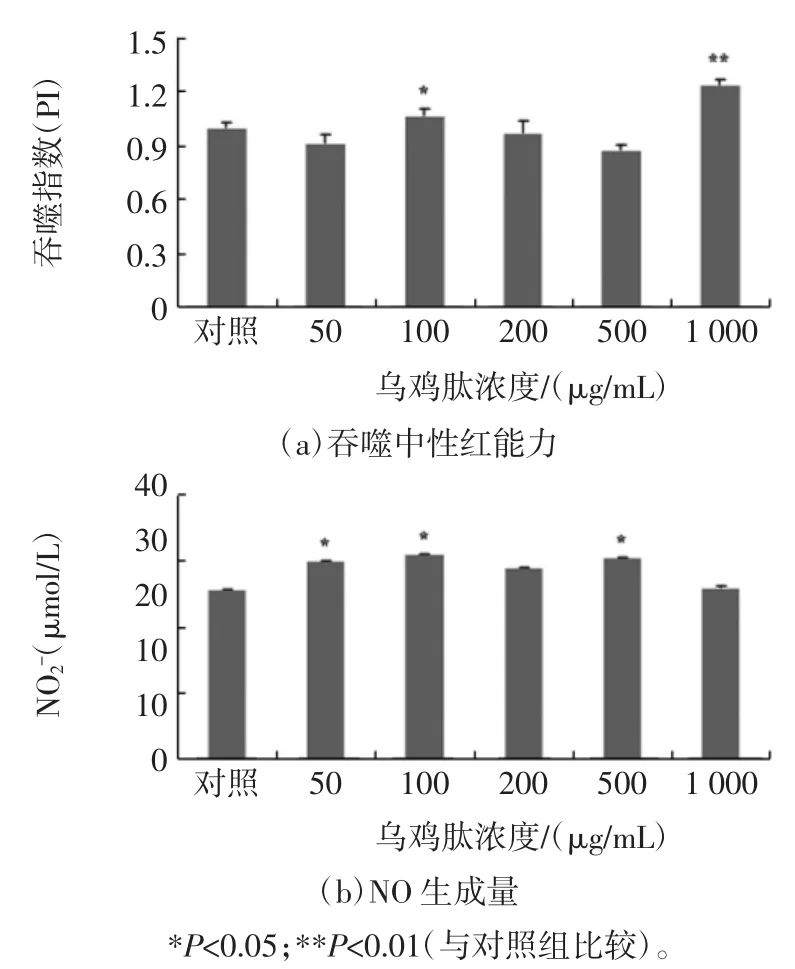
图3 乌鸡肽对LPS诱导的小鼠腹腔巨噬细胞活性的影响Fig.3 Impacts of oligopeptides from Black-bone chicken on cell viability by LPS-stimulated mice peritoneal macrophages
巨噬细胞经激活后,可产生大量的细胞毒分子(如,NO等),这些细胞毒分子对清除外来微生物有着重要的意义。乌鸡肽对小鼠腹腔巨噬细胞NO生成量的影响见图3(b)。由图可以看出,乌鸡肽对LPS诱导的巨噬细胞NO生成量均有促进作用,随浓度变化呈倒U-型关系。当浓度为100μg/mL时,NO生成量为对照组的1.21倍(P<0.05)。
3 结论
本研究选取易于人体吸收利用的小分子量乌鸡肽,对其免疫调节作用进行研究。由实验结果可知乌鸡肽的五个作用浓度对小鼠脾细胞增殖以及丝裂源诱导的T-淋巴细胞和B-淋巴细胞的增殖均有不同程度的促进作用。小鼠腹腔巨噬细胞经LPS诱导后,乌鸡肽浓度为100μg/mL和1 000μg/mL时显著促进巨噬细胞的吞噬能力,在50μg/mL~1 000μg/mL时,乌鸡肽均促进巨噬细胞NO的生成。综合淋巴细胞增殖实验和小鼠腹腔巨噬细胞活力的实验结果可以得出:乌鸡肽在100μg/mL时促进淋巴细胞增殖和促进腹腔巨噬细胞活力的效果最好。
实验证明:乌鸡肽是一种优秀的营养物质来源,本研究为研发免疫营养调节的功能食品提供了理论依据,同时也为乌鸡肽的开发利用和精深加工奠定了实践基础。
[1]孙亚真.乌骨鸡黑色素的测定及其理化性质研究[D].江西:南昌大学,2008
[2]林霖,田颖刚,谢明勇,等.乌骨鸡活性肽组成成分及体外抗氧化活性研究[J].食品科学,2007,28(10):41-45
[3]龙彪,彭志英,陈中,等.采用木瓜蛋白酶制备乌鸡蛋白肽的研究[J].食品工业科技,2005,26(6):135-140
[4]龙彪.乌鸡蛋白酶解制备活性肽的研究[D].广州:华南理工大学, 2005
[5]中华人民共和国卫生部.GB 5009.3-2010食品中水分的测定[S].北京:中国标准出版社,2010:1-4
[6]中华人民共和国卫生部.GB 5009.4-2010食品中灰分的测定[S].北京:中国标准出版社,2010:1-2
[7]中华人民共和国卫生部,中国国家标准化管理委员会.GB/T 5009.6-2003食品中脂肪的测定[S].北京:中国标准出版社, 2004:1-2
[8]中国国家标准化管理委员会.GB 5009.5-2010食品中蛋白质的测定[S].北京:中国标准出版社,2010:1-8
[9]林峰,马勇,徐亚光,等.基于分子量分布的食源性低聚肽品质评价研究[J].食品与发酵工业,2008,34(9):128-131
[10]李勇.营养与食品卫生学[M].北京:北京大学医学出版社,2005
[11]Pengal R A,Ganesan LP,Wei G,et al.Lipopolysaccharide-induced production of interleukin-10 is promoted by the serine/threonine kinase Akt[J].Molecular Immunology,2006,43:1557-1564
[12]徐淑云,卞如镰,陈修.药理实验方法[M].3版.北京:人民卫生出版社,2002:1420-1455
The Effect of Black-bone Chicken Peptide on Immunomodulatory
WEI Ying1,2,GU Rui-zeng1,2,LIN Feng1,2,LIU Yan1,2,ZHANG Hai-xin1,2,CAI Mu-yi1,2,*
(1.China National Research Institute of Food&Fermentation Industries,Beijing 100027,China;2.Beijing Engineering Research Center of Protein and Functional Peptides,Beijing 100027,China)
The basic physical and chemical indicators of Black-bone chicken peptide were measured,and its immunomodulatory activity was study.The effect of Black-bone chicken peptide on the proliferation of murine splenocytes was detected by WST-8.The effects of Black-bone chicken peptide on phagocytic activity and the No production by macrophages were studied in order to evaluate the cell viability of mouse peritoneal.The relative molecular weight of Black-bone chicken peptide was less than 1 000U.Black-bone chicken peptide significantly stimulated ConA-and LPS-stimulated splenocyte proliferation,and significantly promoted murine peritoneal macrophage phagocytic ability of neutral red and the NO production at100μg/mL.Black-bone chicken peptide has good immunomodulatory effect.
Black-bone chicken peptide;lymphocytes;macrophages;immune regulation
10.3969/j.issn.1005-6521.2014.16.001
2013-09-07
十二五国家科技支撑项目(No.2012BAD33B04);国家高技术研究发展计划(863计划)项目(No.2013AA102205-02);科技北京百名领军人才培养工程项目(No.Z131110000513026);北京市科技计划项目(No.Z131100003113010)
魏颖(1981—),女(汉),工程师,博士,研究方向:功能食品。
*通信作者
