响应面法优化搅拌萃取蜂胶总黄酮的提取工艺
2014-03-21沈艳婷林海陈家平韩凯宁杨红丽
沈艳婷,林海,陈家平,韩凯宁,杨红丽,2,*
(1.浙江海洋学院食品与医药学院,浙江舟山316004;2.浙江工业大学化学工程学院,浙江杭州310014)
响应面法优化搅拌萃取蜂胶总黄酮的提取工艺
沈艳婷1,林海1,陈家平1,韩凯宁1,杨红丽1,2,*
(1.浙江海洋学院食品与医药学院,浙江舟山316004;2.浙江工业大学化学工程学院,浙江杭州310014)
采用响应面法对蜂胶总黄酮提取工艺进行优化。以蜂胶原胶为原料,基于单因素实验,以乙醇体积分数、料液比、提取时间和提取次数为相应因素,蜂胶总黄酮提取率为响应值,根据中心组合Box-Behnken的中心组合试验设计原理,采用四因素三水平响应面分析法进行响应面试验,并对各个因素的显著性和交互作用进行分析。结果表明,最优工艺条件为提取次数2次、料液比1∶45(g/mL)、提取时间30min、乙醇浓度90%,在此条件下,总黄酮的提取率为17.07%。
蜂胶;总黄酮;响应面分析法
蜂胶是蜂蜜从外界的胶源植物(如:桦树、杨树、柏树、柳树等)的嫩芽或树皮伤口上采集的树脂,并混入蜜蜂腺体分泌物和蜂蜡而成的一种棕红色、棕黄色、棕褐色或带有青绿色的芳香性黏性胶状固体[1]。目前,从蜂胶中已提取分离出300多种物质,黄酮类物质是蜂胶中主要的活性成分[2-4],具有抗氧化、抗衰老、软化血管、减少血栓形成及改善人体的微循环作用,被誉为珍贵的天然“血管清道夫”[5-7]。
目前,蜂胶中总黄酮的提取已成为研究热点,付英娟[8]等对超声波法提取蜂胶黄酮的工艺条件进行了优化,王小明[9]则采用微波技术提取蜂胶中的黄酮,张建和[10]等对冷浸法提取蜂胶总黄酮的方法进行了研究,超声提取和微波提取效率高、耗时短,但可能会引起活性成分发生改变[11-12],使活性降低,而冷浸法耗时过长,搅拌法可以克服这些问题。本实验采用磁力搅拌对蜂胶中总黄酮进行提取并测定提取液中总黄酮含量,在单因素试验基础上,利用响应面分析法优化磁力搅拌提取蜂胶中总黄酮的工艺条件。
1 试验材料与方法
1.1 仪器与材料
UV-100紫外-可见分光光度计:上海美普达;JB-2型恒温磁力搅拌器:上海雷磁;BSA4124S电子天平:赛多利斯科学仪器;相关玻璃仪器。
蜂胶:购自山东泰安;三氯化铝、醋酸钾、乙醇均为分析纯,芦丁:国药集团化学试剂有限公司,纯度≥95.0%。
1.2 芦丁溶液的配制
精密称取干燥至恒重的无水芦丁50mg置25mL容量瓶中,加90%乙醇适量使之溶解并定容,摇匀,得芦丁对照液。精密量取对照液5mL于50mL容量瓶中,用90%乙醇稀释至刻度,摇匀,即得0.20 g/L的芦丁对照品溶液。
1.3 蜂胶中总黄酮的提取
将于-20℃冷冻24 h后的蜂胶原胶快速粉碎,过40目筛备用。准确称取0.2 g粉碎后的蜂胶,加适量的乙醇水溶液,进行搅拌处理,离心过滤后,添加相同量的乙醇水溶液对滤渣再次搅拌处理,合并2次滤液,定容至50mL,避光保存。
1.4 最大吸收波长的选择
[13],分别取样品溶液和0.20 g/L的芦丁溶液各1mL,置于50mL容量瓶中,加113.2 g/L三氯化铝溶液1mL,摇匀,再加9.8 g/L醋酸钾溶液1mL,摇匀,加14mL 90%乙醇溶液,定容至50mL,用蒸馏水作为空白参照,在200 nm~800 nm扫描吸收曲线。
1.5 总黄酮含量的测定
标准曲线的建立:采用硝酸铝比色法测定[13],精密吸取芦丁对照品使用液1.00、2.00、3.00、4.00、5.00、6.00、10.00、12.00mL分别至于50mL容量瓶中。按照1.4的显色方法进行显色,在最大吸收波长处,以水为空白,测定吸光度,以芦丁的浓度为横坐标,吸光度为纵坐标做标准曲线。将1.3中的蜂胶提取液稀释至适宜浓度,以同样方法测定总黄酮含量。
根据下式计算出蜂胶中黄酮的提取率:
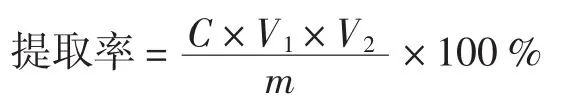
式中:C为由标准曲线计算得出的样品的黄酮浓度,(mg/mL);V1为样品的体积,mL;V2为样品的总稀释倍数;m为样品的质量,mg。
1.6 影响提取工艺的因素试验
1.6.1 单因素试验
称取0.2 g左右的蜂胶粉末,置于锥形瓶中,在不同条件下提取,以确定提取因素变化范围以及各因素的最佳值。按1.3和1.5中蜂胶中总黄酮的提取及测定方法,测出其吸光度,并折算为提取率。
1.6.2 工艺优化试验
以乙醇浓度、提取时间、料液比、提取次数等因素作为考察对象,采用响应面分析并设计试验,以获得最佳的工艺参数。
2 结果与分析
2.1 最大吸收波长的选择
按照2.4中的方法测量得到蜂胶提取液和芦丁的在300 nm~520 nm的吸收曲线,结果见图1。
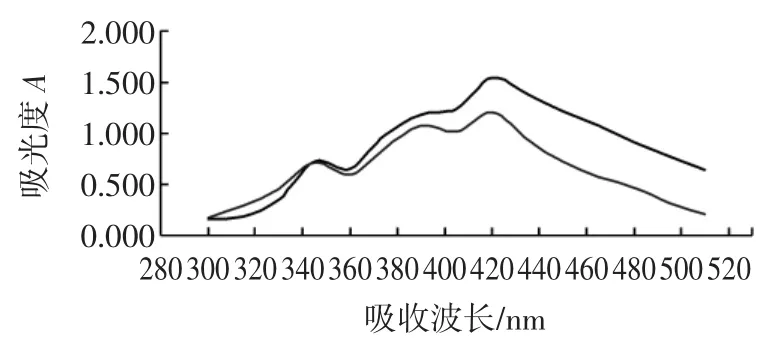
图1 蜂胶提取液的紫外可见吸收光谱Fig.1 The ultraviolet-visible absorption spectrum of the extraction of propolis
由图1可知,蜂胶黄酮提取液(紫色曲线)和芦丁对照品溶液(蓝色曲线)均在420 nm的时候有最大吸收峰,故测量波长选择为420 nm。
2.2 芦丁的工作曲线
由1.5中方法可得到图2的标准曲线,回归方程为:y=0.027 7x+0.041 4,R2=0.998 9。
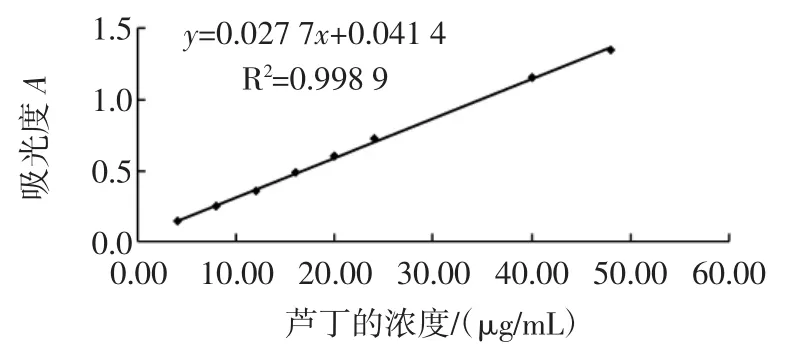
图2 芦丁的工作曲线Fig.2 The working curve of rutin
2.3 料液比对蜂胶中总黄酮提取率的影响
萃取温度22℃,提取次数为3次,乙醇的浓度为90%,提取时间为30min时,测定不同料液比对总黄酮提取率的影响,结果见图3。
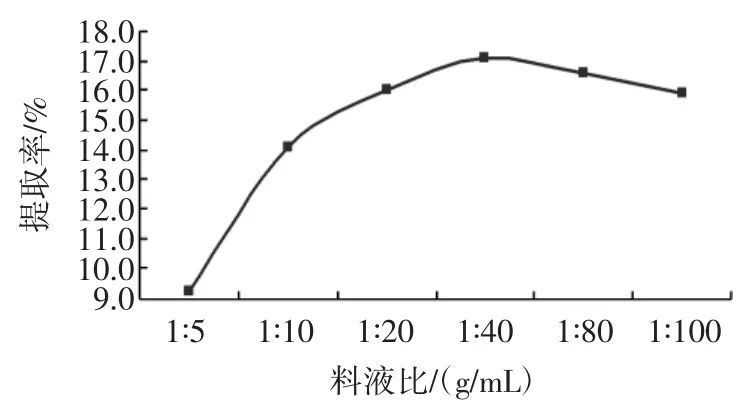
图3 料液比对总黄酮提取率的影响Fig.3 Effect of the liquid-material ratio on flavones extraction rate
由图3可知,当料液比在1∶40(g/mL)的时候,黄酮的提取率是比较大的,而当料液比大于1∶40(g/mL)的时候,随着料液比的增加,黄酮的有下降的趋势,虽然在料液比为1∶100的时候有所增加,但和1∶40(g/mL)的时候相差不大,考虑到实际乙醇用量,料液比选择在1∶40(g/mL)左右。
2.4 乙醇浓度对蜂胶中总黄酮提取率的影响
萃取温度22℃,提取次数为3次,料液比1∶40(g/mL),提取时间为30min时,不同乙醇浓度对黄酮提取的影响如图4所示。
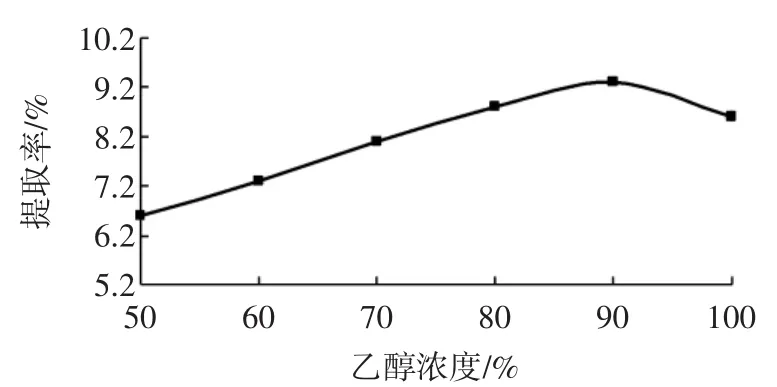
图4 乙醇浓度对黄酮提取率的影响Fig.4 Effect of ethanol concentration on flavones extraction rate
由图4可知,当乙醇浓度在90%的时候,黄酮的提取率是最大的,而当乙醇的浓度大于90%的时候,随着乙醇浓度的增加,黄酮的提取率有明显的下降趋势,所以应该选择乙醇浓度在90%左右比较合适,所以我们选择了乙醇浓度为90%左右。
2.5 提取时间对蜂胶中总黄酮提取率的影响
在萃取温度22℃,乙醇浓度为90%,料液比1∶40(g/mL),提取次数为3次的条件下,测定不同提取时间对总黄酮提取率的影响,如图5所示。
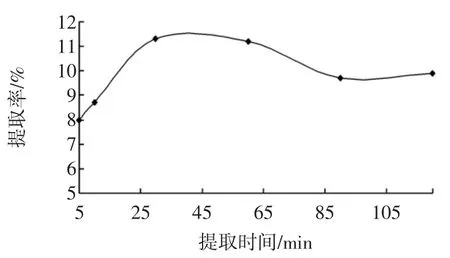
图5 提取时间对黄酮提取率的影响Fig.5 Effect of extraction time on flavones extraction rate
由图5可知,当提取时间为30min的时候,黄酮的提取率最高,而当提取时间大于30min时,随着提取时间的增加,黄酮的提取率有所下降,因此选择提取时间为30min左右。
2.6 提取次数对蜂胶中总黄酮提取率的影响
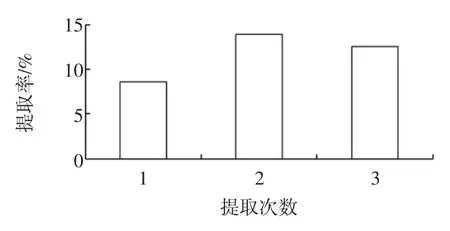
图6 提取次数对黄酮提取率的影响Fig.6 Effect of extraction times on flavones extraction rate
图6为萃取温度22℃,乙醇浓度为90%,料液比1∶40(g/mL)时,提取次数对黄酮提取率的影响,由图可知当提取次数在2次的时候,黄酮的提取率是最大的,而当提取次数在增加的时候,随着提取次数的增加,黄酮的提取率有明显的下降趋势。
2.7 蜂胶总黄酮提取条件的优化
2.7.1 数学模型的建立与检验
根据中心组合Box-Behnken的中心组合试验设计原理,综合单因素试验结果,选取乙醇浓度、提取时间、料液比和提取次数对蜂胶中黄酮提取率影响显著的4个因素,采取4因素3水平响应面分析方法,根据二次响应面通用旋转组合设计原理,试验因素与水平设计见表1。响应面分析方案与试验结果见表2。
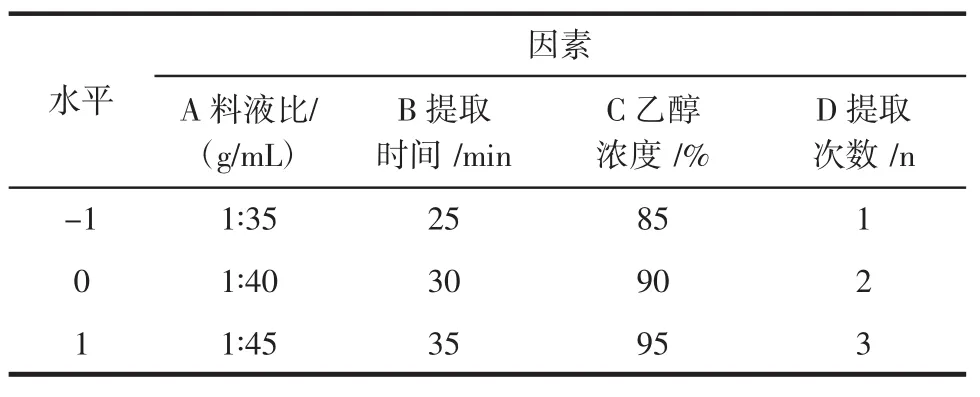
表1 蜂胶黄酮提取响应面分析实验设计因素与水平表Table1 Variables and levels in response surface design
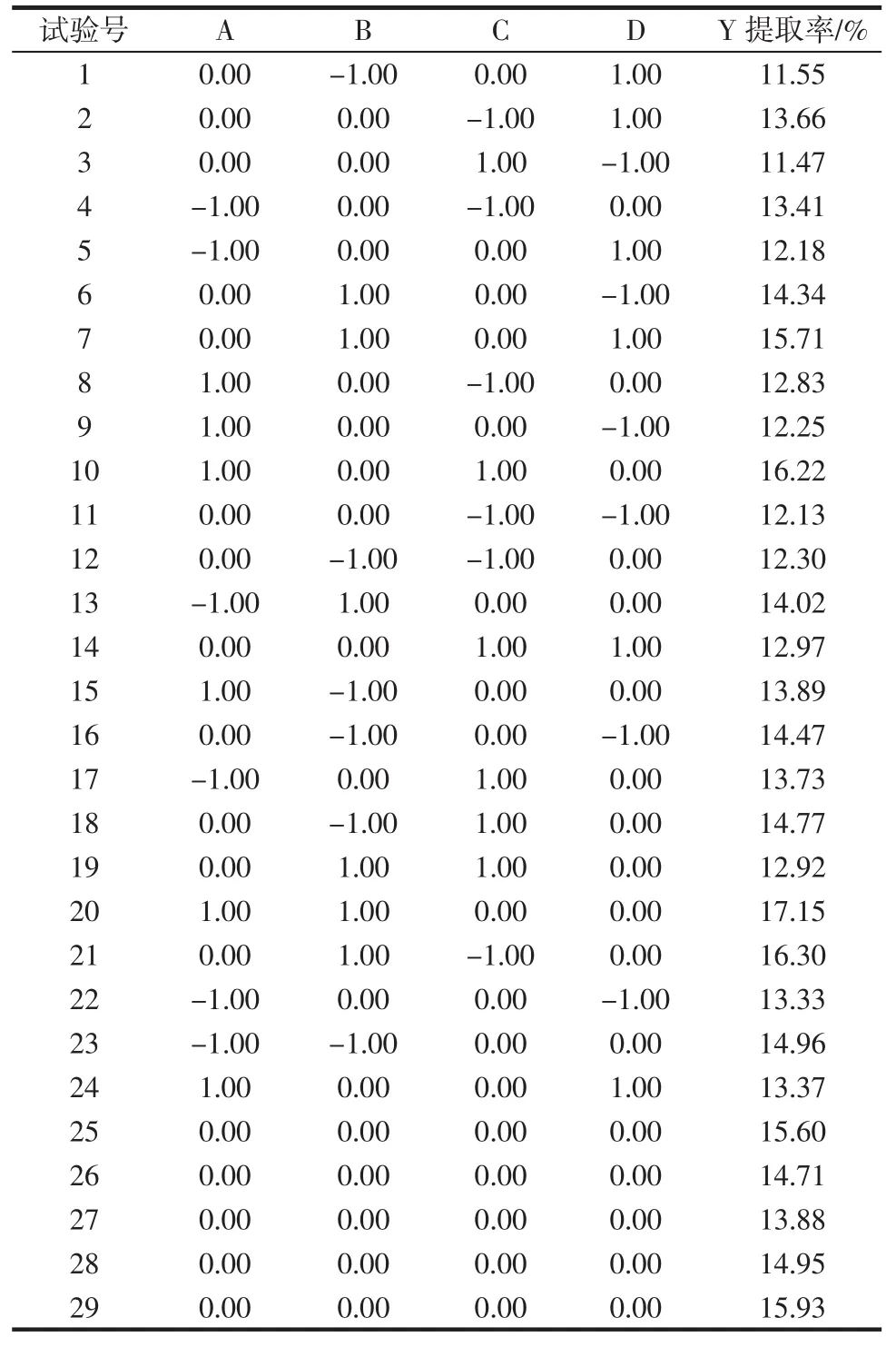
表2 蜂胶总黄酮提取响应面试验设计及结果Table2 Process variables and levels in response surface designarrangement and experimental response values
对料液比、提取时间、乙醇浓度、提取次数作如下变换注:A=(x1-40)/5;B=(x2-30)/5;C=(x3-90)/5;D=(x4-2)/1,以试验所得黄酮提取率为响应值(Y),试验设计与结果见表2,其中1~24是析因试验,25~29是中心试验,用来估计试验误差。
对表2的试验结果进行的响应面方差分析结果显示,蜂胶黄酮提取反应中料液比、提取时间、乙醇浓度、提取次数4个反应因素的P值分别为0.220 8、0.018 3、0.655 7、0.655 7,其中1个因数小于0.05,说明这个反应因素对蜂胶黄酮提取率具有显著性意义。另外,对各个反应因素之间的交互作用P值AC、AD、CD均大于0.05,说明A与C、A与D、C与D因素之间不存在交互作用(见表3)。

表3 方差分析结果Table3 Analysis of variance for quadric regression model
根据表2的试验结果,以蜂胶黄酮提取率为响应值,经Design-Exper7.1.6统计软件进行统计分析,再根据表3的显著性分析结果,剔除各因素间不明显的交互作用得到该试验的回归方程为:

由表3可知,模型极显著(P=0.005 0<0.01),试验所选取的二次多项模型具有高度的显著性,失拟项在a=0.05的水平上不显著(P=0.386 3>0.05),其校正系数R2=81.16%,因此该模型拟合度较好。综合以上各参数表明该试验方法可靠,各因素水平间设计合理,因此可用该回归方程模拟试验真实点值对试验结果进行分析和预测。
该二次回归模型的一次项:提取时间B显著(P= 0.018 3<0.05);交互项:BC极其显著(P=0.006 6<0.01)、AB显著(P=0.038 4<0.05),BD显著(P=0.035 0<0.05);二次项:D2影响极其显著(P<0.01),C2影响显著(P<0.05)。各试验因素对蜂胶总黄酮提取率的影响排序为:提取时间>料液比>乙醇浓度和提取次数。
2.7.2 蜂胶总黄酮提取率的响应面分析
响应面分析立体图以及等高线图如图7~图12所示。
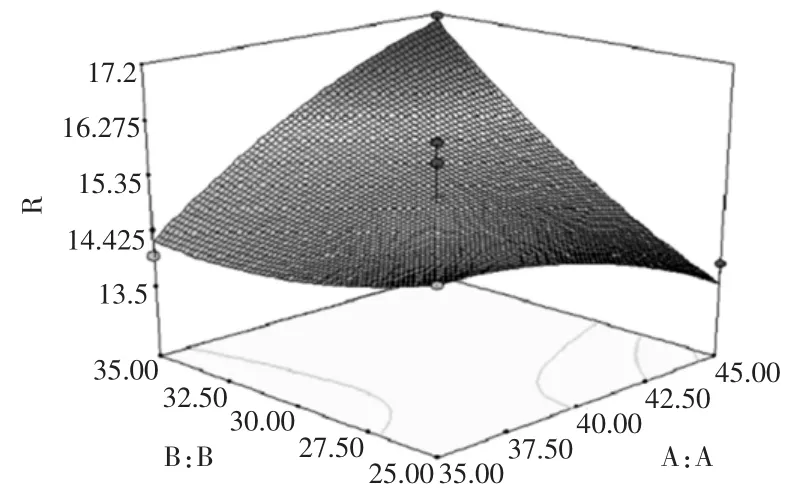
图7 时间与料液比对总黄酮提取率的影响Fig.7 Effect of extraction time and liquid-material ratio on flavones extraction rate
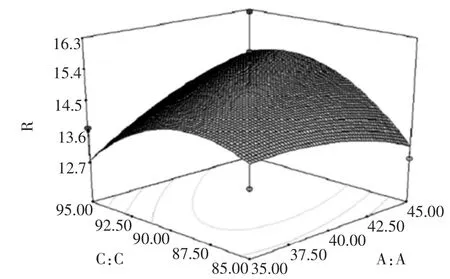
图8 料液比与乙醇浓度对总黄酮提取率的影响Fig.8 Effect of liquid-material ratio and ethanol concentration on flavones extraction rate
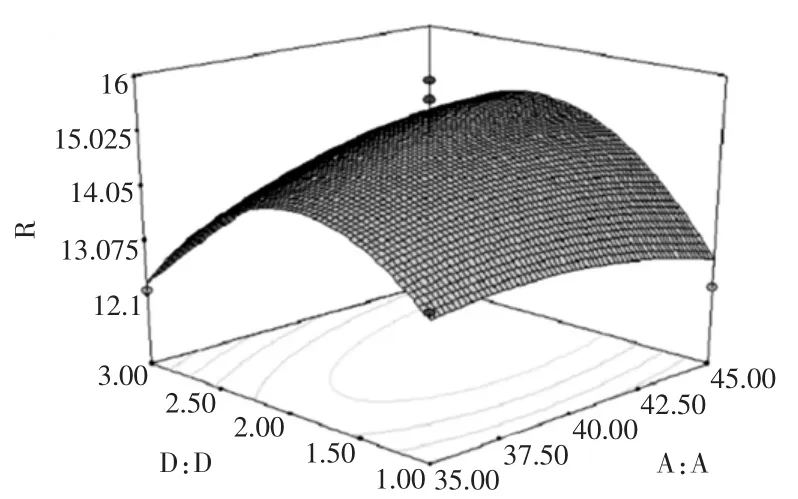
图9 料液比与提取次数对总黄酮提取率的影响Fig.9 Effect of liquid-material ratio and extraction times on flavones extraction rate
图7~图12直观的反映了各因素交互作用对响应值的影响。比较6组图可知:提取时间对蜂胶的黄酮提取率影响最为显著,表现为等值线最密;料液比次之,相应表现为等值线较密,而提取次数和乙醇浓度的影响最小不显著,等值线较宽,且随其数值的增加或减少,响应值变化较小。
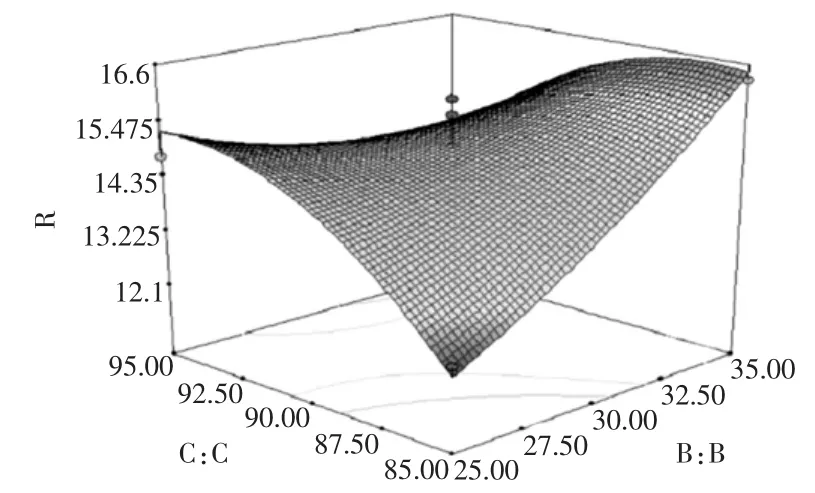
图10 提取时间与乙醇浓度对总黄酮提取率的影响Fig.10 Effects of extraction time and ethanol concentration on flavones extraction rate
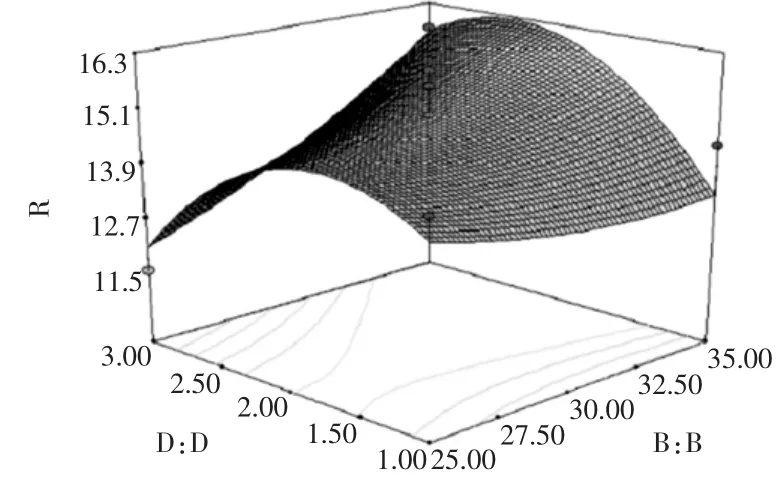
图11 提取次数与提取时间对总黄酮提取率的影响Fig.11 Effects of extraction times and extraction time on flavones extraction rate
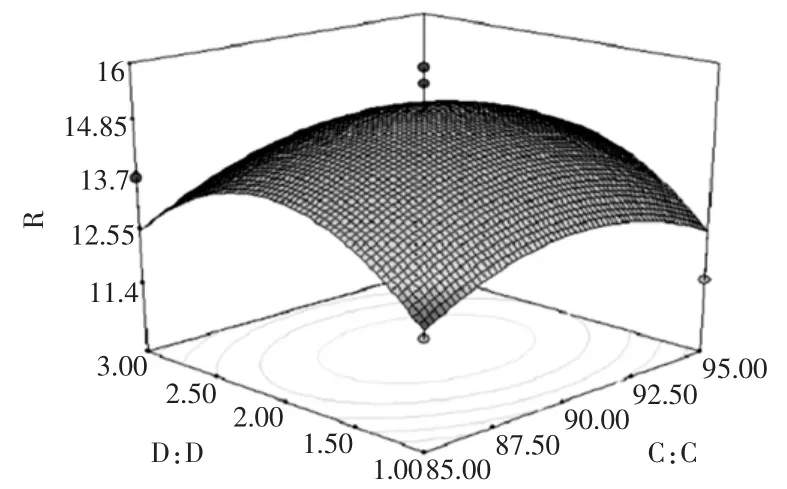
图12 乙醇浓度与提取次数对总黄酮提取率的影响Fig.12 Effects of ethanol concentration and extraction times on flavones extraction rate
2.7.3 验证实验
对回归方程求一阶偏导,并令其等于零,可以得到曲面的最大点,即4个主要因素的最佳水平值,分别为:A=0.998,料液比为1:44.99,B=0.972,提取时间为34.86min,C=-0.294,乙醇浓度为88.53%,D=0.34,提取次数为2.34次,预测黄酮的提取率的最大值为17.48%。考虑到实际的料液比为1∶45、提取时间为35min、提取次数2次及乙醇浓度90%。为了进一步验证最优提取条件,采用上述条件进行了5组平行试验,结果黄酮的提取率达到17.07%,与理论预测值相比,相对误差不到1%。因此,采用响应面法优化得到的黄酮的参数准确可靠,具有实用价值。
3 结论
在单因子试验的基础上,将响应面法应用于优化蜂胶活性成分黄酮的提取。试验结果表明:料液比、提取时间的平方项对黄酮提取率的影响显著。说明提取次数、料液比、提取时间和乙醇浓度对蜂胶黄酮提取率的影响不是简单的线性关系。回归分析和验证试验结果表明,此方法合理可行。得到的最佳提取条件为22.34℃,在乙醇浓度为88.53%,提取时间34.86min,料液比1∶44.99,提取次数2.34。实际条件料液比1∶45提取时间35min及乙醇浓度90%,提取2次,蜂胶黄酮实际提取率17.07%。理论预测值相比相对误差不到1%,试验结果良好,说明采用响应面分析法优化蜂胶黄酮的提取条件是可行的。
参考文献:
[1]曹炜.蜂胶产品加工工艺研究及其生物功能评价[D].西安:陕西师范大学,2001:132-145
[2]Burdock GA.Review of the biological properties and tox i city of bee propolis[J]Food Chemical Toxico.,1998(36):347-363
[3]Vero S.Antioxidant activity of Uruguayan propolis in vitroand cellular assays[J].Jouranl Of Agricultural And Food Chemistry,2011,59 (12):6430-6437
[4]Guo X,Chen B,Luo L,et al.Chemical compositions and antioxidant activities of water extracts of Chinese propolis[J].Jouranl of Agricultural and Food Chemistry,2011,59(23):12610-12616
[5]Ruckstuhl M,Beretz A,Anton R,et al.Flavonoids are selective cyclic GMP phosphodiesterase inhibitors[J].Biochemical Pharmacology, 1979,28(4):535-538
[6]Bankova V,Marcucci MC,Simova S,et al.Antibacterial diterpenic acids from Brazilian propolis[J].Z Naturforsch,1996,51(5/6):277-280
[7]李彦杰,杨勇,阐健全.蜂胶化学成分及生物活性[J].粮食与油脂, 2003(12):43-45
[8]付英娟,于智峰,张建新.超声波提取蜂胶黄酮的条件优化[J].食品工业科技,2007:28(5):143-148
[9]王小明,刘逆夫.微波提取蜂胶总黄酮的工艺研究[J].中国医药导报,2007,4(21):127-128
[10]张建和,符伟玉,佘戟.蜂胶醇冷浸法提取物中总黄酮含量的测定[J].广东医学院学报,2004,22(4):419-420
[11]周勇,杜先锋,江慎华,等.荷叶活性物质超声、微波辅助提取比较及人工胃液处理对其抗氧化活性的影响[J].食品工业科技,2012, 33(17):106-113
[12]翟硕莉.超声波法和微波法提取马齿苋中总黄酮的比较研究[J].中国酿造,2012,31(8):120-122
[13]中华人民共和国质量监督检验检疫总局,中国国家标准化管理委员会.GB/T20574-2006.蜂胶中总黄酮含量的测定方法分光光度比色法[S].北京:中国标准出版社,2007
Optimization of Stirring Extraction of Propolis Flavonoids by Response Surface Methodology
SHEN Yan-ting1,LIN Hai1,CHEN Jia-ping1,HAN Kai-ning1,YANG Hong-li1,2,*
(1.Food and Pharmacy School,Medical School,Zhejiang Ocean University,Zhoushan 316004,Zhejiang,China;2.College of Chemical Engineering,Zhejiang University of Technology,Hangzhou 310014,Zhejiang,China)
Propolis flavonoids were extracted by ethanol,and the extraction process was optimized by response surface analysis.On the basis of one-factor-at-a-time experiments,the optimal extraction conditions for maximizing propolis flavonoids were determined by using a 4-variable,3-level Box-Behnken experimental design combined with response surface analysis as follows:the extraction time was 2;the liquid-material ratio was1∶45(g/mL);the extraction time was 30min;the ethanol concentration was 90%(volume ratio),resulting in anpropolis flavonoids yield of 17.07%.
propolis;flavonoids;response surface methodology(RSM)
10.3969/j.issn.1005-6521.2014.16.011
2013-03-25
2013年浙江省公益性技术应用研究(分析测试)(项目编号:2013C37067);2013年浙江省大学生科技创新活动计划暨新苗人才计划资助项目(项目号:2013R411036)
沈艳婷(1992—),女(汉),本科,研究方向:药物分析。
*通信作者
