柠檬明串珠菌的研究进展
2014-03-21韩瑨刘振民郭本恒吴正钧
韩瑨,刘振民,郭本恒,吴正钧
(乳业生物技术国家重点实验室,光明乳业股份有限公司,上海200436)
柠檬明串珠菌的研究进展
韩瑨,刘振民,郭本恒,吴正钧*
(乳业生物技术国家重点实验室,光明乳业股份有限公司,上海200436)
柠檬明串珠菌(Leuconostoc citreum)是明串珠菌属的重要成员,可以合成胞外多糖如右旋糖苷、产生具有广谱抑菌作用的细菌素等,具有潜在的应用价值。概述1993~2013年间对柠檬明串珠菌在代谢产物、分子生物学以及食品行业应用方面的研究进展。
柠檬明串珠菌;胞外多糖;细菌素;遗传学
柠檬明串珠菌(Leuconostoc citreum)是明串珠菌属(Leuconostoc genus)乳酸菌的一种,为革兰氏阳性菌,G+C含量40.0%(L.citreum NCDO 1837T),其细菌学分类隶属于细菌界(Bacteria)-厚壁菌门(Firmicutes)-芽孢杆菌纲(Bacilli)-乳杆菌目(Lactobacillales)-乳杆菌科(Lactobacillaceae)-明串珠菌属(Leuconostoc)。与其它明串珠菌等乳酸菌的亲缘关系见图1[1]。
自然界中的L.citreum主要存在于绿色植物及其根部[2],此外,哺乳动物乳汁[3]、传统发酵品如泡菜[4]和发酵面团[5]等也可作为筛选的重要来源。
纵览近二十年来对L.citreum的相关报道后可以发现,对L.citreum研究的深度与广度在不断扩展,包括菌株的筛选[6-7]、培养基的优化[8]、代谢产物的分析[9]、菌株质粒的特性[10]及其在食品行业的应用[4],均表明L. citreum正受到越来越多的关注。本文主要从L.citreum的代谢产物、分子生物学研究及食品行业应用三方面对国内外的相关报道进行概述。
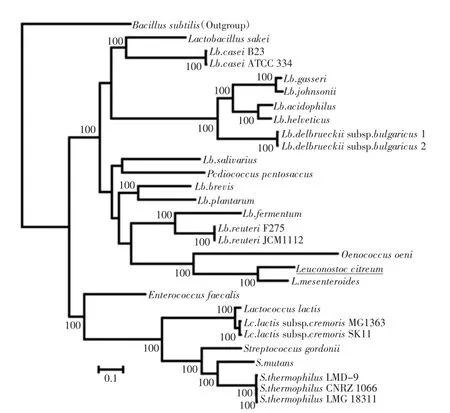
图1 L.citreum与其他乳酸菌的亲缘关系Fig.1 Phylogenetic relationship between L.citreum and other lactic acid bacteria
1 L.citreum的代谢产物
1.1 多糖
右旋糖苷(Dextran,一种由D-葡萄糖以α-1,6糖苷键键合而成的葡聚糖高分子化合物)是由右旋糖苷蔗糖酶(Dextransucrase,EC 2.4.1.5,DSR)代谢蔗糖产生的一种多糖,目前用于商业用途的右旋糖苷大多来自L.mesenteroides,而对L.citreum多糖的研究报道相对较少。Maina NH等以核磁共振技术分析了L.citreum E497的右旋糖苷结构,发现该结构除了大部分的α-1,6糖苷键之外,还包含了11%α-1,2糖苷键和3.5% α-1,3糖苷键,属于Ⅰ型右旋糖苷的特征结构[11]。Son MJ等对一株筛选自韩国传统发酵蔬菜Dongchimi的L.citreum S5进行了产糖条件的优化,结果表明在化学合成培养基添加1.5%脱脂乳和0.5%马铃薯粉可显著提高菌株的生物量,促进蔗糖的转化,增加发酵液中右旋糖苷的积累量。添加脱脂乳和马铃薯的化学合成培养基经L.citreum S5代谢产生的右旋糖苷分子量均为1 100 ku左右,而未添加的发酵液中多糖分子量则为1 100 ku(70%)、2 000 ku(30%)[12]。2008年,L. citreum HJ-P4因其在低温(10℃)下优良的生长特性和多糖合成能力从韩国泡菜Kimchi中被筛选得到。在此温度下,L.citreum HJ-P4增殖后的菌数比L. mesenteroides B-512高出2倍以上,并保留了80%的最大DSR合成能力,这种低温下可快速生长和产糖的特性为L.citreum HJ-P4参与工业化生产Kimchi提供了理论依据[13]。RabeloMC等比较了L.citreum NRRL B-742在化学合成培养基和苹果汁培养基中生长后获得的DSR粗酶的稳定性,结果表明在25℃、pH 6.5的条件下,DSR粗酶在后一种培养基中可保持良好的稳定性达48 h[14]。此外,部分报道涉及L.citreum DSR的异源表达,如表1所示。
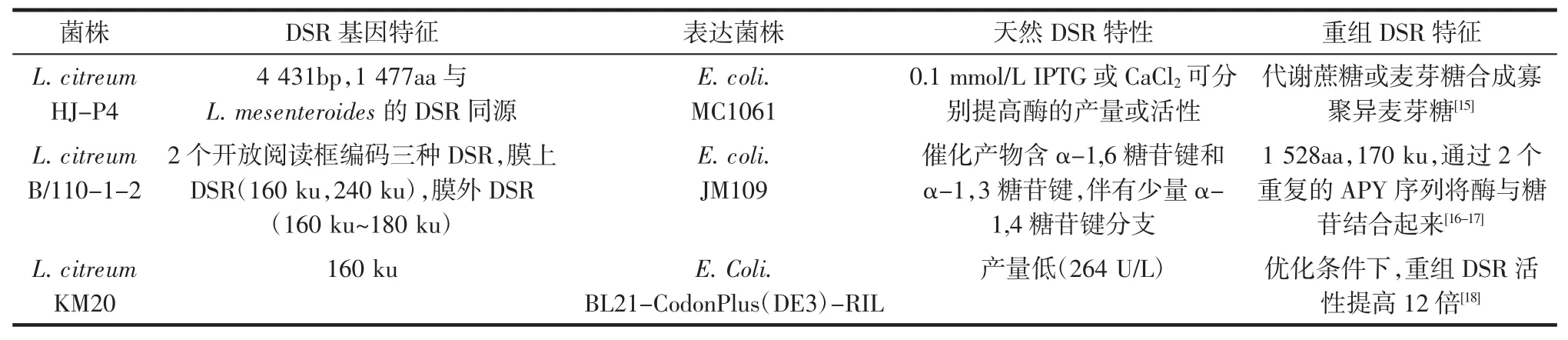
表1 L.citreum DSR异源表达的报道Table1 Partial published results of heterologous expression of DSR from L.citreum
菊粉(Inulin,一种主要由果糖以β-2,1糖苷键聚合而成的果聚糖)是明串珠菌通过菊粉蔗糖酶(Inulosucrase,EC 2.4.1.9,ISR)代谢蔗糖产生的另一种多糖,具有降血糖、助消化、改善新陈代谢等益生功能。2002年,Olivaries-Illana V等从墨西哥传统谷物发酵饮料Pozol中获得一株L.citreum CW28,通过特殊处理,由其细胞膜上分离得到一种分子量为170 ku的果糖基转移酶(Fructosyltransferase,EC 2.4.1.9,FTF),核磁共振结果显示,该酶转化蔗糖形成的多聚物具有与菊粉类似的结构,这是首次在Streptococcus mutans以外的微生物中发现ISR[19]。将该菌株的ISR编码基因进行克隆、表达于E.coli.,分析后发现该ISR的结构相当特殊:其N-末端与不同微生物来源的葡萄糖基转移酶(Glucosyltransferase,GTF)的可变区相似,催化区与其他微生物来源的FTF相近,C末端则与L.mesenteroides NRRLB-1355来源的交替蔗糖酶(Alternansucrase,EC 2.4.1.140,ASR)与葡聚糖结合的部位类似。截去C末端的ISR基因依然可在E.coli.中成功表达并合成菊粉,但缺失了热稳定性,这是首次报道ISR兼有GTF和FTF的结构特征[20]。研究表明,在L.citreum CW28产物中高分子量的菊粉主要由细胞膜上的ISR合成,而低分子量部分菊粉的合成则与发酵液中的游离酶有关。在蔗糖浓度25%的优化条件下,L.citreum CW28的ISR对底物的转化率最高可达76%[21]。DELMORALS等通过截除、倒位的方法确定了L.citreum CW 28在进化过程中其FTF获得的额外区域的功能,主要与酶的稳定性、反应动力学和特异性、尤其是水解与转糖基作用的比例有关[22]。
1.2 乳酸盐
乳酸盐(Lactate)是乳酸菌发酵糖代谢的主要终产物,根据构型不同可分为D-乳酸盐(D-Lactate)和L-乳酸盐(L-Lactate),两者均由其对应的乳酸脱氢酶合成得到。其中L-乳酸脱氢酶(L-Lactate Dehydrogenase,简称L-LDH)与细菌、植物和动物有同源关系,而D-乳酸脱氢酶(D-Lactate Dehydrogenase,简称DLDH)的结构与短链脂肪酸脱氢酶有一定同源性,值得关注的是,未成年人或病人过量摄入D-乳酸盐会引起代谢性应激反应。有报道指出,朝鲜泡菜Kimchi中L. citreum发酵产生的乳酸盐绝大部分属于D构型,L-乳酸盐相对较少[23]。为了提高L-乳酸盐的产量,JINQ等借助穿梭载体pLeuCM将植物乳杆菌的L-LDH克隆并引入L.citreum中,获得的转化子成功将该基因转录和表达,产物中的L-乳酸盐的增加与D-乳酸盐的少使两种异构体的比例发生变化,但乳酸盐总量没有显著增加,这是首次以调节中央碳通量的方式将代谢工程应用于明串珠菌的改造[24]。采用穿梭载体pMBLT02,L.citreum 95成功地过量表达了D-LDH,实验结果显示,补充了14%葡萄糖的培养液经转化株发酵后D-乳酸产量可达61 g/L,比对照组的产量高6倍以上[25]。
1.3 细菌素
细菌素(Bacteriocin)是产生菌以抑制同源种或近似种的生长为目的所分泌的肽类抗菌物质,通常由质粒编码产生,主要通过吸附并作用于敏感菌细胞表面的特异受体从而达到抑菌的目的。目前关于明串珠菌产细菌素的报道,,主要有Mesentericin Y105(L. mesenteroides)、L.gelidum(eucocin A-UAL 187)、L. carnosum(carnosin 44A)、L.paramesenteroides(leuconocin S)等,却较少涉及的L.citreum产细菌素功能。Chang JY等筛选得到一株产细菌素的L.citreum GJ7,这种细菌素命名为Kimchicin-GJ7,分子量在3 500 u左右,不但热稳定性强、耐酸碱能力佳,而且对广谱微生物有拮抗作用。以灭活的细菌素敏感菌株Lb. plantarum KFRI 464为环境刺激因素可提高Kinchicin-GJ7的产量。进一步的研究发现,Lb.plantarum KFRI464可产生一种使L.citreum GJ7增产细菌素的诱导因子,以其N末端的一段由16个氨基酸组成的序列为模板合成的16肽对Kinchicin-GJ7的诱导效果仅比完整诱导因子的效果低10%左右。这是首次报道关于一种细菌产物影响另一种细菌的细菌素产量[26]。在优选的发酵条件下,使用经上述诱导方式获得的细菌素高产菌株L.citreum GJ7来发酵泡菜,可以控制泡菜的后熟程度和菌群组成,同时延长商品的货架期,此项研究为发酵制品企业提供了敞开式、非无菌发酵过程中控制微生物生长的理论依据[27]。研究表明,L.citreum的乳酸发酵过程可以显著延缓3种真菌(Cladosporium sp.YS1,Neurospora sp.YS3,Penicillium crustosum YS2)在米团中的增殖,这种抑菌效果比添加0.3%丙酸钙要好得多,乳酸发酵时的副产物如乳酸和乙酸等有机酸被认为是主要抑菌物质,因此,L.citreum等乳酸菌在控制米团发酵、延长年糕保存期等方面有一定优势[28]。
1.4 其他代谢产物
通过体外瘤胃发酵的方法,Baek E等发现L.citreum TSD-1在发酵红绒球和象草时,pH不断降低,同时伴有氨气和戊酸盐产量增加的现象[9]。Rodriguez-Alengria ME等对L.citreum IS的ISR催化区域IslA4进行定位突变,其中突变株S425A丧失了原有产菊粉的能力,只分解蔗糖与合成低聚果糖。在0.67mol/L蔗糖溶液里,低聚果糖转化率可达65%,进一步研究表明,这种果糖基转化过程符合一级动力学规律,因此,S425A表达的ISR可用于以蔗糖为底物合成低聚果糖[29]。对大多数L.citreum而言,甘露醇是其代谢蔗糖的一类副产物,然而OtgonbayarGE通过研究发现,在优化条件下(pH 6.50,30℃),L.citreum 91348P发酵改良的MRS培养基(葡萄糖∶果糖1∶2)时合成甘露醇的最大效率为14.38 g/L·h,终产物总获率达到86.6%,说明该菌株在含果糖食品发酵方面具有一定应用前景[30]。Leathers TD等发现L.citreum和L.mesenteroides不同菌株之间形成生物膜的能力存在差异巨大,但菌株形成生物膜的能力与菌株所产的多糖类型无关[31]。人参皂苷是人参重要的功能组分,具有调节免疫、降血压等益生作用,但不易被人体吸收,L.citreum LH1却可将人参皂苷Rb1转化为易吸收的复合物K,后者可通过抑制癌细胞入侵、阻断癌细胞形成的方法来遏制癌细胞扩散,该转化线路如图2所示[32]。
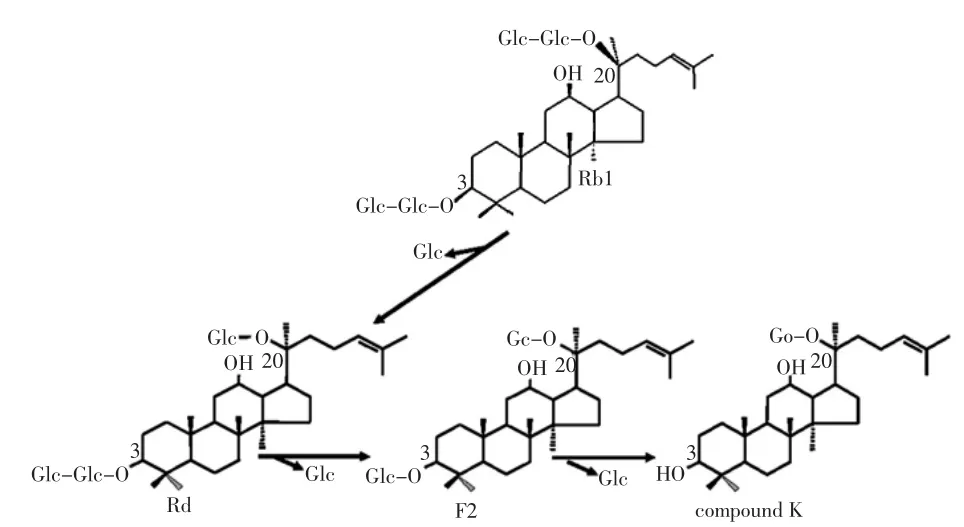
图2 L.citreum LH 1将人参皂苷Rb1转化为复合物K的线路Fig.2 Bioconversion pathway of ginsenoside Rb1 to compound K by Leuconostoc citreum LH 1
2 L.citreum的分子生物学研究
2008年,Kim JF等完成了L.citreum KM20的全基因组测序,发现了4个环状质粒和一些可能与发酵和益生功能相关的基因[33]。来源于法国小麦发酵面团的三株柠檬明串珠菌(L.citreum LBAEC10,L.citreum LBAEC11 and L.citreum LBAEE16)也在2012年被测序并构建成基因组图谱[34]。Park J等从L.citreum IH3中分离获得一种隐秘质粒pIH01(1.8 kb),单一的开放阅读框(Opening Reading Frame,ORF)结构表明该质粒的复制模式为滚环复制,其产物与L.mesenteroides FR52来源的质粒pFR18所编码的复制酶蛋白有较高的相似度(64%),因此,pIH01的衍生质粒可用于对明串珠菌进行遗传学的研究[35]。L.citreum C4的pCC3是另一个被深入研究的质粒,该质粒碱基对长度达3338bp兼有3个ORF,其中ORF3与θ型质粒pTXL1有高度同源性,ORF3所在片段含有一个功能性质粒的复制子。以pCC3为基础构建成的穿梭质粒pUCC3E1可在E.coli TG1和克隆宿主菌L.citreum C16及L.citreum GJ7中复制表达[36]。由来源于L.citreum CBNU75的另一种隐秘质粒pCB18(1,821 bp,G+C 39.2%)与大肠杆菌质粒pEK104构建的穿梭载体pLeuCM,可通过滚环复制的方式,完成在E.coli.和L.citreum中的复制,而且遗传性相当稳定。实验表明,克隆了植物乳杆菌β-半乳糖苷酶编码基因的pLeuCM可以在L.citreum中成功表达,同时,pLeuCM在L.citreum,L.mesenteroides,Lb.plantarum,Lb.reuteri,Lc.lactis,Streptococcus thermophilus,Weissella confusa和Oenococcus oeni中均可被复制。因此,质粒pLeuCM可以成为多种乳酸菌之间进行基因传递的有效工具[10]。
上述研究大多针对L.citreum的特定质粒,在L. citreum相关的分子生物学报道中,还有一部分是将L. citreum作为外源基因表达的宿主菌的研究。Park JY等以穿梭载体为手段,将L.mesenteroides SY1的α-半乳糖苷酶编码基因引入L.citreum KCTC3526,该基因在宿主菌中获得成功表达[37]。Eom HJ等通过同样的方法完成了α-淀粉酶在L.citreum中的异源表达[38]。
3 L.citreum在食品行业的应用
Choi IK等利用L.citreum的高产酸能力,在泡菜制作工艺中人为添加L.citreum IH22来加快发酵过程中pH的下降速率,以此法制成的泡菜比未添加L.citreum IH22制成泡菜保持期更长[39]。L.citreum的这种高产酸能力同样被运用于北京豆汁的生产工艺中,北京豆汁中主要产酸微生物为乳酸乳球菌(Lactococcus lactis)和柠檬明串珠菌(Leuconostoc citreum),且分别占72%与26%,乳酸菌发酵导致可溶性蛋白及可溶性糖含量下降,游离氨基酸含量迅速累积,绿豆内源蛋白酶与淀粉酶活性下降,微生物蛋白酶活性增强[40]。Delgerzaya P等尝试用L.citreum HJ-P4发酵麦芽汁来探索一种新型益生菌饮料,发现发酵液中功能性代谢产物(有机酸、功能性糖等)的浓度及其风味主要受到麦芽烘焙条件和发酵条件的影响[41]。经实践证明,含糖14.08%、柠檬香精0.98%的麦芽汁经S.cerevisiae和L.citreum HJ-P4相继发酵后的产物最受消费者欢迎,此项研究为L.citreum在功能性饮品发酵制备方面的应用提供了理论依据[42]。ChoiH等在酵母面包制作过程中添加了L.citreum HO12参与发酵的面团,此法显著延缓了真菌、芽孢杆菌等腐败菌在面包产品中的生长,这是利用了L.citreum产细菌素的特性[4],这种特性使L.citreum被广泛地应用于延长产品货架期等方面[27-28]。
4 展望
明串珠菌最初被发现于20世纪40、50年代,对明串珠菌的研究工作仅限于培养条件分析等技术层面,直到20世纪末,尤其是近年来,有关明串珠菌的研究才慢慢开始升温,包括了L.citreum培养基的优化[8]、生长保存的特性[43-45]、致病性[46-48]、调节免疫[49]、功能性酶的发现[50]、与L.mesenteroides的分子差异[51]和产糖差异[5]等方面,这些研究提高并深化了对L.citreum的认识。
尽管L.citreum代谢产物丰富(有机酸、多糖、细菌素等),作为研究对象,具有广泛用途(质粒供体、宿主菌等),但与明串珠菌其它菌株或其它乳酸菌相比,其应用特性往往不够突出。例如,L.citreum的产糖能力普遍低于L.mesenteroides,商业用途的多糖合成菌株基本采用L.mesenteroides,因此,目前对L.citreum的研究依然处于技术层面。
[1]ZHANG Z-G,YE Z-Q,YU L,et al.Phylogenomic reconstruction of lactic acid bacteria:an update[J].BMC evolutionary biology,2011, 11(1):1
[2]MUNDT J.Lactic acid bacteria associated with raw plant food material[J].JMilk Food Technol,1970,33:550-553
[3]SINGH G,SHARMA R R.Dominating species of Lactobacilli and Leuconostocs present among the lactic acid bacteria ofmilk of differentcattle’s[J].Asian JExp Sci,2009,23(1):173-179
[4]CHOIH,KIM Y-W,HWANG I,et al.Evaluation of Leuconostoc citreum HO12 and Weissella koreensis HO20 isolated from kimchi as a starter culture for whole wheat sourdough[J].Food Chemistry, 2012,134(4):2208-2016
[5]BOUNAIX M-S,GABRIEL V,ROBERTH,et al.Characterization of glucan-producing Leuconostoc strains isolated from sourdough [J].International Journalof Food Microbiology,2010,144(1):1-9
[6]BENKERROUM N,MISBAH M,SANDINEW E,et al.Developmentand useofa selectivemedium for isolation of Leuconostoc spp. from vegetablesand dairy products[J].Applied and environmental microbiology,1993,59(2):607-609
[7]KUROSEN,ASANO T,KAWAKITA S,etal.Isolation and characterization of psychotrophic Leuconostoc citreum isolated from rice koji[J].Seibutsu-Kogaku Kaishi,2004,82(5):183-190
[8]KIM H,EOM H J,LEE J,et al.Statistical optimization ofmediumcomposition forgrowth of Leuconostoc citreum[J].Biotechnology and Bioprocess Engineering,2004,9(4):278-284
[9]WAJIZAH S.Effect of Leuconostoc citreum TSD-10 supplementation with different substrate on ruminal fermentation(In vitro)[J]. Jurnal Agrista,2000,4(3):291-297
[10]EOM H-J,CHO SK,PARK M S,et al.Characterization of Leuconostoc citreum Plasmid pCB18 and Development of Broad Host Range Shuttle Vector for Lactic Acid Bacteria[J].Biotechnology and Bioprocess Engineering,2010,15(6):946-952
[11]MAINA NH,TENKANENM,MAAHEIMOH,et al.NMR spectroscopic analysis of exopolysaccharides produced by Leuconostoc citreum and Weissella confusa[J].Carbohydrate Research,2008,343 (9):1446-1455
[12]SONM-J,JANGE-K,KWONO-S,etal.Characterization of dextran produced from Leuconostoc citreum S5 strain isolated from Korean fermented vegetable[J].European Food Research and Technology,2008,226(4):697-706
[13]YIM C-Y,EOM H-J,JINQ,etal.Characterization of low temperature-adapted Leuconostoc citreum HJ-P4 and itsdextransucrase for theuse of kimchistarter[J].Food Science and Biotechnology,2008, 17(6):1391-1395
[14]RABELOM C,FONTESCM L,RODRIGUESS.Stability study of crude dextransucrase from Leuconostoc citreum NRRL B-742[J]. Indian JournalofMicrobiology,2011,51(2):164-170
[15]YIA-R,LEE S-R,JANG M-U,et al.Cloning of dextransucrase gene from Leuconostoc citreum HJ-P4 and itshigh-levelexpression in E.coli by low temperature induction[J].Journal of Microbiology and Biotechnology,2009,19(8):829-835
[16]FRAGA VIDALR,MARTINEZA,MOULISC,et al.A novel dextransucrase is produced by Leuconostoc citreum strain B/110-1-2:an isolate used for the industrial production of dextran and dextran derivatives[J].Journal of Industrial Microbiology&Biotechnology, 2011,38(9):1499-1506
[17]FRAGA VIDAL R,MOULISC,ESCALIER P,et al.Isolation of a gene from Leuconostoc citreum B/110-1-2 encoding a novel dextransucrase enzyme[J].Current Microbiology,2011,62(4):1260-1266
[18]KO J-A,JEONGH J,RYUY B,etal.Large increase in Leuconostoc citreum KM20 dextransucraseactivity achieved by changing the strain/inducer combination in an E.coliexpression system[J].JournalofMicrobiology and Biotechnology,2012,22(4):510-515
[19]OLIVARES-ILLANA V,WACHER-RODARTEC,LE BORGNES, etal.Characterization ofa cell-associated inulosucrase from anovel source:A Leuconostoc citreum strain isolated from Pozol,a fermented corn beverageofMayan origin[J].Journalof IndustrialMicrobiology&Biotechnology,2002,28(2):112-117
[20]OLIVARES-ILLANA V,LOPEZ-MUNGUIA A,OLVERA C. Molecular characterization of inulosucrase from Leuconostoc citreum:a fructosyltransferase within a glucosyltransferase[J].Journal of Bacteriology,2003,185(12):3606-3612
[21]ORTIZ-SOTOM E,OLIVARES-ILLANA V,LOPEZ-MUNGUIA A.Biochemical propertiesof inulosucrase from Leuconostoc citreum CW28 used for inulin synthesis[J].Biocatalysis and Biotransformation,2004,22(4):275-281
[22]DELMORALS,OLVERAC,ELENARODRIGUEZM,etal.Functional role of the additional domains in inulosucrase(IsIA)from Leuconostoc citreum CW28[J].BMCBiochemistry,2008(9):6
[23]JINQ,YOONH-S,HANNS,etal.Effectof lactic acid bacteria on D-and L-lactic acid contents of kimchi[J].Food Science and Biotechnology,2006,15(6):124-129
[24]JINQ,JUNG JY,KIM Y J,et al.Production of L-lactate in Leuconostoc citreum via heterologousexpression of L-lactate dehydrogenasegene[J].Journalof Biotechnology,2009,144(2):160-164
[25]CHAEH S,LEE SH,LEE J-H,et al.Use of a Novel Escherichia coli-Leuconostoc Shuttle Vector forMetabolic Engineering of Leuconostoc citreum To Overproduce D-Lactate[J].Applied and environmentalmicrobiology,2013,79(5):1428-1435
[26]CHANG JY,LEEH J,CHANGHC.Identification of the agent from Lactobacillus plantarum KFRI464 that enhances bacteriocin production by Leuconostoc citreum GJ7[J].Journalof Applied Microbiology,2007,103(6):2504-2515
[27]CHANG JY,CHANGH C.Improvements in the Quality and Shelf Life of Kimchiby Fermentation with the Induced Bacteriocin-Producing Strain,Leuconostoc citreum GJ7 as a Starter[J].Journal of Food Science,2010,75(2):M103-M10
[28]BAEK E,KIM H,CHOIH,etal.Antifungal activity of Leuconostoc citreum and Weissella confusa in rice cakes[J].Journal of Microbiology,2012,50(5):842-848
[29]ELENA RODRIGUEZ-ALEGRIA M,ENCISO-RODRIGUEZ A, ELENA ORTIZ-SOTOM,et al.Fructooligosaccharide production by a truncated Leuconostoc citreum inulosucrase mutant[J].Biocatalysis and Biotransformation,2010,28(1):51-59
[30]OTGONBAYARG-E,EOM H-J,KIM B S,et al.Mannitol Production by Leuconostoc citreum KACC 91348P Isolated from Kimchi [J].Journal of Microbiology and Biotechnology,2011,21(9):968-971
[31]LEATHERST D,BISCHOFF K M.Biofilm formation by strains of Leuconostoc citreum and L.mesenteroides[J].Biotechnology Letters, 2011,33(3):517-523
[32]QUAN L-H,PIAO J-Y,MIN J-W,etal.Bioconversion ofGinsenoside Rb1 Into Compound K by Leuconostoc citreum Lh1 Isolated From Kimchi[J].Brazilian Journal of Microbiology,2011,42(3):1227-1237
[33]KIM JF,JEONGH,LEE J-S,et al.Complete genome sequence of Leuconostoc citreum KM20[J].Journal of Bacteriology,2008,190(8):3093-3094
[34]LAGUERRE S,AMARIM,VUILLEMIN M,et al.Genome Sequences of Three Leuconostoc citreum Strains,LBAE C10,LBAE C11,and LBAEE16,Isolated from Wheat Sourdoughs[J].Journalof Bacteriology,2012,194(6):1610-1611
[35]PARK J,LEEM,JUNG J,etal.pIH01,a smallcryptic plasmid from Leuconostoc citreum IH3[J].Plasmid,2005,54(2):184-189
[36]CHANG JY,CHANGH C.Identification ofa replicon from pCC3,a cryptic plasmid from Leuconostoc citreum C4 derived from kimchi, and developmentofanew host-vector system[J].Biotechnology Letters,2009,31(5):685-696
[37]PARK J-Y,JEONG S-J,LEE A R,et al.Expression of alphagalactosidase gene from Leuconostoc mesenteroides SY1 in Leuconostoc citreum[J].JournalofMicrobiologyand Biotechnology,2007, 17(12):2081-2084
[38]EOM H-J,MOON J-S,SEO E-Y,et al.Heterologous expression and secretion of Lactobacillus amylovorus alpha-amylase in Leuconostoc citreum[J].Biotechnology Letters,2009,31(11):1783-1788 [39]CHOIIK,JUNG SH,KIM B J,et al.Novel Leuconostoc citreum starter culture system for the fermentation of kimchi,a fermented cabbage product[J].Antonie Van Leeuwenhoek International Journal of General and Molecular Microbiology,2003,84(4):247-253
[40]丁玉振,张绍英,梁尽祎,等.北京传统小吃“豆汁”制作工艺研究[J].食品科学,2010,31(2):280-283
[41]DELGERZAYA P,SHIN J-Y,KIM K-O,et al.Wort Fermentation by Leuconostoc citreum Originated from Kimchi and Sensory Properties of Fermented Wort[J].Food Science and Biotechnology,2009, 18(5):1083-1090
[42]SHIN JY,DELGERZAYA P,LIM Y B,etal.Sensory and Chemical Characteristics of Worts Fermented by Leuconostoc citreum and Saccharomyces cerevisiae and Consumer Acceptability with Added Flavorings[J].Food Science and Biotechnology,2009,18(5):1109-1117
[43]RATNAKOMALA S,WIDYASTUTIY.Storage of Probiotic Leuconostoc citreum TSD-10 By Freezing and Freeze-drying[J].Ann Bogor,2000(7):43-48
[44]SUNG I-K,HAN N S,KIM B S.Co-production of biomass and metabolites by cell retention culture of Leuconostoc citreum[J].Bioprocess and Biosystems Engineering,2012,35(5):715-720
[45]WENGP,WU Z,LEIL.Predictive Models for Growth of Leuconostoc citreum and Its Dynamics in Pickled Vegetables with Low Salinity[J].Journal of Food Process Engineering,2012,36(3):284-291
[46]GIACOMETTI A,RANALDI R,SIQUINI F M,et al.Leuconostoc citreum isolated from lung in AIDS patient[J].Lancet,1993,342 (8871):622
[47]YOUN JS,PARK Y J,KIM B K,et al.Two cases of bacteremia caused by Leuconostoc citreum[J].Korean Journal of Clinical Pathology,1997,17(4):623-628
[48]LEE J-J,CHANGH-C,LEEM-Y.Acute Toxicity of Leuconostoc citreum GJ7 Isolated from Kimchiin Mice[J].Journal of The Korean Society of Food Science and Nutrition,2007,36(5):534-539
[49]KANG H,OH Y-J,AHN K-S,et al.Leuconostoc citreum HJ-P4 (KACC 91035)regulates immunoglobulin E in an ovalbumin-in-duced allergy model and induces interleukin-12 through nuclear factor-kappa B and p38/c-Jun N-terminal kinases signaling in macrophages[J].Microbiology and Immunology,2009,53(6):331-339
[50]CIBIK R,TAILLIEZ P,LANGELLA P,etal.Identification of Mur, an atypical peptidoglycan hydrolase derived from Leuconostoc citreum[J].Applied and Environmental Microbiology,2001,67(2):858-864
[51]CIBIK R,LEPAGE E,TAILLIEZ P.Molecular diversity of Leuconostoc mesenteroides and Leuconostoc citreum isolated from traditional french cheeses as revealed by RAPD fingerprinting,16S rDNA sequencing and 16SrDNA fragment amplification[J].Systematic and Applied Microbiology,2000,23(2):267-278
Progress in Study on Leuconostoc citreum
HAN Jin,LIU Zhen-min,GUO Ben-heng,WU Zheng-jun*
(State Key Laboratory of Dairy Biotechnology,Bright Dairy&Foods Co.,Ltd.,Shanghai 200436,China)
Leuconostoc citreum is an important member of Leuconostoc genus with application potential i.e. production of polysaccharides including dextrans,and bacteriocins with antagonistic activity against a broad spectrum of microorganisms.In this article,the research progress in metabolites,genetics as well as present and potential application in fermented food of Leuconostoc citreum in update was reviewed.
Leuconostoc citreum;exopolysaccharide;bacteriocin;genetics
10.3969/j.issn.1005-6521.2014.16.032
2013-05-13
“十二五”国家科技支撑计划课题:发酵乳制品乳酸菌菌种与发酵剂的研究与开发(2013BAD18B01);“十二五”国家863项目:优良益生菌高效筛选与应用关键技术(2011AA100901)
韩瑨(1980—),男(汉),工程师,硕士,研究方向:乳品科学专业。
*通信作者
