扁桃茎尖包埋玻璃化超低温保存条件研究
2014-03-21陈加利刘建亮李志军
陈加利 姜 喜 肖 巍 刘建亮 王 琳 李志军
(1塔里木大学植物科学学院,新疆阿拉尔 843300)(2新疆生产建设兵团塔里木盆地生物资源保护与利用重点实验室 新疆 阿拉尔843300)
扁桃(Amygdalus communi L.)又名巴旦杏,为落叶乔木,其果仁营养价值很高并具有一定食疗功效和经济价值[1]。在我国扁桃栽培已有 1 300余年的历史,扁桃资源丰富,在我国自行培育和引进的品种有200多个,其中新疆约有90多个[2]。扁桃种子繁殖后代性状易发生分离,不宜作为扁桃种质资源保存的有效方式;田间种植保存占地面积大,耗费人力和物力,易受环境的影响;目前多数采用扁桃接穗来进行繁殖和保存,但其种质资源并没有系统地被保存,致使一些扁桃资源面临丧失的危险。李康[3]、姜俊卿[4]、高疆生[5]等对新疆扁桃在组织培养方面已有一些报道,但用常规的离体保存方法需经常继代,容易污染和发生体细胞变异。越来越多的研究结果表明,包埋玻璃化超低温保存法是一种操作简单、能同时处理大量材料,对材料毒害作用小、可长期稳定保存种质资源的一种有效途径,该方法已成功应用在桃[6]、李[7、8]、苹果[9]、青岛百合[10]、山药[11]、葡萄[12]和怀地黄[13]等多种植物的茎尖保存上。为此,本实验以莎车18号扁桃茎尖为试材,研究影响其茎尖包埋玻璃化法超低温保存的一些因素, 为扁桃种质资源的长期保存提供一条有效途径。
1 材料与方法
1.1 材料
2013年3月中旬采自塔里木大学园艺试验站的莎车18号扁桃。
1.2 方法
本试验主要从低温锻炼时间、预处理时间和预处理浓度、装载液处理时间、玻璃化( PVS2) 液处理时间5个方面进行研究。
1.2.1 再生无菌苗的获得 选取一年生枝条剪去叶片,用自来水冲洗干净,取带腋芽的茎段2~3 cm及顶芽,倒入吐温用流水冲洗30 min左右,然后置于超净工作台下,用70%酒精灭菌8 s,再用2%浓度的次氯酸钠消毒处理10 min,无菌水冲洗3遍后,接入诱导培养基上,即MS+6-BA0. 3 mg/L+IAA0. 3 mg/L。30d后将萌芽切下转入继代培养基MS+6-BA1. 0 mg/L+IAA0. 1 mg/L,培养室内温度为(25±2) ℃,光照强度为1 200~2 000 lx,每日光照为16 h,8 h黑暗。
1.2.2 低温锻炼 将继代培养1个月的试管苗置于4 ℃恒温恒湿箱中进行低温锻炼,并设置时间梯度,分别为0、1、2、3、4、5和6周。
1.2.3 包埋 在超净工作台上取低温锻炼后的莎车18号扁桃试管苗,在培养皿上切取长约2 mm的茎尖,用镊子将切好的茎尖放入已配好并高温灭菌过的3%(w/v)海藻酸钠(包含0. 4 mol/L蔗糖和无钙离子MS)中。用无菌的胶头滴管吸取莎车18号扁桃茎尖,滴到0. 4 mol/L蔗糖的0. 1 mol/LCaCl2溶液中,每一滴含有一个茎尖并在常温下固定30 min后形成直径约4 mm的包埋丸,将其取出待用。
1.2.4 预培养 将莎车18号扁桃茎尖包埋丸放入含有0、0. 1、0. 3、0. 5和0. 7 mol/L蔗糖+5%二甲基亚砜(DMSO)的MS培养基上,分别预培养1 d、2 d和3 d。
1.2.5 装载液处理 预培养结束后将莎车18号扁桃茎尖包埋丸放入1. 8 mL的冷冻管中(10个/管),重复3次,用装载液(MS+2 mol/L甘油+0. 4 mol/L蔗糖)于25 ℃±2 ℃处理0、10 min、20 min、30 min、40 min、50 min和60 min。
1.2.6 玻璃化液处理 用无菌胶头滴管吸出装载处理液,加入玻璃化溶液PVS2并在0 ℃冰水混合物条件下处理0 min、10 min、30 min、50 min、70 min和90 min,处理后换上新鲜的PVS2,将冷冻管放入纱布袋中,迅速将冷冻管浸入液氮中。其中玻璃化液PVS2是由30%甘油、15%二甲基亚砜、15%乙二醇和0. 4 mol/L蔗糖组成。
1.2.7 化冻、洗涤、活性检测和恢复培养 莎车18号扁桃茎尖包埋丸超低温保存24 h后取出,放入40 ℃水浴锅中化冻1~2 min,用1. 2 mol/L蔗糖的MS洗涤液清洗2次,每次10 min,用无菌滤纸吸去残留在莎车18号扁桃茎尖包埋丸表面的洗涤液,用TTC法[14]检测莎车18号扁桃茎尖成活率,或接种到MS+6-BA0. 3 mg/L+IAA 0. 3 mg/L培养基中,暗培养15d后,转移到正常条件下(25 ℃,1 500 lx),观察其再生情况。
2 结果与分析
2.1 低温锻炼对扁桃茎尖包埋玻璃化超低温保存后存活率的影响
对扁桃茎尖进行不同时间低温锻炼处理,经过超低温保存后发现,低温锻炼影响保存后茎尖存活率。由图1可知,在4 ℃条件下扁桃茎尖随着低温锻炼时间的延长,其存活率不断增加,但4周后存活率不断降低。低温锻炼4周时,扁桃茎尖存活率达最高,为62. 1%;而不经低温锻炼处理的扁桃茎尖存活率为0,经过1周低温锻炼的扁桃茎尖存活率较低,达2.3%。

图1 低温锻炼对存活率的影响
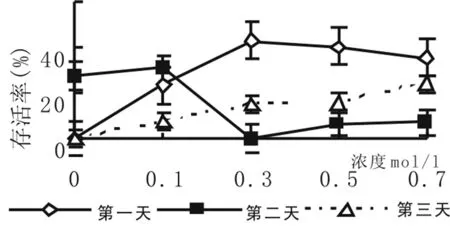
图2 预处理对存活率的影响
2.2 预培养对莎车18号扁桃茎尖包埋玻璃化超低温保存后存活率的影响
预处理液浓度和预培养时间对莎车18号扁桃茎尖超低温保存后的存活率有较大的影响。经5%DMSO和不同浓度蔗糖预培养的扁桃茎尖超低温保存后的存活率高于不进行5%DMSO和蔗糖浓度预培养的茎尖。由图2表明,预处理时间不同,扁桃茎尖存活率变化趋势不同。常温条件下预培养1 d时,扁桃茎尖存活率随5%DMSO和蔗糖浓度的增加呈现先升高后降低的趋势;预培养2 d时,扁桃茎尖存活率随蔗糖浓度的增加呈现先升高后降低再升高的趋势;而预培养3 d时,扁桃茎尖存活率随蔗糖浓度的增加逐渐升高,但扁桃茎尖的存活率没有预培养1 d的高。综合考虑,扁桃茎尖包埋丸用0.3 mol/l蔗糖和5%DMSO处理液处理1天效果最好,扁桃茎尖存活率高,达43%。
2.3 装载时间对莎车18号扁桃茎尖包埋玻璃化超低温保存后存活率的影响
装载液处理是莎车18号扁桃茎尖包埋玻璃化法超低温保存必不可少的关键环节,扁桃茎尖包埋丸用0. 3 mol/l蔗糖处理液处理1天后用装载液进行装载0~60 min。由图3可以看出,莎车18号扁桃茎尖包埋丸进行装载后,随装载时间的增加,超低温保存后的存活率呈先增加后降低的趋势,用装载液处理20 min、40 min扁桃茎尖存活率较高,均达90%。
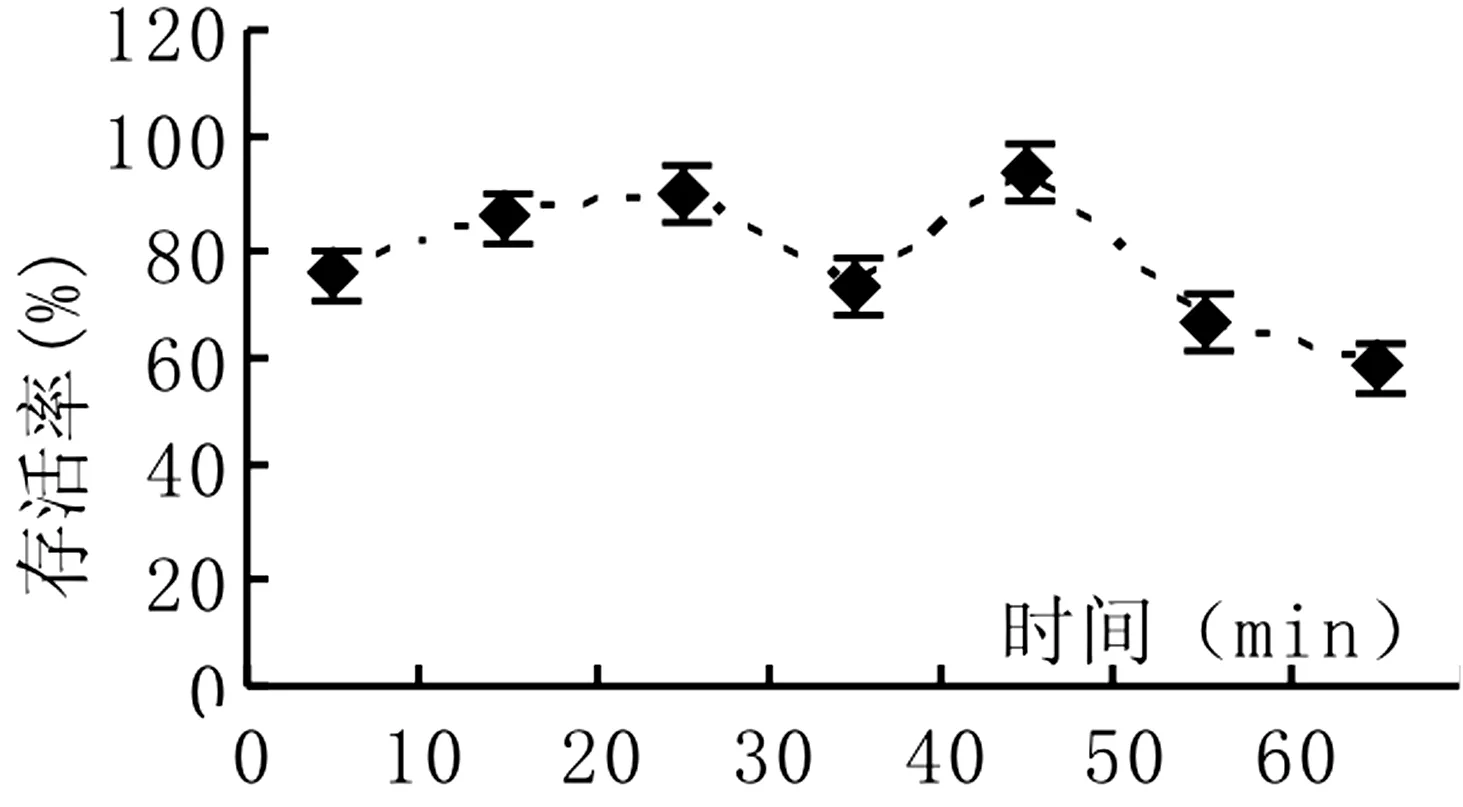
图3 装载时间对存活率的影响

图4 PVS2处理对存活率的影响
2.4 PVS2处理时间对莎车18号扁桃茎尖包埋玻璃化超低温保存后存活率的影响
用玻璃化保护液PVS2处理莎车18号扁桃茎尖包埋丸可脱去茎尖中过多的水分,使扁桃茎尖完全玻璃化,并使冷冻保护液渗入细胞而减轻在超低温保存过程中细胞所受的伤害[15]。由图4可以看出,玻璃化保护液PVS2处理50 min时,扁桃茎尖存活率最高,达52%。未经PVS2处理的莎车18号扁桃茎尖超低温保存后存活率为0;玻璃化保护液PVS2处理50 min、70 min和90 min 的茎尖冻后存活率高于10 min和30 min的处理。
3 结果与讨论
在植物超低温保存过程中,许多植物需要适当的低温锻炼来提高其超低温保存后的成活率,因为低温锻炼可以提高植物体内脯氨酸和多胺的含量以及细胞液的渗透势,从而增加植物的抗冻性[16]。李明军[13]等对怀地黄进行包埋玻璃化超低温保存时低温锻炼5 d,存活率达66%;本研究表明,扁桃茎尖未经低温锻炼的扁桃茎尖进行超低温保存后茎尖存活率为0,经过低温锻炼4周后可以提高扁桃超低温保存后的成活率。但低温锻炼时间太长超过6周后,扁桃试管苗叶片逐渐枯黄、淡褐色的茎尖增多,从而降低了莎车18号扁桃茎尖超低温保存后的存活率。
在预培养中单独使用一种冰冻保护剂其保存效果不理想,很多报道研究发现采用复合冰冻保护剂的优越性在于它能充分发挥各种成分的保护作用,从而产生累加效应[17],而本试验用5%DMSO和0.3 mol/L蔗糖复合冰冻保护剂预培养1 d,存活率较高。预培养时间过短或过长对扁桃茎尖超低温保存后存活率影响较大,本研究发现同一浓度的预处理液随着预处理天数的增加,包埋丸中的扁桃茎尖褐变率增加,其原因可能是由于材料脱水过度、细胞产生了渗透胁迫所致。
在恢复培养时暗培养时间对扁桃茎尖的存活率有较大的影响。赵艳华等[18]发现在桃茎尖超低温保存过程中,化冻后的茎尖通过15 d的暗培养后,可显著提高其成活率,若直接在光下培养,成活率极低。本研究还发现,暗培养1周以内,茎尖都是绿的,一旦转入光照培养扁桃茎尖第二天就会变白;暗培养2周后,扁桃茎尖超低温保存后存活率增加。有研究认为,在恢复培养时需要提高激素浓度或添加新的激素成份,材料才能恢复正常生长[16]。在扁桃茎尖超低温保存后恢复培养时,用继代培养基培养的扁桃茎尖存活率不高,为了提高莎车18号扁桃茎尖超低温保存后的存活率,究竟暗培养要进行多长时间的,培养温度多少和恢复培养基是什么,还有待进一步研究。
本试验采用包埋玻璃化法超低温保存扁桃茎尖, 保存后存活率还比较低,还需进一步对扁桃超低温保存的程序和方法进行优化,从而建立适合扁桃超低温保存体系。
[1] 兰彦平,吐拉克孜,郭文英,等.巴旦杏的研究现状及开发利用前景[J].林业科学研究,2004,17(5):674-679.
[2] 王森,谢碧霞,杜红岩,等.我国扁桃产业的发展趋势[J].经济林研究,2006,24(3):75-79.
[3] 李康,陈聚衡.扁桃组织培养和快速繁殖[J].植物生理学通讯,1990,7(6):46.
[4] 姜俊卿,冯建荣,张大海等.正交设计南疆扁桃品种芽组培离体增殖研究[J].新疆农业科学,2010,47(8):1497-1500.
[5] 高疆生,张卫芳,段黄金.建立巴旦杏试管苗无性系研究[J].山西果树,2001,4(1):4-6.
[6] Dereuddre J, Bertrand DA, Brison M, et al.Cryopreservation of fruit tree somatic embryos and shoot tips. Ge-netics Selection Evolution, 1994,26: 279-290
[7] Carlo AD, Benelli C, Lambardi M.Develop-mentofashoot-tipvitrification Protocol and comparison with encapsulation-based procedures for plum (Prunus domestica L.) cryopreservation.Cryo-Letters,2000, 21:215-222.
[8] 陈红,韩晓莹.李茎尖包埋玻璃化法超低温保存的条件探索[J].山地农业生物学报,2013,32(3):276-279.
[9] Paul H,Daigny G, Sangwan-Norreel BS.Cryopreservation of apple (Malus×domestica Borkh.) shoot tips following encapsulation-dehydrationoren capsulation-vitrification. Plant Cell Reports,2000,19:768-774.
[10] 王金录,钤泰琳,赵美爱.青岛百合包埋-玻璃化法超低温保存技术研究[J].北方园艺,2012,18:135-139.
[11] 赵喜亭,王苗,邵换娟.山药种质包埋玻璃化超低温保存再生植株的稳定性分析[J].华北农学报,2012,27(1):234-238.
[12] Wang Q C,Mawassi M,Sahar N,et al.Cryopreservation of grapevine(Vitis spp.) embryogenic cell suspensions by encapsulation-vitrification[J].Plant Cell Tissue Organ Cult,2004,77:267-275
[13] 李明军,周娜,刘杰等.怀地黄玻璃化和包埋玻璃化法超低温保存[J].园艺学报,2008,35 (4): 607-610
[14] Verleysen H,Samyn G,Van Bockstaele E&P.Debergh Evaluation of Analytical techniques to prediet viability after cryopreservation. Plant Cell Tiss Org Cult,2004,77:11-21.
[15] 张永卓,罗正荣.甜柿休眠芽茎尖包埋玻璃化法超低温保存及植株再生[J].中国农业科学,2004,37(12):2019-2022.
[16] 刘云国,王晓云.苹果种质资源玻璃化法超低温保存技术[J].山东农业大学学报, 2002, 33 (1): 32-36.
[17] 柳金伟,陈新,徐丽等.果树种质资源超低温保存研究进展[J].山东农业科学,2013,45( 3):122-125,131.
[18] 赵艳华,吴雅琴.桃离体茎尖的超低温保存及植株再生[J].园艺学报,2006,33(5):1042-1044.
