胡杨条形叶和卵形叶类胡萝卜素含量与高光谱反射率的相关性研究
2014-03-21,2*
,2*
(1 塔里木大学植物科学学院, 新疆 阿拉尔 843300)(2 新疆生产建设兵团塔里木盆地生物资源保护利用重点实验室, 新疆 阿拉尔 843300)
1 前言
胡杨(Populus euphratica)是杨柳科杨属中最古老、最原始的荒漠特有珍贵树种,是我国首批确定的388种珍稀濒危植物中的渐危种之一,也是新疆维吾尔自治区人民政府列为优先保护的濒危物种之一[1]。分布在塔里木河沿岸的胡杨林,具有防风固沙、稳定河道、保障绿洲农牧业生产和维持绿洲生态系统持续健康发展的重要作用[2,3]。近几十年来,受人类活动的影响,塔里木河两岸地下水位下降,导致天然胡杨林的大面积衰退,加大对胡杨林的保护和研究已迫在眉睫。
在植物叶片色素中,类胡萝卜素具有重要的生理功能[4],尤其是在捕获光能及对光合作用器官的光保护方面发挥着关键的作用[5-6]。当受到环境胁迫时,类胡萝卜素的含量也会发生变化[7-10]。传统的测定植物叶片类胡萝卜素含量的方法如化学、物理化学及生物学方法具有破坏性取样,耗时间,成本较高,需用专业仪器设备等缺点[11-12]。近二十年来,随着高光谱遥感技术的快速发展,利用高光谱反射率数据可以快速、无损地实现植物色素的遥感估测[13-16]。胡杨叶片有多种形状[17]。目前,关于不同叶形的类胡萝卜素含量及光谱反射率的相关研究还鲜有报道。本研究目的是利用野外地物光谱辐射计实地测量胡杨条形叶和卵形叶类胡萝卜素含量和高光谱反射率,研究二者之间的相关性,以便为利用遥感技术监测胡杨叶片类胡萝卜素的变化提供基础依据。
2 材料与方法
2.1 研究区概况
研究区位于塔里木河上游阿拉尔交叉工程东原始胡杨林,地理坐标为北纬40°26′,东经80°56′(图1)。该地区属典型大陆性气候,全年干旱少雨,蒸发强烈,日照充足,热量丰富,降水稀少,温差大。年日照数平均2 915. 1小时,年平均气温10. 8 ℃,7月份平均气温25. 3 ℃,1月份平均气温-8. 3 ℃,年际温差33. 6 ℃。全年平均无霜期204天,全年平均降水量43 mm,年蒸发量2 110 mm。
2.2 光谱数据的采集
采用ISI921VF-512野外地物光谱辐射计测量胡杨叶片的高光谱反射率。测量波段范围为可见-近红外波段(393-1095 nm),共有512个波段,光谱采样间隔为1. 4 nm,光谱分辨率为3. 5 nm,视场角为2. 5°。为了减小太阳高度角变化对光谱测量结果的影响,测量时间固定在12:00~16:00之间,且仪器探头垂直向下。将胡杨枝条用高枝剪剪下,随机采集枝条中部叶片,将其平放在有阳光直接照射的林间空地的一块黑布上。先测量标准漫反射板,紧接着测量叶片。每隔10个叶片测量一次标准漫反射板。每个样本由10个叶片组成,以其平均值作为样本的光谱反射率值。从2009年5月至9月,在胡杨叶片生长季节期间每月测量一次,选择晴朗无云无风天气时测量。日期分别是5月16日(卵形叶和条形叶各44个样本),6月14日(卵形叶和条形叶各40个样本),7月15日(卵形叶和条形叶分别40、38个样本),8月17日(卵形叶和条形叶各40个样本),和9月19日(卵形叶和条形叶分别40、30个样本)。5月原始胡杨林的胡杨叶片受春尺蠹(俗称“吊死鬼”)危害严重,难以采集到完整的叶片,因此,就用塔里木大学校园内的胡杨树叶片作为5月的样本。

图1 研究区假彩色合成图像
2.3 叶面积和叶片含水量的测定
摘取胡杨卵形叶和条形叶各100片。用直尺测量长(l0)和宽(w0),然后用数字式光电求积仪测量叶片面积(S0)。采用公式S0=k×l0×w0计算出胡杨卵形叶和条形叶的叶面积系数k。再根据k值及测量的样本叶片的长(l)和宽(w)换算出样本的叶面积S。用烘干法(80 ℃下烘干48小时)测量胡杨叶片含水量。
2.4 类胡萝卜素含量和密度的测定[18]
将0. 2 g剪碎的新鲜胡杨叶片放入25 mL具塞试管中,加入20 mL丙酮:Tris缓冲溶液(80:20,pH=7. 8),在冷藏箱(4 ℃)中浸提2~5天至叶片完全变成白色。用分光光度计测定浸提液在470 nm,537 nm,647 nm,和663 nm波长时的吸光度A值。根据Simms and Gamon(2002)提出的公式来计算类胡萝卜含量和密度[18]:
chla=0. 01 373A663- 0. 000 897A537- 0. 003 046A647
chlb=0. 024 05A647- 0. 004 305A537- 0. 005 507A663
anths=0. 081 73A537- 0. 006 97A647- 0. 002 228A663
car=[8A470- (1. 71*chla+chlb) - 9. 479*Anths]/119. 26
A470, A537, A647, A663分别表示色素提取液在波长470 nm、537 nm、647 nm和663 nm下的吸光度值。chla, chlb, anths和car分别表示浸提液中叶绿素a、叶绿素b、花青素和类胡萝卜素的浓度(umol/ml)。由类胡萝卜素的分子量(550 g/mol)及叶片含水量和叶面积,将浸提液中的色素浓度换算为叶片中类胡萝卜素的含量与密度。胡杨叶片中的类胡萝卜素含量和密度的表示单位有三种: 每克鲜叶中含类胡萝卜素的毫克数(mg/g Fw)、每克干叶中含类胡萝卜素的毫克数(mg/g Dw)和类胡萝卜素密度,每平方米叶面积含类胡萝卜素的毫克数(mg.m-2)。
2.5 数据分析
对类胡萝卜素含量、密度分别与不同波段高光谱反射率进行相关分析。rCar、rCF、和rCD分别表示高光谱反射率与类胡萝卜素密度(Car)、类胡萝卜素含量Ccf (鲜基)和Ccd (干基)之间的简单相关系数。
3 结果
3.1 叶面积
图2和图3表示不同叶形叶面积系数k值。

图2 胡杨卵形叶面积系数变化图

图3 胡杨条形叶面积系数变化图
从图2可知,胡杨卵形叶的面积系数在0. 5~0. 7之间,平均值为0. 62;从图3可知,胡杨条形叶的面积系数在0. 6~0. 8之间,平均值为0. 70。卵形叶的面积要大于条形叶。

表1 胡杨叶片面积季节变化
从表1可知,胡杨单个叶片的叶面积从7月到8月的增长幅度最大,说明7月份是胡杨叶片的快速扩展期。
3.2 类胡萝卜素密度、含量

表2 胡杨卵形叶和条形叶类胡萝卜素密度及含量的季节变化
从表2可知,随着季节的变化,胡杨叶片类胡萝卜素的含量先增加后减少。卵形叶类胡萝卜素含量在8月最高,7月到8月的增长幅度最大,这说明7月胡杨卵形叶类胡萝卜素大量产生。胡杨条形叶在7月类胡萝卜素含量最高,说明7月胡杨条形叶类胡萝卜素大量产生。
3.3 叶片反射光谱
植物叶片中各种光合色素的吸收光谱不同。叶绿素吸收光谱的最强吸收区有二处:一是波长660~640 nm的红光区,另一个是波长430~450 nm的蓝紫光区[19]。叶绿素a和叶绿素b的吸收光谱很相近,但叶绿素a在红光部分的吸收区较叶绿素b宽,而在蓝紫色光部分的吸收区则较窄。类胡萝卜素的吸收光谱与叶绿素不同,主要吸收可见光中的蓝紫光区,但是一有部分与叶绿素a的吸收区重叠[18]。图4和图5表明:无论卵形叶还是条形叶,胡杨叶片的反射光谱都具有绿色植物的典型反射光谱特征,如“绿峰”、“红谷”和“红边”。胡杨叶片中的色素对可见光中的蓝光和黄光的强吸收而在绿光区(510~560 nm)形成了反射率较高的“绿峰”;接下来的低谷称之为“红谷”即红光吸收谷,是由胡杨叶片叶绿素强烈吸收640~680 nm红光所形成的;“红谷”之后紧接着是胡杨叶片的“红边”。随季节的变化,胡杨卵形叶在“绿峰”、“红谷”处的光谱反射率升高,而在近红外波段的光谱反射率是先升高再降低。但条形叶的光谱反射率与卵形叶略有不同。

图4 不同月份胡杨卵形叶光谱反射率
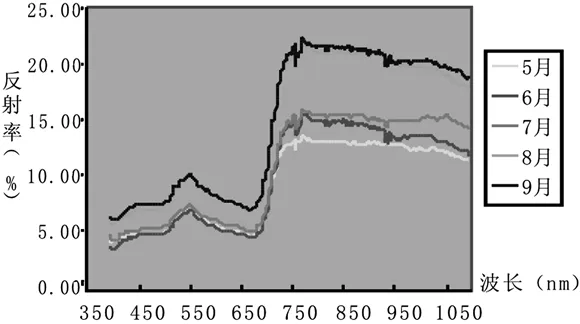
图5 不同月份胡杨条形叶光谱反射率
3.4 类胡萝卜素含量、密度与光谱反射率的相关性
图6~图7反映了5月胡杨叶片光谱反射率与类胡萝卜素含量、密度的相关系数随波长的变化趋势。卵形叶类胡萝卜素含量、密度与光谱反射率在可见光-近红外波段(393~1 095 nm)存在着较强的负相关性,简单相关系数小于0;光谱反射率与类胡萝卜素含量(鲜基)的负相关性最强,与类胡萝卜素含量(干基)的负相关性次之,与类胡萝卜素密度的负相关性最弱。条形片类胡萝卜素含量(鲜基)和类胡萝卜素密度与光谱反射率在可见光-近红外波段(393~1 095 nm)也存在着较强的负相关性,简单相关系数小于0;条形叶类胡萝卜素含量(干基)与光谱反射率在可见光-近红外波段(393~1 095 nm)的相关性存在着两个不同的波段范围,在可见光波段(393~727 nm)呈负相关,简单相关系数小于0,而在近红外波段呈正相关,简单相关系数大于0。
图8~图9反映了6月胡杨叶片光谱反射率与类胡萝卜素含量、密度的相关系数随波长的变化趋势。卵形叶类胡萝卜素含量(鲜基)与光谱反射率在可见光-近红外波段(393~1 095 nm)存在着较强的负相关性,简单相关系数小于0;类胡萝卜素含量(干基)和类胡萝卜素密度与光谱反射率在可见光-近红外波段(393~1 095 nm)存在着较强的正相关性,且光谱反射率与类胡萝卜素密度的正相关性比光谱反射率与类胡萝卜素含量(干基)的正相关性要高。条形叶类胡萝卜素含量(干基)和类胡萝卜素密度与光谱反射率在可见光-近红外波段(393~1 095 nm)存在着较强的负相关性,简单相关系数小于0;而条形叶类胡萝卜素含量(鲜基)与光谱反射率在可见光-近红外波段(393~1 095 nm)的相关性存在着两个不同的波段范围,在可见光波段(393~409 nm)呈正相关,简单相关系数大于0,在可见光-近红外波段(409~1 095 nm)呈负相关,简单相关系数小于0;光谱反射率与类胡萝卜素密度的负相关性最强,光谱反射率与类胡萝卜素含量(鲜基)的负相关性次之,光谱反射率与类胡萝卜素含量(干基)的负相关性最弱。

图6 5月胡杨卵形叶光谱反射率与类胡萝卜素含量(或密度)的相关性

图7 5月胡杨条形叶光谱反射率与类胡萝卜素含量(或密度)的相关性
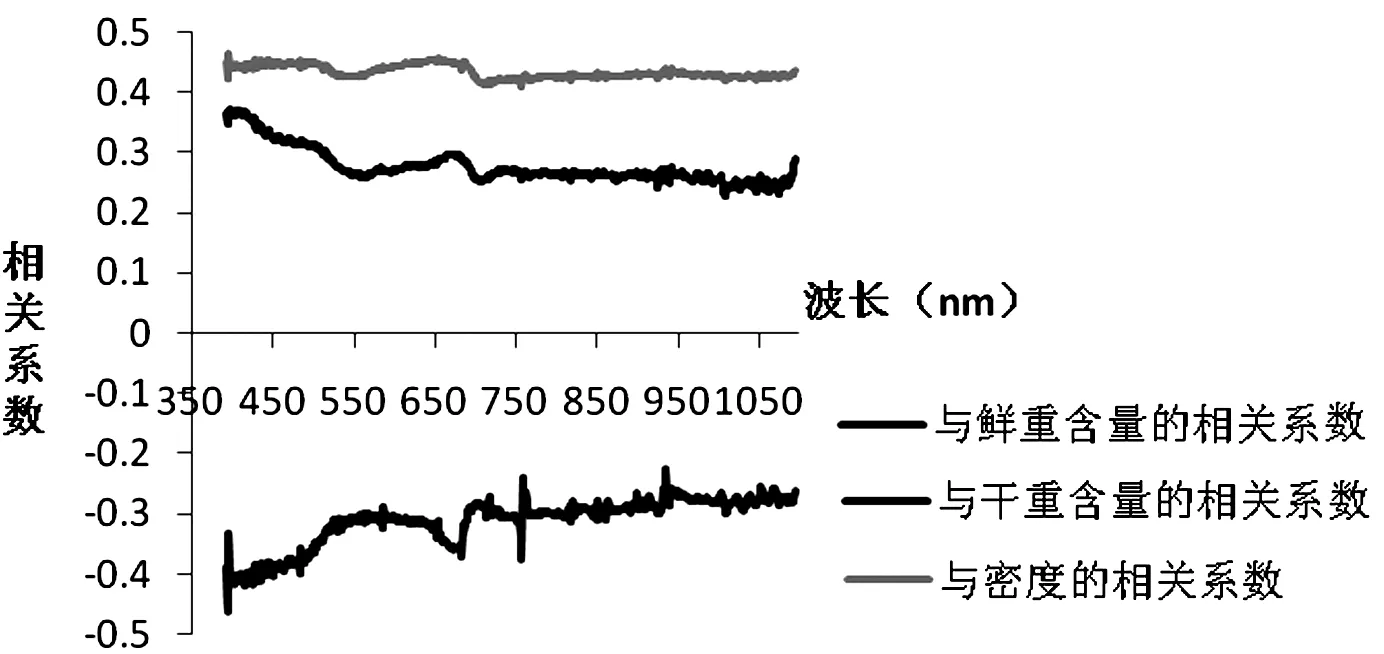
图8 6月胡杨卵形叶光谱反射率与类胡萝卜素含量(或密度)的相关性

图9 6月胡杨条形叶光谱反射率与类胡萝卜素含量(或密度)的相关性

图10 7月胡杨卵形叶光谱反射率与类胡萝卜素含量(或密度)的相关性

图11 7月胡杨条形叶光谱反射率与类胡萝卜素含量(或密度)的相关性

图12 8月胡杨卵形叶光谱反射率与类胡萝卜素含量(或密度)的相关性

图13 8月胡杨条形叶光谱反射率与类胡萝卜素含量(或密度)的相关性

图14 9月胡杨卵形叶光谱反射率与类胡萝卜素含量(或密度)的相关性

图15 9月胡杨条形叶光谱反射率与类胡萝卜素含量(或密度)的相关性
图10-图11反映了7月胡杨叶片光谱反射率与类胡萝卜素含量、密度的相关系数随波长的变化趋势。卵形叶片类胡萝卜素含量、密度与光谱反射率在可见光-近红外波段(393~1 095 nm)存在着较强的正相关性,简单相关系数大于0;光谱反射率与类胡萝卜素含量(鲜基)的正相关性较强,与类胡萝卜素含量(干基)的正相关性次之,与类胡萝卜素密度的正相关性较弱。正相关系数最大值都在0. 3左右。条形叶类胡萝卜素密度与光谱反射率在可见光-近红外波段(393~1 095 nm)存在着较强的负相关性,简单相关系数小于0;条形叶类胡萝卜素含量(鲜基)与光谱反射率在可见光-近红外波段(393~1 095 nm)的相关性存在着三个不同的波段范围,在可见光波段(393~432 nm)呈负相关,简单相关系数小于0,在可见光-近红外波段(433~926 nm)呈正相关,简单相关系数大于0,在近红外波段呈负相关,简单相关系数小于0;条形叶类胡萝卜素含量(干基)与光谱反射率在可见光-近红外波段(393~1 095 nm)的相关性存在着两个不同的波段范围,在可见光波段(393~450 nm)呈负相关,简单相关系数小于0,在可见光-近红外波段(450~1 095 nm)呈正相关,简单相关系数大于0。
图12~图13反映了8月胡杨叶片光谱反射率与类胡萝卜素含量、密度的相关系数随波长的变化趋势。卵形叶片类胡萝卜素含量(鲜基)与光谱反射率在可见光-近红外波段(393~1 095 nm)存在着较强的负相关性,简单相关系数小于0;类胡萝卜素密度与光谱反射率在可见光-近红外波段(393~1 095 nm)存在着较强的正相关性,简单相关系数大于0;类胡萝卜素含量(干基)与光谱反射率在可见光-近红外波段(393~1 095 nm)的相关性比较复杂,既有正相关的波段存在也有负相关的波段存在。条形叶片类胡萝卜素含量(干基)与光谱反射率在可见光-近红外波段(393~1 095 nm)存在着较强的正相关性,简单相关系数大于0;类胡萝卜素含量(鲜基)与光谱反射率在可见光-近红外波段(393~1 095 nm)存在着较强的负相关性,简单相关系数小于0;条形叶类胡萝卜素密度与光谱反射率在可见光-近红外波段(393~1 095 nm)的相关性也比较复杂,也波段长有关。
图14~图15反映的是9月胡杨叶片光谱反射率与类胡萝卜素含量、密度的相关系数随波长的变化趋势。卵形叶片类胡萝卜素含量、密度与光谱反射率在可见光-近红外波段(393~1 095 nm)存在着较强的负相关性,简单相关系数小于0;光谱反射率与类胡萝卜素含量(鲜基)的负相关性最强,类胡萝卜素密度次之,类胡萝卜素含量(干基)最弱。条形叶片类胡萝卜素含量、密度与光谱反射率在可见光-近红外波段(393~1 095 nm)存在着较强的负相关性,简单相关系数小于0;光谱反射率与类胡萝卜素含量(干基)的负相关性最强,类胡萝卜素密度次之,类胡萝卜素含量(鲜基)最弱。

表3 胡杨叶片光谱反射率与类胡萝卜素密度、含量的简单相关系数极值(注:绝对值最大值)
由表3可知,9月份的胡杨卵形叶类胡萝卜素含量(鲜基)与光谱反射率在757 nm波长处的负相关性最强,其值为-0. 582;6月份的胡杨条形叶类胡萝卜素密度与光谱反射率在862 nm波长处的负相关性最强,其值为-0. 430。其它月份,两种叶形的光谱反射率与类胡萝卜素的相关系数极值有正值也有负值,只有条形叶类胡萝卜素含量(鲜基)与光谱反射率的极值为负值。
4 结论与讨论
本研究实地测量了塔里木河上游生长季节期间两种叶形胡杨叶片的光谱反射率与类胡萝卜素含量,分析了它们之间的相关性;同时还获得了卵形叶和条形叶的叶面积系数,得到了以下结论:
胡杨叶片类胡萝卜素与光谱反射率之间的相关性极为复杂,既有正相关关系也有负相关关系。相关系数值与叶片的生长期、叶形、类胡萝卜素含量的表示单位和光谱波长均有关系。卵形叶类胡萝卜素含量(鲜基)与高光谱反射率在9月份时757 nm处的负相关性最强(相关系数为-0. 582);条形叶类胡萝卜素密度与高光谱反射率在6月份时862 nm处的负相关性最强(相关系数为-0. 430)。不同月份和用不同单位表示的类胡萝卜素含量(或密度)条形叶和卵形叶的类胡萝卜素含量、密度与光谱反射率的相关性表现不同,相关系数值大小变化较大。这说明,胡杨叶片高光谱反射率与类胡萝卜素之间存在着比较复杂的关系。目前,对这种复杂性现象的研究报道还不多。可能因为类胡萝卜素吸收光谱与叶绿素有部分的重叠[15,8],且类胡萝卜素含量与总叶绿素含量有一定的相关性[14,16]。不同生长季节,胡杨叶片内部色素含量、比例了发生着变化(类胡萝卜素/叶绿素比值从5月的5. 0降低到9月的4. 0),而反射光谱是一个综合性反映叶片内部成分(主要是色素)和表面结构(如绒毛,蜡质)的指标,因此,出现这种复杂性也是在情理之中,这也是普遍认为的单独用反射率来估计类胡萝卜素比估计叶绿素要困难得多的主要原因之一[14,18,20]。目前,尽管有许多研究人员用高光谱指数,如光化学或生理反射指数PRI[21]、结构不敏感色素指数SIPI[22]和植物衰老反射指数PSRI[23]来估计植物叶片类胡萝卜素的含量,还是利用了类胡萝卜素与叶绿素之间的相关性[14,15],但多数研究回避了类胡萝卜素与光谱反射率相关性的报道,可能就是基于这种复杂性,似乎无规律性的现象不便于描述的因素所致。
胡杨的两种叶形,无论卵形叶还是条形叶的反射光谱都符合典型的植物叶片反射光谱。具有明显的“绿峰”、“红谷”和“红边”等特征。这与肖正清等(2007)[24]、许丹等(2012)[25]和林海军等(2013)[26]的研究结果是一致的。同时本研究还包括了胡杨叶片光谱的季节性变化及考虑了不同的叶形条件下的反射光谱,这方面的研究报道还比较少。随着生长季节的变化,从5月至9月,胡杨叶片反射光谱变化的主要特征是:卵形叶在“绿峰”、“红谷”处的光谱反射率升高,而在近红外波段的光谱反射率是先升高后降低。随季节的变化,胡杨条形叶的光谱反射率升高。
本研究获得了塔里木河上游胡杨叶片类胡萝卜素含量随着季节变化的规律。相关的研究报道还不多,仅见袁月等(2009)[27]和王海珍等(2013)[28]报道的类胡萝卜素含量分别是0. 32~0. 61 mg/kgFW 和0. 19~0. 26 mg/g Fw。随着季节的变化,胡杨叶片类胡萝卜素的含量先增加后减少,胡杨卵形叶在8月类胡萝卜素含量最多,胡杨条形叶在7月类胡萝卜素含量最多。
接下来的工作是利用类胡萝卜素/叶绿素的比值,从多种可选的高光谱指数或者新的高光谱指数来构建类胡萝卜素含量的遥感估算模型;并评价不同月份、不同叶形遥感估算模型的精度,从而能为应用航天高光谱影像来开展胡杨类胡萝卜素的遥感监测提供依据。
致谢:塔里木大学动物科学学院草业科学11班的牛华东同学参加了室内外的分析测试工作,在此表示感谢!
[1] 王世绩. 全球胡杨林的现状及保护和恢复对策[J].世界林业研究,199(6):37-44.
[2] 王让会. 干旱区内陆河流域的荒漠河岸林变化研究[J]. 林业科技通讯,2000(5):9-13.
[3] 苏培玺,张立新,杜明武,等.胡杨不同叶形光合特性、水分利用效率及其对加富有CO2的响应[J].植物生态学报,2003,29(10):34-40.
[4] 黄彬城, 季静, 王罡,等. 植物类胡萝卜素的研究进展[J]. 天津农业科学,2006,12(2): 13-17.
[5] Cazzonelli C I. Carotenoids in nature: insights from plants and beyond[J]. Functional Plant Biology, 2011(38):833-847.
[6] Frank H A,Cogdell R J.Carotenoids in Photosynthesis[J]. Photochemistry and Photobiology, 1996,63(3): 257-264.
[7] 白娟,龚春梅,王刚,等.干旱胁迫下荒漠植物红砂叶片抗氧化特性[J].西北植物学报,2010,30(12): 2444-2450.
[8] McElroy S J,Kopsell D A. Physiological role of carotenoids and other antioxidants in plants and application to turfgrass stress management[J]. New Zealand Journal of Crop and Horticultural Science, 2009,37(4): 327-333.
[9] Chenard C H,Kopsell D A,Kopsell D E. Nitrogen concentration affects nutrient and carotenoid accumulation in Parsley[J].Journal of Plant Nutrition, 2005, 28(2): 285-297.
[10] Borghesi E, González-Miret M L, Escudero-Gilete M L, et al. Effect of salinity stress on Carotenoids, Anthocyanins, and color of diverse tomato genotypes[J]. Journal of Agricultural and Food Chemistry, 2011(59):11676-11682.
[11] Arvayo-Enríquez H, Mondaca-Fernández I,Gortárez-Moroyoqui P, et al. Carotenoids extraction and quantification: a review[J]. Analytical Methods. 2013(5):2916-2924.
[12] 刘长付,陈媛梅,郑彩霞. HPLC 法研究番茄中类胡萝卜素的动态变化[J]. 中国农业大学学报,2013,18(4):84-90.
[13] 童庆禧,张兵, 郑兰芬. 高光谱遥感的多学科应用[M].北京:电子工业出版社,2006: .
[14] 赵德华,李建龙.高光谱技术提取不同作物叶片类胡萝卜素信息[J].遥感信息,2004(3):13-17.
[15] 伍维模,牛建龙,温善菊,等. 植物色素高光谱遥感研究进展[J]. 塔里木大学学报,2009,21(4):61-68.
[16] Gitelson A A, Keydan G P, Merzlyak M N. Three-band model for noninvasive estimation of chlorophyll, carotenoids, and anthocyanin contents in higher plant leaves [J]. Geophy.Res.Lett, 2006,33,L11402,1-5.
[17] 黄文娟,李志军,杨赵平,等.胡杨异形叶结构型性状及其相互关系[J]. 生态学报,2010,30(17):4636-4642.
[18] Simms D A, Gamon J A. Relationship between leaf pigment content and spectral reflectance across a wide range of species, leaf structures and developmental stages[J]. Remote Sensing of Environment,2002(81):337-354.
[19] 孟繁静 编. 植物生理生化[M].1995,北京: 中国农业出版社.
[20] Zhao Kaiguang, Valle D, Popescu S, et al. Hyperspectral remote sensing of plant biochemistry using Bayesian model averaging with variable and band selection [J]. Remote Sensing of Environment, 2013(132):102-119.

[23] Merzlyak M N, Gitelson A A, Chivkunova O B, et al. Non-destructive optical detection of pigment changes during leaf senescence and fruit ripening [J]. Physiologica Plantarum, 1999(106):135-141.
[24] 肖正清,王树东,古丽 加帕尔,等. 塔里木河流域中下游胡杨典型叶片光谱响应特征[J].干旱区地理,200730(5):680-687.
[25] 许丹,伍维模,王家强,等.塔里木河上游天然胡杨叶片叶绿素与可见光-近红外光谱反射率的相关性研究[J].塔里木大学学报,2012,24(4):53-59.
[26] 林海军,李霞,牛婷,等.不同地下水埋深条件下胡杨叶片光谱特征分析[J].干旱资源与环境,2013,27(11):80-85.
[27] 袁月,吕光辉,徐敏,等.干旱胁迫下不同胸径胡杨生理特点分析[J]. 新疆农业科学,2009,46(2):299-305.
[28] 王海珍,陈加利,韩路,等. 地下水位对胡杨(Populus euphratica)和灰叶胡杨(Populus pruinosa)叶绿素荧光光响应与光合色素含量的影响[J].中国沙漠,2013,33(4):1054-1063.
