弥漫性脑创伤大鼠海马区Homer1a表达与p38MAPK激活的关系
2014-03-21李建民马荣丽赵雅宁窦娜陈长香李淑杏张盼
李建民,马荣丽,赵雅宁,窦娜,陈长香,李淑杏,张盼
(1.河北联合大学附属医院神经外科,河北唐山063000;2.河北省唐山市截瘫疗养院老年病区,河北唐山063000)
弥漫性脑创伤大鼠海马区Homer1a表达与p38MAPK激活的关系
李建民1,马荣丽2,赵雅宁1,窦娜1,陈长香1,李淑杏1,张盼1
(1.河北联合大学附属医院神经外科,河北唐山063000;2.河北省唐山市截瘫疗养院老年病区,河北唐山063000)
目的探讨弥漫性脑创伤(DBI)大鼠海马区Homer1a表达与p38有丝分裂原活化蛋白激酶(MAPK)的关系。方法将雄性SD大鼠149只分为对照组、轻度DBI组、重度DBI组。参照Marmarou′s法制作大鼠DBI模型。应用光镜和电镜观察脑组织形态变化;免疫组化及Western blot法检测海马区Homer1a和磷酸化p38MAPK表达。结果重度DBI组大鼠死亡率(49.3%)明显高于轻度DBI组(22.2%)(P<0.05)。电镜下,重度DBI组中神经元内细胞器、轴索及毛细血管等超微结构的损伤程度明显高于轻度DBI组。与对照组比较,2组DBI组1、6、24、48、72 h Homer1a和磷酸化p38MAPK表达均增高(P<0.05),轻度DBI组中Homer1a和磷酸化p38MAPK 24 h达高峰,48 h和72 h下降,但仍明显高于对照组(P<0.05);重度DBI组中Homer1a表达在6 h出现峰值,高表达持续至24 h;磷酸化p38MAPK 24 h达高峰。重度DBI组中1 h、6 h和24 h Homer1a表达高于轻度DBI组,48 h和72 h低于轻度DBI组(P<0.05);各时间点磷酸化p38MAPK表达均高于轻度DBI组(P<0.05)。相关分析显示轻度DBI组Homer1a与磷酸化p38MAPK表达相关(r=0.942,P<0.05);重度DBI组Homer1a与磷酸化p38MAPK表达相关(r=0.896,P<0.05)。结论DBI大鼠海马区Homer1a表达与p38MAPK激活有关。
弥漫性脑创伤;大鼠;Homer1a;有丝分裂原活化蛋白激酶
弥漫性颅脑损伤(diffuse brain injury,DBI)是导致儿童和青少年死亡或残疾的最常见原因[1]。DBI的病理机制与奋性氨基酸激活氧自由基、钙离子超载、炎性细胞因子及细胞凋亡等造成脑组织继发性损害有关[2,3]。Homer是一种主要存在于中枢神经系统的信号转导蛋白,属于突触后密度(postsynaptic density,PSD)蛋白质家族成员,大致可分为Homer1、Homer2和Homer3 3型。研究显示:脑损伤后Homer1a在神经细胞中呈动态表达,与神经元的存活有密切关系,而其同源异构体Homer1b/c表达无明显变化[4]。p38有丝分裂原活化蛋白激酶(mitogen -activated protein kinases,MAPK)是MAPKs家族的重要组成部分,在细胞增殖、分化及凋亡的过程中具有重要作用。现已证实p38MAPK信号活化在多种中枢神经疾病如脑卒中、脑创伤、老年痴呆等的病理过程中具有关键作用[5,6]。脑创伤病理过程中p38MAPK与Homer1a的关系尚不清楚。本研究通过参照Marmarou法[7]建立大鼠DBI模型,拟观察Homer1a和磷酸化p38MAPK在海马区的变化并分析其意义,旨在为DBI的救治提供新思路。
1 材料与方法
1.1 实验动物及分组
健康清洁级雄性Sprague-Dawley大鼠149只,体质量(320±20)g(购自北京维通利华公司)。将其按随机数字表法分为对照组(n=35)、轻度DBI组(n= 45)和重度DBI组(n=69)。每组大鼠根据受伤时间又分为1 h、6 h、24 h、48 h和72 h共5个时间点亚组。
DBI组:参照Marmarou法制作大鼠DBI模型。轻度DBI组:乙醚麻醉动物70~150 s,将质量450 g、直径18 mm的铜棒自1 m高度垂直落下,撞击置于大鼠冠状缝与矢状缝正中的不锈钢垫,造成大鼠轻度DBI模型;重度DBI组:调整打击高度至1.5 m,其余操作包括麻醉时间及方法、制作模型的装置及模型制作人员均同轻度DBI组。对照组:只进行乙醚麻醉而不致伤。模型制作过程中轻度DBI组动物死亡10只(死亡率22.2%),重度DBI组动物死亡34只(死亡率49.3%)。
1.2 方法
1.2.1 脑组织形态结构观察:(1)光镜:每组各时间点取3只大鼠。0.4%戊巴比妥纳麻醉动物,开胸、暴露心脏,4%多聚甲醛心脏灌流,断头取脑,在视交叉后1 mm和6 mm处冠状面切开,取中间块置入4%多聚甲醛固定液固定,石蜡包埋,切片(片厚5 μm),HE染色。存活神经细胞密度定量分析:每个标本取5张切片,在有测微尺的光学显微镜(× 200)下观察海马区神经元形态变化(有明显细胞膜、细胞核、核仁为存活神经细胞)。将海马区平均分为5个等份,每个等份选取1个相同部位,应用Motic-6.0图像采集及分析系统分别计数每个视野下存活神经元及总细胞数量,以每个视野下平均存活细胞百分率(海马区存活细胞数量与总细胞数量的比值)表示。(2)电镜:每组各时间点取1只大鼠。迅速断头取脑,冰台上分离大脑组织海马区,取约0.2 cm大小的组织,切成1 mm×1 mm×1 mm组织块,立即以4%戊二醛固定。0.1 mol/L二甲砷酸缓冲液冲洗2遍。1%四氧化锇固定。再经缓冲液冲洗,逐级丙酮脱水,环氧树脂浸透,包埋,超薄切片,醋酸铀枸橼酸铅染色。透射电镜(H-7650,日本Olympus公司)观察脑组织超微结构的变化。
1.2.2 Homer1a和磷酸化p38MAPK的免疫组化检测:切片常规脱蜡至水,枸橼酸盐微波修复,滴加Homer1a抗体(1∶200)或磷酸化p38MAPK抗体(1∶150),湿盒中4℃过夜,IgG抗体-HRP多聚体(PV二步法),37℃温箱30 min,DAB显色,脱水、透明、封片。以PBS代替一抗做阴性对照。观察并摄片。阳性率的定量分析:每个标本取5张切片,光镜下(× 200)每张切片在海马区选取5个视野,在有测微尺的光学显微镜下,应用Motic-6.0图像采集及分析系统分别观察海马区阳性细胞变化、对各组阳性细胞进行吸光度(absorbance,A)分析。
1.2.3 Homer1a和磷酸化p38MAPK免疫印迹:每组各时间点取3只大鼠,致死后迅速取双侧海马区组织,称量0.6 g,4℃PBS充分洗涤,加入3倍体积的4℃全细胞裂解液,冰浴中匀浆,4℃离心5 min,12 000 r/min,取上清。蛋白定量并贮存于-80℃备用。取40 μg蛋白样品与等体积上样缓冲液混合,煮沸10 min,100 g/L十二烷基硫酸钠聚丙烯酰胺凝胶电泳,转膜,封闭2~3 h,加入Homer1a抗体(1∶2 000)或磷酸化p38MAPK抗体(1∶2 000),4℃孵育过夜,TBST洗膜,加入标记的二抗,37℃孵育1 h,TBST洗膜,DAB显色,用图像分析仪测定光密度,进行定量分析。
1.3 统计学分析
应用SPSS 17.0统计分析软件对数据进行数据处理,检验方法为析因设计的方差分析以及Pearson相关分析,数据以表示,P<0.05为差异有统计学意义。
2 结果
2.1 脑组织形态结构变化
伤后轻度和重度DBI组大鼠脑组织大体均可见出血点,但无明显挫裂灶。光镜下,2组大鼠蛛网膜下腔可见出血或黄染,大脑皮层组织广泛水肿,血管腔扩大、充血;伤后2组大鼠不同时间点均可见大脑皮质区散在变性死亡的神经元,神经细胞胞体收缩呈三角形,胞质嗜色性减弱,核皱缩浓染,细胞周围出现空隙;视野内可见有核溶解及神经元细胞空泡样变,细胞间隙显著增宽。电镜下,2组DBI组大鼠脑组织出现轴索排列紊乱、肿胀,髓鞘泡鼓、内折、分层,轴索内神经丝结构不清(变性),轴索断裂,毛细血管周围水肿,肿胀变性神经元中大量细胞器堆积。上述超微结构变化在重度DBI组更显著。结合动物死亡率和组织形态改变,本研究轻度和重度DBI动物模型制作成功[7]。
与对照组比较,轻度DBI组海马区各时间点存活神经细胞数量降低;与轻度DBI组比较,重度DBI组海马区各时间点存活神经细胞数量降低(P<0.05)。见表1。
表1 海马区神经细胞存活率的比较Tab.1 Comparison of the rate of survival nerve cells in hippocampus

表1 海马区神经细胞存活率的比较Tab.1 Comparison of the rate of survival nerve cells in hippocampus
1)compared with the control group,P<0.05;2)compared with mild DBI group,P<0.05.
2.2 Homer1a和磷酸化p38MAPK蛋白免疫组化及免疫印迹结果
Homer1a的阳性表达主要位于神经元胞质或突起,磷酸化p38MAPK的阳性表达主要位于神经元胞核。对照组大鼠海马区只有极少量的Homer1a和磷酸化p38MAPK阳性细胞,染色较淡。轻度和重度DBI组海马区可见大量Homer1a和磷酸化p38MAPK阳性细胞。与对照组比较,轻度DBI组Homer1a和磷酸化p38MAPK阳性反应伤后1 h即开始逐渐增强,24 h达高峰,48 h和72 h有所减弱,但仍强于对照组(P<0.05);重度DBI组伤后Homer1a和磷酸化p38MAPK阳性反应变化趋势与轻度DBI组基本一致,Homer1a的表达于6 h达高峰,高表达状态持续至24 h,磷酸化p38MAPK则于24 h达高峰,与轻度DBI组比较,重度DBI组1、6和24 h Homer1a表达上调,48 h和72 h时减少;各时间点磷酸化p38MAPK表达增加(P<0.05)。见图1,表2,表3。
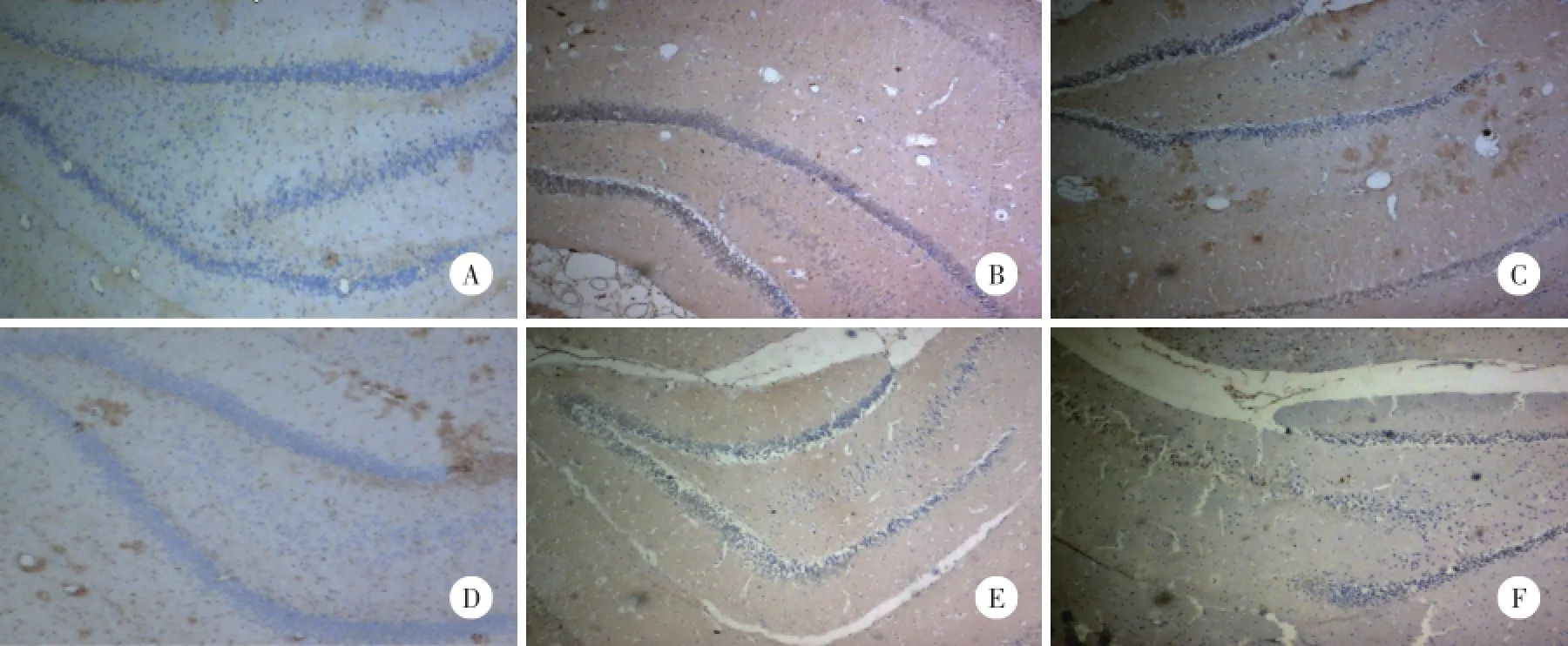
图1 免疫组化标记海马区Homer1a和磷酸化p38MAPK阳性细胞×100Fig.1 Immunohistochemical markers immunoreactive cells of Homer1a and phosphorylated p38MAPK in the hippocampus×100
免疫印迹结果显示:Homer1a条带清晰,以β-actin吸光度值作为内参照,对各组条带的吸光度值进行校正和半定量分析。与对照组比较,轻度DBI组中各时间点Homer1a和磷酸化p38MAPK蛋白均增高,24 h达高峰,48 h和72 h有所下降,但仍高于对照组(P<0.05);重度DBI组Homer1a和磷酸化p38MAPK阳性反应变化趋势与轻度DBI组基本一致,Homer1a蛋白6 h出现峰值,高表达状态持续至24 h;Homer1a 6 h达高峰,高表达状态持续至24 h,磷酸化p38MAPK 24 h达高峰。与轻度DBI组比较,重度DBI组Homer1a在上伤后1、6和24 h表达上调,48和72 h减少;各时间点磷酸化p38MAPK蛋白的表达均增高(P<0.05)。见图2,表4,表5。
表2 各组大鼠海马区Homer1a蛋白吸光度值的比较Tab.2 Comparison of the absorbance(A)volume of Homer1a protein in hippocampus

表2 各组大鼠海马区Homer1a蛋白吸光度值的比较Tab.2 Comparison of the absorbance(A)volume of Homer1a protein in hippocampus
1)compared with the control group,P<0.05;2)compared with mild DBI group,P<0.05.
表3 各组大鼠海马区磷酸化p38MAPK蛋白的吸光度值的比较Tab.3 Comparison of the absorbance(A)volume of phosphorylated p38MAPK protein in hippocampus

表3 各组大鼠海马区磷酸化p38MAPK蛋白的吸光度值的比较Tab.3 Comparison of the absorbance(A)volume of phosphorylated p38MAPK protein in hippocampus
1)compared with the control group,P<0.05;2)compared with mild DBI group,P<0.05.
2.3 相关分析结果
相关分析结果显示:轻度及重度DBI组Homer1a与磷酸化p38MAPK表达水平相关(r=0.942,P<0.05;r=0.896,P<0.05)。
3 讨论
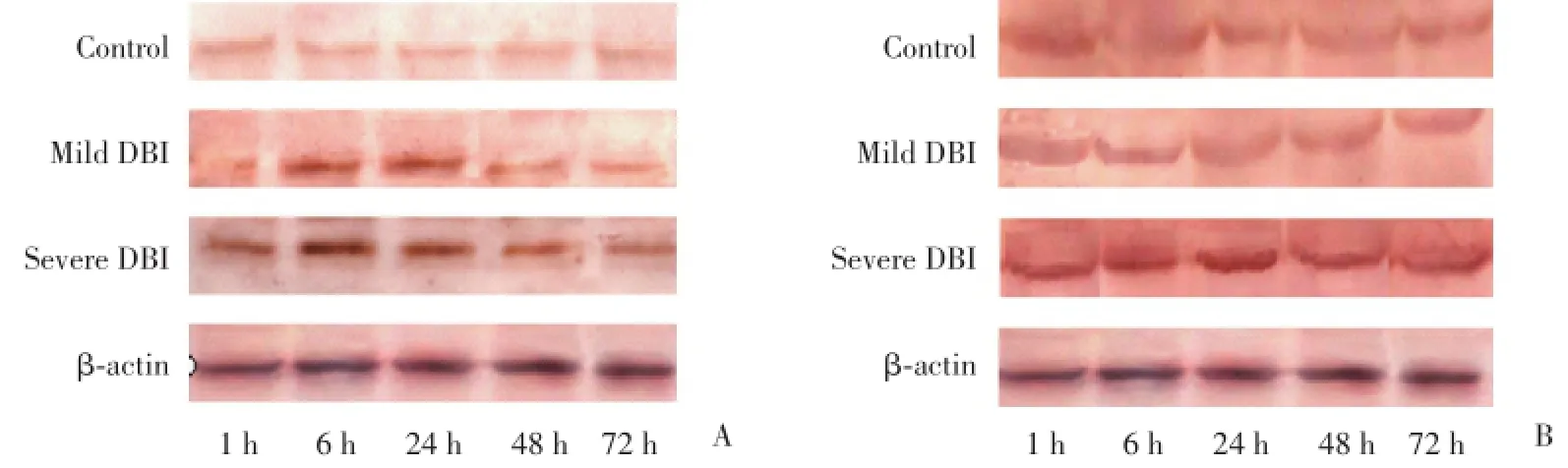
图2 Western blot法检测海马区Homer1a和磷酸化p38MAPK蛋白的表达Fig.2 Detection of Western blot of the expression of Homer1a and phosphorylated p38MAPK protein in the hippocampus
表4 各组大鼠海马区Homer1a蛋白表达水平的比较Tab.4 Comparison of the Homer1a protein expression in hippocampus
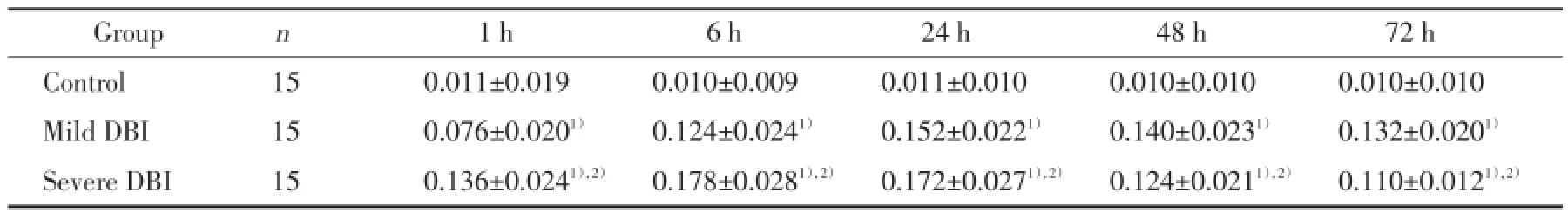
表4 各组大鼠海马区Homer1a蛋白表达水平的比较Tab.4 Comparison of the Homer1a protein expression in hippocampus
1)compared with the control group,P<0.05;2)compared with mild DBI group,P<0.05.
表5 海马区磷酸化p38MAPK蛋白表达水平的比较Tab.5 Comparison of the phosphorylated p38MAPK expression in hippocampus

表5 海马区磷酸化p38MAPK蛋白表达水平的比较Tab.5 Comparison of the phosphorylated p38MAPK expression in hippocampus
1)compared with the control group,P<0.05;2)compared with mild DBI group,P<0.05.
Homer1a是存在于中枢神经系统的重要信号转导蛋白,能够调节代谢型谷氨酸受体在突触部位的分布及受体信号传递效率,减少离子型谷氨酸受体聚合物数量以及其活性,防止细胞过度兴奋,减少钙离子内流,对神经细胞起保护作用[8~10]。本研究结果发现:2个DBI组在伤后1 h~72 h时Homerla表达上调,轻度DBI组于24 h达到高峰;而重度DBI组于6 h出现峰值,高表达状态持续至24 h。Homer1a表达受神经元兴奋性活动调节,且呈长时程[11]。DBI的发病机制异常复杂,其中谷氨酸的兴奋毒性作用及其启动的钙离子超载是关键因素,谷氨酸升高的浓度及持续的时间与脑创伤损伤程度及预后相关[12]。相较于轻度DBI,重度DBI后谷氨酸在短时间迅速堆积,神经细胞快速去极化,可诱导即早基因蛋白Homer1a超表达;此外,重度DBI后,谷氨酸的降解系统功能衰竭,甚至出现向细胞外逆转运现象,导致细胞间隙的谷氨酸较长时间内在高水平范围变动,可能是Homer1a表达高于轻度DBI组和高表达状态持续时间延长的原因。重度DBI组48 h和72 h时Homer1a表达降低,可能与该时间点大量神经细胞死亡、存活神经细胞率明显降低有关。
p38MAPK活化在中枢神经系统疾病中主要表现为负性损伤作用,可介导并加重谷氨酸兴奋性毒性作用、炎性反应,导致脑水肿和神经细胞死亡[13,14]。本研究结果发现,DBI后海马区Homer1a表达与p38MAPK活化的趋势和分布区域存有一定的相似性,相较于轻度DBI组,重度DBI组Homer1a和磷酸化p38MAPK的表达发生进一步改变。相关分析也显示二者的相关性。提示DBI后Homer1a表达和P38MAPK活化存在一定的内在联系。目前尚无关于p38MAPK信号和Homer1a关系的明确报道。但多项研究表明p38MAPK活化与谷氨酸的兴奋性有关,有学者指出在谷氨酸与离子型受体结合过程中p38MAPK的活化必不可少[15];而Homer1a表达的变化与谷氨酸及其受体活性有明确关系[16,17]。因此,推测可能Homer1a表达增加和p38MAPK活化是脑创伤后谷氨酸启动兴奋毒性作用病理过程中2个相互伴随的平行过程,或是关系密切的上游和下游级联启动关系。
总之,本研究通过对比分析轻、重度DBI大鼠脑海马区Homer1a和磷酸化p38MAPK表达的变化,发现脑创伤大鼠海马区Homer1a表达与p38MAPK激活有关。
[1]Graham DI,McIntosh TK,Maxwell Wl.Recent advaces in neurotrauma[J].Neuropathol Exp Neurol,2000,59(8):641-651.
[2]Urban RJ,Harris P,Masel B.Anterior hypopituitarism following truamatic brain injury[J].Brain Inj,2005,19(5):349-358.
[3]Mcpeak LA,Stries WM,Cope VN.Disability evaluation following traumatic brain injury[J].Phys Med Rehabil Clin N Am,2001,12(3):587-601.
[4]张磊,刘伟,刘文博,等.大鼠脑缺血再灌注损伤后皮层Homerla蛋白改变及意义[J].临床神经外科杂志,2009,6(1):1-3.
[5]Wallace BK,Jelks KA,O'donell ME.Ischemia-induced stimulation of cerebral microvascular endothelial cell Na-K-Cl cotransport involves p38 and JNK MAPkinases[J].Physiol Cell Physiol,2012,302(3):C505-C517.
[6]李建民,赵雅宁,陈长香,等.脑缺血预处理对沙鼠脑缺血再灌注损伤p38MAPK活化的作用[J].中华神经外科杂志,2011,27(7):741-745.
[7]Marmarou A,Foda MA,van den Brink W,et al.A new model of difuse brain injur-y in rats.Part I:pathophysiology and biomechanics[J].J Neurosurg,1994,80(2):291-300.
[8]Sakagami Y,Yamamoto K,Sugiura S,et al.Essential roles of Homerla in homeostatic regulation of pyramidal cell excitability:a possible link to clinical benefits of electroconvulsive shock[J].Eur Neurosci,2005,21(12):3229-3239.
[9]Sato M,Suzuk S.NMDA receptor stimulation and brain-derived neurotrophic factor upregulate homer 1a mRNA via the mitogen-activated protein kinase cascade in cultured cerebellar granule cells[J]. Neuroscience,2001,21(11):3797-3805.
[10]Salm EJ,Thayer SA.Homer proteins accelerate Ca2+clearance mediated by the plasma membrane Ca2+pump in hippocampal neurons[J].Biochem Biophys Res Commun,2012,424(6):76-81.
[11]Shin DM,Dehoff M,Luo X,et al.Homer 2 tunes G protein-coupled receptors stimulus intensity by regulating RGS proteins and PLC beta GAP activities[J].Cell Biol,2003,162(2):293-303.
[12]Shutter L,Tong KA,Holshouser BA,et al.Proton MRS in acute traumatic brain injury.Role for glutamate/glutamine and choline for outcome prediction[J].J Neurotrauma,2004,21(12):1693-1705.
[13]唐兆华,廖正步,石全红,等.p38信号通路对大鼠脑创伤后MMP-9的表达及脑水肿形成的影响[J].南方医科大学学报,2012,32(7):928-931.
[14]KI YW,Park JH,Lee JE,et al.JNK and p38 MAPK regulate oxidative stress and the inflammatory response in chlorpyrifos-induced apoptosis[J].Toxicol Lett,2013,218(3):235-245.
[15]Chaparro-Huerta V,Flores SotoT ME,Gudno Cabrera G,et al. Role of p38 MAPK and pro-inflammatory cytokines expression in glutamate induced neuronal death of neonatal rats[J].Devl Neurosci,2008,26(5):487-495.
[16]Xiao B,Tu JC,Worley PF,et al.Homer:a link between neural activity and glutamate receptor function[J].Curr opin Neurobiol,2000,l0(3):370-374.
[17]Bottai D,Guzowski JF,Schwarz MK,et al.Synaptic activity induced conversion or intronic to exonic sequence in Homer1 immediate early gene expression[J].J Neurosci,2002,22(1):167-175.
(编辑王又冬)
Relationship between Homer1a Expression and p38MAPKPhosphorylation in Hippocampusafter Diffuse Brain Injury in Rats
LIJian-min1,MA Rong-li2,ZHAOYa-ning1,DOUNa1,CHENChang-xiang1,LIShu-xing1,ZHANGPan1
(1.DepartmentofNeurosurgery,Affiliated HospitalofHebeiUnited University,Tangshan 063000,China;2.HebeiProvince Paraplegic Elderly Nursing Home Wards,Tangshan 063000,China)
ObjectiveTo investigate the relationship between Homer1a and p38MAPK phosphorylation in hippocampus after severe diffuse brain injury in rats.Methods149 male Sprague-Dawley rats were divided into three groups:control group,mild DBI group and severe DBI group.DBI rat model was established according to the description of Marmarou′s diffused brain injury.The histopathologic changes of hippocampus were observed by light and electron microscope.The expressions of Homer1a and phosphorylated p38MAPK were observed by immunohistochemistry and Western blot.ResultsThe rate ofdeath rats in severe DBIgroup(49.3%)was highersignificantly than thatin mild DBIgroup(22.2%)(P<0.05). The damaged degree of ultrastructure including organelle,axonal and capillary in mild DBI group was higher significantly than that in severe DBI group under the electron microscope.The expressions of Homer1a and phosphorylated p38MAPK increased at each time points in the two DBI groups when compared with control group(P<0.05);Homer1a reached the peak at 24 h and decreased at 48 h and 72 h in mild DBI group and it reached the peak at 6 h and continued to 24 h and decreased at 48 h and 72 h in severe DBI group.Phosphorylated p38MAPK reached the peak at 24 h and decreased at 48 h and 72 h in mild DBI group and it also reached the peak at 24 h in severe DBI group.The expression of Homer1a in severe DBIgroup was higherthan thatin mild DBIgroup at1 h,6 h and 24 h,while lowerat48 h and 72 h(P<0.05).The expression ofphosphorylated p38MAPK was higher at each time points in severe DBI group than that in mild DBI group(P<0.05).ConclusionThe dynamic expression of Homer1a is related to p38MAPK phosphorylation in hippocampusafterdiffuse brain injury in rats.
diffuse brain injury;Homer1a;mitogen-activated protein kinases
R743
A
0258-4646(2014)03-0235-05
河北省科技厅支撑课题(20276102D);河北省教育厅重点课题(ZD2010106)
李建民(1962-),男,教授,博士.
赵雅宁,E-mail:zyning789@126.com
2013-08-28
网络出版时间:
