姜黄素对人肝癌细胞BEL⁃7402中环氧合酶⁃2表达影响的研究
2014-03-21李帅帅孙军
李帅帅,孙军
(1.辽宁医学院锦州市中心医院消化内科,辽宁锦州121001;2.锦州市中心医院消化内科,辽宁锦州121002)
姜黄素对人肝癌细胞BEL⁃7402中环氧合酶⁃2表达影响的研究
李帅帅1,孙军2
(1.辽宁医学院锦州市中心医院消化内科,辽宁锦州121001;2.锦州市中心医院消化内科,辽宁锦州121002)
目的探讨姜黄素对人肝癌细胞BEL-7402中环氧合酶2(COX-2)表达的影响。方法以不同浓度的姜黄素处理人肝癌细胞BEL-7402,CCK-8法分析细胞增殖,采用RT-PCR和Western blot方法检测人肝癌细胞BEL-7402中COX-2的表达。以不同浓度的NS-398+10 μmol/L姜黄素处理人肝癌细胞BEL-7402,对照组单独加入10 μmol/L姜黄素,RT-PCR和Western blot检测VEGFmRNA、蛋白和HIF-1αmRNA、蛋白表达。结果不同剂量的姜黄素对肝癌细胞增殖率的影响与对照组相比差异有统计学意义(P<0.01);随着姜黄素浓度的增加,COX-2mRNA表达逐渐降低,与对照组相比差异有统计学意义(P<0.01);随着姜黄素浓度的增加,COX-2蛋白表达逐渐降低,与对照组相比差异有统计学意义(P<0.01);NS-398 100 μmol/L组+姜黄素10 μmol/ L、NS-398 200 μmol/L组+姜黄素10 μmol/L组VEGFmRNA、VEGF蛋白、HIF-1α蛋白表达均降低,与姜黄素10 μmol/L组相比差异有统计学意义(P<0.01),而NS-398 100 μmol/L组+姜黄素10 μmol/L、NS-398 200 μmol/L组+姜黄素10 μmol/L组的HIF-1α mRNA表达与姜黄素10 μmol/L组相比差异无统计学意义(P>0.05)。结论姜黄素抑制人肝癌细胞BEL-7402中COX-2mRNA和蛋白的表达;姜黄素在人肝癌细胞BEL-7402中可能通过COX-2/PGE2/HIF-1α/VEGF途径抑制肿瘤血管生成。
姜黄素;肝肿瘤;环氧合酶2;血管内皮生长因子;缺氧诱导因子-1α
我国是世界上原发性肝癌发病率最高的国家之一,且大多数病例在确诊时肝功能储备已很差,化疗药强烈的细胞毒性作用又进一步损害正常肝细胞,使肝脏功能进一步恶化。因此,对正常肝组织损伤小,抑癌作用强的抗癌药物的发现和应用显得尤为重要。姜黄素,姜科姜黄属的多年生草本植物,美国国立肿瘤所已将其列为第三代癌化学预防药,具有靶向作用强,不良反应小等优点,同时具有明确的抑癌作用,这种作用是通过抑制肿瘤血管的新生来实现的[1]。目前认为,在肿瘤血管的生成过程中,环氧合酶2(cyclooxygenase-2,COX-2),一种前列腺素(prostaglandin,PG)E2合成限速酶,在肝癌中呈高表达状态[2],它能够辅助产生PGE2从而刺激肿瘤的生长和血管新生。Bu等[3]针对原发性肝癌与COX-2之间的关联做了Meta分析,结果显示两者之间存在极显著的关联性,而COX-2是血管生成的启动子,如果能阻滞其启动,就能有效控制肿瘤,因此,探讨姜黄素对肝癌细胞中COX-2表达的影响,使其抗肝癌血管形成机制逐渐明确,成为新的研究热点。实验采用RT-PCR及Western blot方法,观察姜黄素对人肝癌细胞株BEL-7402中COX-2表达的影响机制,从分子水平探讨姜黄素抗肿瘤血管形成的机制。
1 材料与方法
1.1 主要试剂
姜黄素为Sigma公司产品,溶于少量DMSO中,加双蒸水配制成500 μmol/L的水溶液,用培养液稀释成所需浓度,DMSO终浓度小于0.1%。特异性的COX-2抑制剂NS-398为碧云天公司产品,溶于少量DMSO中,配制成1 000 μmol/L的溶液,用培养液稀释成所需浓度,DMSO终浓度小于0.1%。RT-PCR试剂盒为碧波公司产品,引物由大连宝生物工程有限公司合成。兔抗人COX-2、VEGF、HIF-1α单克隆抗体(IgG),GAPDH单抗GAPDH单抗为Enogene公司产品。
1.2 方法
1.2.1 细胞培养及处理:人肝癌细胞BEL-7402由江阴康众康民生物医药技术有限公司提供。肝癌细胞BEL-7402中加入含10%胎牛血清的RPMI1640培养基,内含100 U/L青、链霉素,在37℃、5%CO2、正常氧浓度饱和湿度的培养箱中培养,常规胰蛋白酶消化法传代细胞,取对数生长期细胞用于实验。细胞进入对数生长期后,将细胞按2×105/mL密度接种于6孔板,24 h细胞贴壁后,分别加入不同浓度的姜黄素,使姜黄素的终浓度分别为0、2.5、5、10、15、20 μmol/L,置37℃、5%CO2饱和湿度培养箱中培养6 h,收集细胞。
1.2.2 CCK-8法检测细胞增殖:将人肝癌细胞BEL-7402按1×104/mL密度,每孔100 μL接种于96孔板,37℃、5%CO2孵育24 h,然后加入不同浓度姜黄素,培养箱中培养6 h后,每孔加入10 μL CCK-8溶液,将培养板在培养箱中孵育2 h,酶标仪检测各孔在450 nm处的吸光度值(A)。
1.2.3 Western blot法:每孔细胞加入200 μL细胞裂解液提取蛋白,考马斯亮蓝法检测蛋白浓度,调整蛋白浓度为一致。制备10%SDS-page凝胶,每孔加入蛋白样品20 μg电泳分离蛋白,转印至PVDF膜后,5%脱脂奶粉TBS缓冲液封闭,加入兔抗人COX-2、VEGF、HIF-1α单克隆抗体、兔抗人VEGF单克隆抗体、兔抗人HIF-1α单克隆抗体,4℃过夜,洗膜30 min,加入辣根过氧化物酶标记的羊抗兔二抗孵育,在新鲜配制的NBT/BCIP底物溶液中显色20 min,流水冲洗终止显色,照相。内参采用GAPDH。采用Fluorch-em 2.01软件分析蛋白条带积分A值(IDV)。以目的条带与内参条带的比值代表目的蛋白的表达水平。试验重复3次。
1.2.4 RT-PCR提取细胞总RNA:加入Trizol提取细胞总RNA,紫外分光光度计测定RNA浓度和纯度,OD260/OD280=1.6~2.0。取5 μg总RNA进行逆转录反应合成cDNA。2 μL cDNA用于PCR扩增。COX-2:上游引物5′-TCAAATGAGATTGTGGGAAAATTG-3′,下游引物5′-TCTAGTAGAGACGGACTCATAGAA-3′,扩增长度为310bp[2];VEGF:上游引物5′-GGGCTGCTGCAATGACGA-3′,下游引物5′-GTTTAACTCAAGCTGCCTCGC-3′,扩增长度为360 bp;HIF-1α:上游引物5′-CAAAACACACAGCGAAG C-3′,下游引物5′-TCAACCCAGACATATCCACC-3′,扩增长度为473 bp;β-actin:上游引物5′-CAGAGCAAGAGAGGCATCCT-3′,下游引物5′-GCATAGCACAGCCTGGATAG-3′,扩增长度250 bp。PCR反应:COX-2:94℃预变性3 min,94℃变性30 s,54℃退火30 s,72℃延伸1 min,30个循环,72℃最终延伸10 min。VEGF:94℃预变性3 min,94℃变性30 s,60℃退火30 s,72℃延伸1 min,30个循环,72℃最终延伸10 min;HIF-1α:94℃预变性3 min,94℃变性30 s,58℃退火30 s,72℃延伸1 min,30个循环,72℃最终延伸10 min;β-actin:94℃预变性3 min,94℃变性30 s,52℃退火30 s,72℃延伸1 min,30个循环,72℃最终延伸10 min。继之1.5%琼脂糖凝胶电泳观察,应用Fluorchem 2.01软件进行分析,PCR产物cDNA条带与内参条带的吸光度值比值(A/A0)作为基因的相对表达量。试验重复3次。
1.3 统计学分析
统计学处理用SPSS17.0软件完成,Western blot和RT-PCR结果为计量资料,数据以x±s表示,采用方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 细胞增殖分析
不同剂量的姜黄素(2.5、5、10、15、20 μmol/L)处理的人肝癌细胞BEL-7402,细胞增殖率分别为(6.23±0.74)%、(92.81±0.36)%、(89.38±0.36)%、(85.13±0.51)%、(79.32±0.49)%,与对照组(姜黄素0 μmol/L)(98.94±0.57)%相比降低,差异有统计学意义(P<0.01)。
2.2 不同剂量的姜黄素对人肝癌细胞BEL-7402中COX-2mRNA的影响
2.5 、5、10、15、20 μmol/L姜黄素处理BEL-7402 6 h后,COX-2mRNA表达与对照组(2.40±0.05)相比分别降低至1.57±0.02、0.97±0.03、0.75±0.02、0.41± 0.03、0.17±0.03,差异有统计学意义(P<0.01),RTPCR结果见图1。
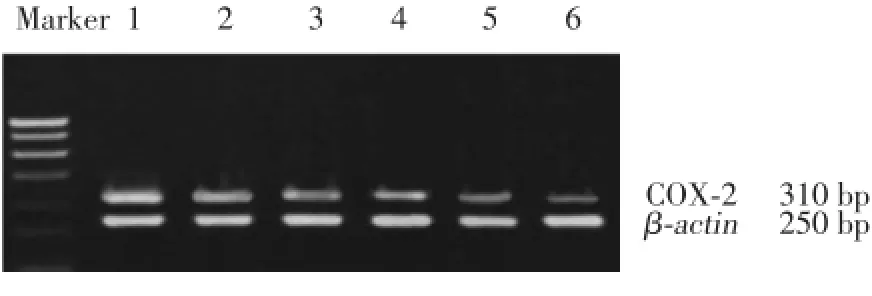
图1 PCR检测姜黄素对人肝癌细胞中COX⁃2mRNA的影响Fig.1 Effects of curcumin on mRNA expression of COX⁃2in human hepatocellular carcinoma cells by RT⁃PCR
2.3 不同剂量的姜黄素对人肝癌细胞BEL-7402中COX-2蛋白的影响
2.5 、5、10、15、20 μmol/L姜黄素处理BEL-7402 6 h后,COX-2蛋白表达与对照组(3.30±0.14)相比分别降低至2.40±0.06、1.60±0.07、1.03±0.04、0.70± 0.06、0.33±0.03,差异有统计学意义(P<0.01),Western blot结果见图2。
2.4 COX-2在姜黄素对肝癌细胞中VEGF、HIF-1α表达的作用
2.4.1 COX-2在姜黄素对肝癌细胞中VEGFmRNA表达作用:NS-398 100 μmol/L组+姜黄素10 μmol/L、NS-398 200 μmol/L组+姜黄素10 μmol/L组VEGFmRNA表达与姜黄素10 μmol/L组(0.82±0.02)相比分别降低至0.50±0.01、0.31±0.02,差异有统计学意义(P<0.01),RT-PCR结果见图3。
2.4.2 COX-2在姜黄素对肝癌细胞中VEGF蛋白表达的作用:NS-398 100 μmol/L组+姜黄素10 μmol/L、 NS-398 200 μmol/L组+姜黄素10 μmol/L组VEGF蛋白表达与姜黄素10 μmol/L组(0.85±0.03)相比分别降低至0.61±0.05、0.32±0.01,差异有统计学意义(P<0.01),Western blot结果见图4。

图2 WB检测姜黄素对人肝癌细胞中COX⁃2蛋白的影响Fig.2 Effects of curcumin on protein expression of COX⁃2 in human hepatocellular carcinoma cells by WB

图3 RT⁃PCR检测VEGF mRNA表达Fig.3 The expression of VEGF mRNA used RT⁃PCR
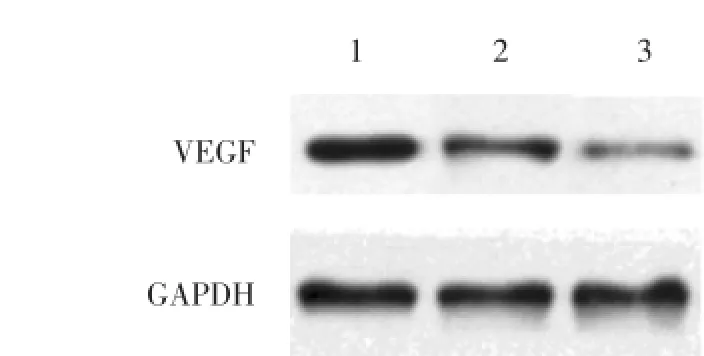
图4 Western blot检测VEGF蛋白表达Fig.4 The protein expression of VEGF detected by Western blot
2.4.3 COX-2在姜黄素对肝癌细胞中HIF-1αmRNA表达的作用:NS-398 100 μmol/L组+姜黄素10 μmol/L、NS-398 200 μmol/L组+姜黄素10 μmol/L组的HIF-1αmRNA表达分别为1.48±0.01、1.46± 0.03,与姜黄素10 μmol/L组(1.49±0.03)相比差异无统计学意义(P>0.05),RT-PCR结果见图5。
2.4.4 COX-2在姜黄素对肝癌细胞中HIF-1α蛋白表达中的作用:NS-398 100 μmol/L组+姜黄素10 μmol/L、NS-398 200 μmol/L组+姜黄素10 μmol/L组HIF-1α蛋白表达与姜黄素10 μmol/L组(1.03±0.03)相比分别降低至0.63±0.01、0.29±0.01,差异有统计学意义(P<0.01),Western blot结果见图6。

图5 RT⁃PCR检测HIF⁃1αmRNA表达Fig.5 The expression of HIF⁃1αmRNA by RT⁃PCR analysis

图6 RT⁃PCR检测HIF⁃1α蛋白表达Fig.6 The expression of HIF⁃1α protein determined by Western blot
3 讨论
姜黄是姜科姜黄属的多年生草本植物,姜黄素是从姜黄根茎中提取的一种酚性色素,是咖喱、芥末中的主要黄色色素。姜黄素具有明确的抗肿瘤作用,它可以通过调节细胞周期中直接和间接结合的分子靶点来达到抑制肿瘤血管生成的作用[4,5],而对于正常细胞和组织是安全的。姜黄素已经被证明能够影响各种各样的与致癌作用相关的细胞因子,其中就包括COX-2[6],COX-2是花生四烯酸生物合成前列腺素的限速酶,在大多数正常组织不表达,但在多种癌组织中,各种肿瘤促进因素的作用下呈诱导性表达,在肿瘤发病中起重要作用。既往研究表明,COX-2可能通过促进前列腺素的合成、促进血管形成、增加肿瘤细胞的侵袭力等参与肿瘤的形成,其中促进血管生成是其促癌作用的关键因素。依赖于新生血管的支持作用,肿瘤不断地吸取营养而无限制地生长,同时又可通过不健全的血管进入血液循环,直至远处扩散和转移[7,8]。
在肿瘤血管生成的微环境中,缺氧诱导因子1α(hypoxia-inducible factor 1α,HIF-1α)和血管内皮生长因子(vascular endothelial growth factor,VEGF)是两个不可或缺的关键因子,HIF-1在缺氧诱导的哺乳动物细胞中广泛表达,为缺氧应答的全局性调控因子,在存在COX-2表达的细胞中,特异的COX-2抑制剂NS-398通过抑制一种COX-2依赖的方式抑制HIF-1α的表达和功能,达到抑制缺氧诱导的血管生成的目的,而在无COX-2表达的细胞,NS-398对HIF-1α的作用就消失[9,10],即COX-2/PGE2可以调控HIF-1α的表达。在肿瘤生长的微环境中,HIF-1α作为VEGF的调控因子而存在[11,12]。目前研究认为,在肿瘤组织的缺氧状态下,高表达的HIF-1α促进VEGF的生成。VEGF作为一个最主要的细胞因子,在肿瘤诱导产生新生血管的过程中,特别是在肿瘤体积快速增长阶段,VEGF的合成呈数倍增加,肿瘤细胞促血管生成能力大幅提高,与此同时,结构和功能异常的血管开始出现并且逐渐增多,使癌细胞更容易通过异常的血管发生远处转移[13~15]。综上所述,COX-2、HIF-1α和VEGF在肿瘤新生血管的形成过程中均有不同程度的作用,他们之间存在着必然的联系,并且在血管新生过程中很可能存在COX-2/ PGE2/HIF-1α/VEGF这样一条途径。
该研究表明,姜黄素可能通过抑制人肝癌细胞BEL-7402中COX-2mRNA和蛋白的表达来抑制肝细胞肿瘤的生长、血管生成和转移,通过切断肿瘤组织的营养来源影响肿瘤的转归。同时,在肝细胞肿瘤中,特异性地抑制COX-2的表达,VEGF和HIF-1α的表达也随之降低,表现出明显的协同作用,提示姜黄素可能通过COX-2/PGE2/HIF-1α/VEGF途径抑制肿瘤的血管新生,而且对HIF-1α的这种抑制作用是通过转录后机制来实现的。
近年来,通过抑制血管生成来达到抗肿瘤目的已成为肿瘤治疗的新热点,姜黄素作为第三代癌化学预防药,具有不良反应小,靶向作用强等优点,具有良好的开发价值和应用前景,值得我们进一步研究。
[1]金苹,谭晓斌,刘文博,等.中药的癌化学预防靶点与研究思路[J].中华中医药杂志,2012,27(12):3015-3018.
[2]梁熹,胡雅楠,和水祥,等.COX-2与C/EBP β在人肝细胞肝癌中的表达及其临床意义[J].世界华人消化杂志,2010,18(28):3040-3044.
[3]Bu X,Zhao C.The association between cyclooxygenase-2 1195 G/A polymorphism and hepatocellular carcinoma:evidence from a metaanalysis[J].Tumour Biol,2013,34(3):1479-1484.
[4]Shehzad A,Lee J,Lee YS.Curcumin in various cancers[J].Biofac-tors,2013,39(1):56-68.
[5]Stasinopoulos I,Shah T,Penet MF,et al.Cox-2 in cancer:Gordian knot or Achilles heel?[J].Front Pharmacol,2013,4(34):1-7.
[6]Park J,Conteas CN.Anti-carcinogenic properties of curcumin on colorectal cancer[J].World J Gastrointe Oncol,2010,2(4):169-176.
[7]Hanahan D,Weinberg RA.Hallmarks of cancer:The next generation[J].Cell,2011,144(5):646-674.
[8]范昊宁,佟丽,范钦.姜黄素对肿瘤的抑制和放射增敏作用研究进展[J].中国实验方剂学杂志,2013,19(3):333-335.
[9]Kaidi A,Qualtrough D,Williams AC,et al.Direct transcriptional upregulation of cyclooxygenase-2 by hypoxia-inducible factor(HIF)-1 promotes colorectal tumor cell survival and enhances HIF-1 transcriptional activity during hypoxia[J].Cancer Res,2006,66(13):6683-6691.
[10]Lee JJ,Natsuizaka M,Ohashi S,et al.Hypoxia activates the cyclooxygenase-2-prostaglandin E synthase axis[J].Carcinogenesis, 2010,31(3):427-434.
[11]Yu ZY,Bai YN,Luo LX.Expression of microRNA-150 targeting vascular endothelial growth factor-A is downregulated under hypoxia during liver regeneration[J].Mol Med Rep,2013,8(1):287-293.
[12]郭科军,薛晖,张颐.HIF-1α和VEGF在宫颈癌癌变过程中的表达及意义[J].中国医科大学学报,2008,37(2):237-239.
[13]Sasano H,Suzuki T.Pathological evaluation of angiogenesis in human tumor[J].Biomed Pharmacother,2005,59(2):334-336.
[14]Pradeep CR,Sunila ES,Kuttan G.Expression of vascular endothelial growth factor(VEGF)and VEGF receptors in tumor angiogenesis and mailgnancies[J].Integr Cancer Ther,2005,4(4):315-321.
[15]Gupta SC,Kismali G,Aggarwal BB.Curcumin,a component of turmeric:from farm to pharmacy[J].Biofactors,2013,39(1):2-13.
(编辑裘孝琦)
EffectsofCurcumin on the Expression ofCyclooxygenase-2 in Human Hepatocellular Carcinoma BEL-7402 Cells
LIShuai-shuai1,SUNJun2
(1.Department of Digestive Disease,The Five Affiliated Hospital,Liaoning Medical University,Jinzhou 121001,China;2.Department of Digestive Disease,Jinzhou CentralHospital,Jinzhou 121002,China)
ObjectiveTo investigate the effects of curcumin on the expression of COX-2 in human hepatocellular carcinoma BEL-7402 cells.MethodsHuman hepatocellular carcinoma BEL-7402 cells were treated with various concentrations of curcumin.The cell proliferation was determined by CCK-8 method.The expressions of COX-2 in human hepatocellular carcinoma BEL-7402 cells were detected by RT-PCR and Western blot.Human hepatocellular carcinoma BEL-7402 cells were treatment with different concentrations of NS-398 plus 10 μmol/L of curcumin or alone treated with 10 μmol/L of curcumin in control group,the mRNA and protein expression of VEGF and HIF-1α were checked by RT-PCR and Western blot.ResultsThe cell proliferation rate were significantly different between control and different concentrations of curcumin(P<0.01).Curcumin can down-regulate the expression ofCOX-2mRNA in a concentration dependent manner,and the differences were significant compared with the control(P<0.01);Curcumin can down-regulate the expression ofCOX-2 protein with the increase ofconcentration gradually and the differences were significant compared with the control(P<0.01).The expressions ofVEGFmRNA,VEGF protein,HIF-1α protein in 100 μmol/L of NS-398 plus 10 μmol/L of curcumin group,200 μmol/L of NS-398 plus 10 μmol/L of curcumin group were respectively reduced,and the differences were significant compared with the control(P<0.01);there was no significant difference of theHIF-1αmRNA expressions in 100 μmol/L of NS-398 plus 10 μmol/L of curcumin group,200 μmol/L of NS-398 plus 10 μmol/L of curcumin group comparing with the control(P>0.05).Conclu⁃sionThere is an inhibitory effectofcurcumin on the mRNA and protein expression ofCOX-2 in human hepatocellularcarcinoma BEL-7402 cells;Curcumin inhibits tumorangiogenesis in human hepatocellularcarcinoma BEL-7402 cells may through the pathway ofCOX-2/PGE2/HIF-1α/VEGF.
curcumin;liver cancer;cyclooxygenase-2;vascular endothelial growth factor;hypoxia-inducible factor-1α
RRRR
A
0258-4646(2014)03-0222-04
辽宁省自然科学基金(20112077)
李帅帅(1987-),女,住院医师,硕士研究生. E-mail:381724012@qq.com
2013-11-24
网络出版时间:
