帕金森病患者血清RANTES水平及外周血CD4+CD45RO+T淋巴细胞比例测定及意义
2014-03-21朱瑜龄牛平苏岑
朱瑜龄,牛平,苏岑
(沈阳军区总医院神经内科,沈阳110016)
帕金森病患者血清RANTES水平及外周血CD4+CD45RO+T淋巴细胞比例测定及意义
朱瑜龄,牛平,苏岑
(沈阳军区总医院神经内科,沈阳110016)
目的检测帕金森病(PD)患者血清RANTES水平及外周血CD4+CD45RO+T淋巴细胞比例,探讨其变化原因、相关影响因素及其在PD免疫异常发病机制中的作用。方法采用生物素双抗体夹心酶联免疫吸附法对43例PD患者(PD组)、33例健康人(正常对照组)血清调节活化正常T细胞表达与分泌的趋化因子(RANTES)水平进行检测,同时采用流式细胞术检测外周血CD4+CD45RO+T淋巴细胞比例。采用PD统一评分量表(UPDRSⅢ)对PD患者进行病情评估。依据性别、年龄、病程、治疗状况对PD患者进行分组比较。结果与对照组比较,PD组血清RANTES水平、外周血CD4+CD45RO+T淋巴细胞比例均明显升高(P均<0.01),PD组血清RANTES水平与外周血CD4+CD45RO+T淋巴细胞比例呈正相关(r=0.53,P<0.01),与UPDRS评分亦呈正相关(r=0.74,P<0.001)。依据性别、年龄、病程、治疗状况对PD患者分组比较,各组间均无统计学差异(P均>0.05)。结论与正常对照比较,PD患者血清RANTES水平及外周血CD4+CD45RO+T淋巴细胞比例均明显增高,2者显著正相关。血清RANTES水平与PD患者UPDRS评分正相关。提示活化小胶质细胞及CD4+T淋巴细胞介导的特异性免疫反应在PD的发病、进展过程中起重要作用。
帕金森病;调节活化正常T细胞表达与分泌因子的趋化;CD4+CD45RO+T淋巴细胞
近年来,研究者在帕金森病(Parkinson’s disease,PD)动物模型及PD患者尸检中已观察到了黑质内存在T淋巴细胞浸润的证据[1~3]。PD患者外周血中淋巴细胞亚群比例失调也屡见报道[4,5]。活化的小胶质细胞通过分泌一系列前炎性因子及趋化因子,一方面直接作用于外周T淋巴细胞,导致外周免疫失调;另一方面诱导外周T淋巴细胞进入中枢神经系统(central nerve system,CNS),直接或通过激活小胶质细胞间接造成多巴胺(dopamine,DA)能神经元损伤。本研究通过检测PD患者和正常健康者血清RANTES水平及外周血CD4+CD45RO+T淋巴细胞(效应/记忆性T淋巴细胞)比例,探讨其变化原因、相关影响因素及其在PD免疫异常发病机制中的作用。
1 材料与方法
1.1 研究对象及分组
选自2010年10月至2011年5月我院门诊就诊的原发性PD患者43例(PD组),诊断符合中华医学会神经病学分会制定的PD诊断标准[6]。男27例,女16例,年龄45~85岁,平均(64.25±10.23)岁,病程0.5~12年,平均(3.48±3.39)年。排除近期感染[近期发烧和(或)外周血白细胞计数超过正常]、肿瘤、免疫性疾病、长期慢性感染、2个月内应用抗生素、应用非甾体类抗炎药及免疫抑制剂者。病情评估采用PD统一评分量表第3部分(united Parkinson′s disease rate scale partⅢ,UPDRSⅢ)评分[7]。正常对照组33例,为同期健康体检者,男18例,女15例,年龄45~76岁,平均(62.8±10.06)岁,2组性别及年龄匹配。PD组按年龄、性别、病程及不同治疗情况再进行分组。
1.2 方法
肘正中静脉采血,分装A、B两管各2 mL。A管乙二胺四乙酸(EDTA)抗凝,6 h内完成流式细胞术,检测外周血CD4+CD45RO+T淋巴细胞比例(抗CD4-FITC单克隆抗体、抗CD45RO-PE单克隆抗体,美国Biolegend公司)。B管自然凝固,1 h内离心,分离血清,分装后保存于-80℃冰箱内。采用生物素双抗体夹心酶联免疫吸附(enzyme-linked immunolsorbent assay,ELISA)定量测定血清调节活化正常T细胞表达与分泌的趋化因子(regulated upon activation of normal T cell expressed and secreted,RANTES)水平(RANTES试剂盒,上海活乐生物科技有限公司)。
1.3 统计学处理
采用SPSS 17.0统计软件包对数据进行统计学分析。计量资料采用表示,组间差异比较采用单因素方差分析(ANOVA)或t检验,计量资料两组间相关性采用Pearson直线相关分析,P<0.05为差异具有统计学意义。
2 结果
2.1 PD组和对照组血清RANTES水平、外周血CD4+CD45RO+T淋巴细胞比例比较
结果显示,PD组、血清RANTES水平及CD4+CD45RO+T淋巴细胞比例明显高于对照组,差异具有统计学意义(P<0.01),见表1。
表1 血清RANTES水平及外周血CD4+CD45RO+T淋巴细胞比例比较Tab.1 Results of RANTES levels and the percentage of CD4+CD45RO+T cells

表1 血清RANTES水平及外周血CD4+CD45RO+T淋巴细胞比例比较Tab.1 Results of RANTES levels and the percentage of CD4+CD45RO+T cells
1)P<0.01 compared with control group.
2.2 不同性别、年龄、病程及治疗状况PD患者血清RANTES水平、外周血CD4+CD45RO+T淋巴细胞比例比较
PD组按性别、年龄、病程、治疗情况(未用药、单药、联合用药)进行分组,比较血清RANTES水平、外周血CD4+CD45RO+T淋巴细胞比例,结果显示,组间均无统计学差异(P均>0.05)。PD各组血清RANTES水平、外周血CD4+CD45RO+T淋巴细胞比例与对照组比较均增高,差异具有统计学意义(P<0.01),见表2。
2.3 PD患者血清RANTES水平与病情相关性
采用UPDRS评分对PD患者进行病情评估,评分越高,病情越重。将PD组血清RANTES水平与UPDRS评分两组数据绘制成散点图,显示二者呈同向变化,进行Pearson直线相关分析,结果显示:PD组血清RANTES水平与UPDRS评分呈正相关(r= 0.74,P<0.01,图1),而CD4+CD45RO+T淋巴细胞比例与UPDRS评分无相关性(r=0.13,P>0.05)。
2.4 血清RANTES水平与外周血CD4+CD45RO+T淋巴细胞比例相关性分析
表2 不同年龄、性别、病程及治疗状况PD患者外周血RANTES水平、CD4+CD45RO+T淋巴细胞比例比较Tab.2 Results of PD group RANTES levels and the percentage of CD4+CD45RO+T cells in several subgroups according to the different gender,age,duration and treatment status
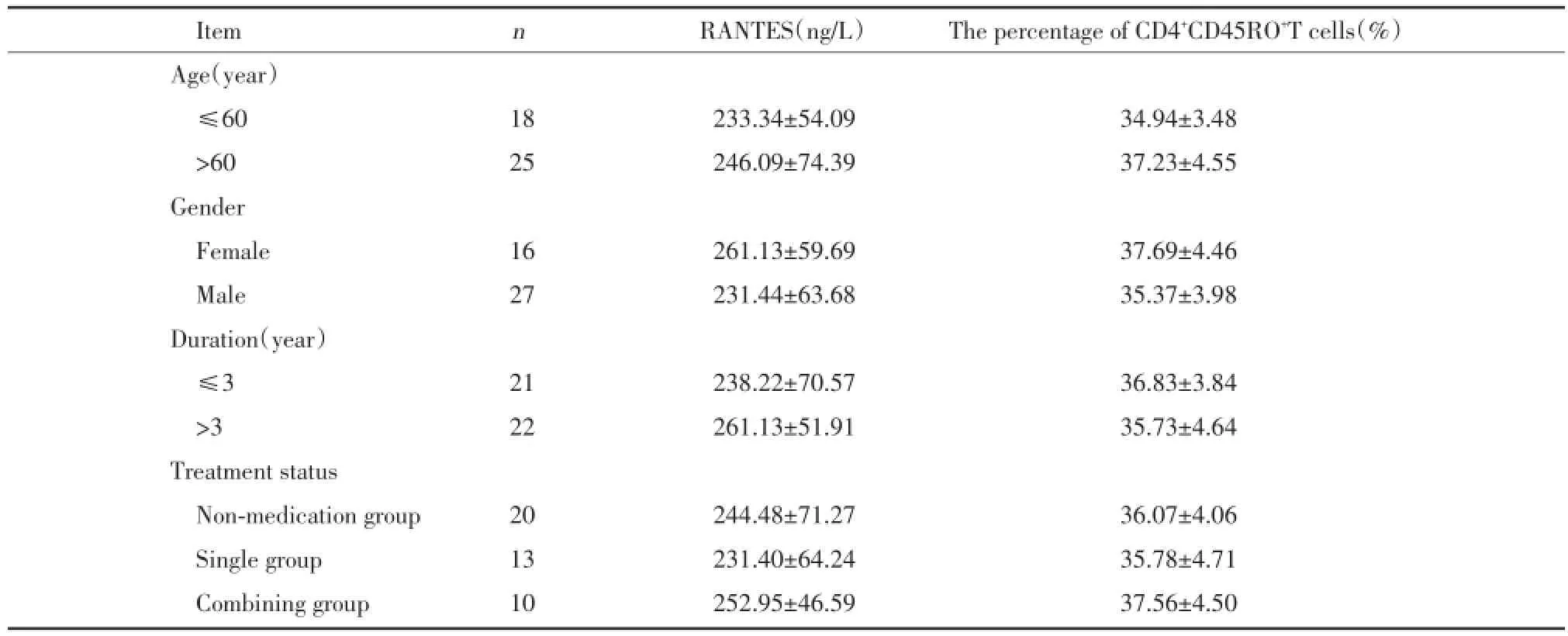
表2 不同年龄、性别、病程及治疗状况PD患者外周血RANTES水平、CD4+CD45RO+T淋巴细胞比例比较Tab.2 Results of PD group RANTES levels and the percentage of CD4+CD45RO+T cells in several subgroups according to the different gender,age,duration and treatment status
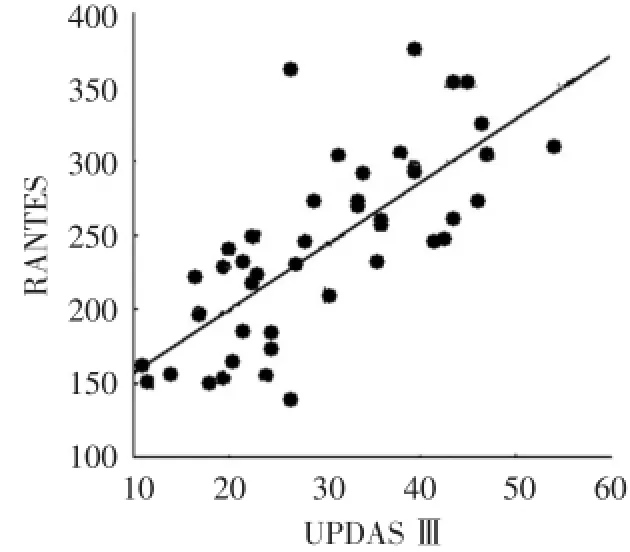
图1 PD组血清RANTES水平与UPDRS评分相关分析结果Fig.1 Results of pearson correlations between RANTES levels and UPDRS III
PD组血清RANTES水平与外周血CD4+CD45RO+T细胞比例进行Pearson相关性分析,结果表明:血清RANTES水平与外周血CD4+CD45RO+T淋巴细胞比例呈正相关(r=0.53,P<0.01),见图2。
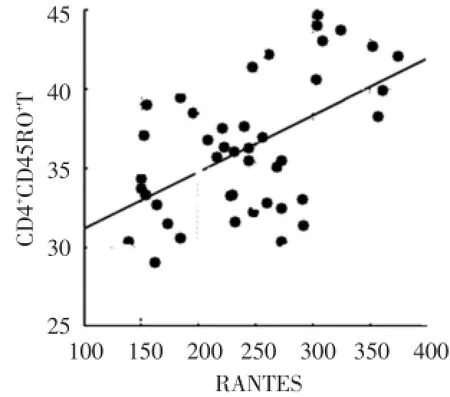
图2 血清RANTES水平与外周血CD4+CD45RO+T淋巴细胞相关分析结果Fig.2 Results of pearson correlations between RANTES levels and the percentage of CD4+CD45RO+T cells
3 讨论
RANTES为CC类趋化蛋白,其来源广泛。外周单核巨噬细胞、NK细胞等多种细胞均可分泌RANTES,其对外周T淋巴细胞、单核巨噬细胞有强烈的趋化作用。活化的小胶质细胞为脑内RANTES分泌的主要来源,因此,脑内RANTES水平在一定程度上反应了CNS以小胶质细胞为主的神经炎性反应的严重程度。近年研究表明血清RANTES水平和其他趋化因子水平升高不仅见于PD,也见于多发性硬化、阿尔兹海默病及脑缺血等神经系统疾病[8,9]。这些趋化因子主要通过强大的招募淋巴细胞和单核巨噬细胞进入CNS炎性反应区域的作用,参与上述疾病的发病过程,这在一定程度上反映了神经系统疾病共同的发病机制。本研究检测了PD患者及正常对照组血清RANTES水平,结果表明PD组与对照组比较,血清RANTES水平显著增高(P<0.01),这与Rentzos等[10]的研究结果相同。进一步与PD患者临床表现客观测评(UPDRS评分)进行相关性分析,结果表明PD患者血清RANTES水平与病情轻重程度呈正相关。其机制可能是由于PD患者神经炎性反应的持续进展,血脑屏障破坏、通透性增加,脑内RANTES透过受损的血脑屏障漏至外周,导致外周循环血中RANTES水平逐步增高,后者作用于外周T淋巴细胞、单核细胞等发挥生物学效应。因此,PD患者外周血RANTES水平升高与脑内小胶质细胞活化有关,间接反应小胶质细胞的活化程度。
本研究同时应用流式细胞术检测了PD患者及正常对照组外周血CD4+CD45RO+T淋巴细胞比例,结果表明PD组显著高于正常对照组,提示PD患者外周血中存在着T淋巴细胞免疫异常。许多学者[11,12]已观察到PD患者脑内存在T淋巴细胞浸润、黑质DA能神经元损伤以及外周血淋巴细胞数目及比例失调的证据,但免疫异常的机制目前尚不明确。PD动物模型[13]研究也发现,与存在严重免疫缺陷的小鼠比较,MPTP对免疫功能正常小鼠所致的DA能神经元毒性作用更强,其机制认为是免疫缺陷小鼠由于缺乏T淋巴细胞,能抵抗MPTP所造成的黑质纹状体DA能神经元变性,提示T淋巴细胞在PD发病机制中可能发挥着重要作用。实验研究[14]表明两种不同免疫缺陷类型的小鼠由于缺乏成熟T淋巴细胞,使MPTP导致的DA能神经元丢失减少。与体内缺乏CD8+T淋巴细胞的小鼠比较,缺乏CD4+T淋巴细胞的小鼠,MPTP导致的DA能神经元丢失显著减少,即起到了相对的神经保护作用。而缺乏CD8+T淋巴细胞的小鼠DA能神经元丢失无显著改变,说明CD4+T淋巴细胞对DA能神经元有神经毒性作用。本研究结果表明PD患者外周血CD4+CD45RO+T淋巴细胞比例显著增加,并与PD患者血清RANTES水平呈正相关,我们推测这可能与小胶质细胞活化程度有关。活化的小胶质细胞通过分泌一系列前炎性因子促使外周T淋巴细胞向CD4+T淋巴细胞转化。小胶质细胞活化具有可塑性,分为经典的M1型和选择性激活的M2型活化小胶质细胞[15]。Mount等[16,17]研究表明脑内活化的小胶质细胞与外周T淋巴细胞之间存在积极的相互作用。经典的M1型增加分泌TNF-α、IL-1β等前炎性因子、RANTES等多种趋化因子,减少分泌神经保护因子,并促使T淋巴细胞增殖分化为CD4+Th1细胞。选择性激活的M2型活化小胶质细胞则增加IGF-1等神经保护因子释放、减少前炎性因子释放,有助炎性反应的消散,并促使T淋巴细胞增殖分化为CD4+Th2细胞。进入CNS的CD4+Th1细胞通过分泌IFN-γ,激活M1型小胶质细胞,促进DA能神经元丢失;相反,CD4+Th2细胞通过分泌IL-10,激活M2型小胶质细胞,对DA能神经元起保护作用。Sawada等[18]研究表明,在MPTP新生小鼠模型中活化的小胶质细胞对DA能神经元有潜在的神经营养作用,表现为酪氨酸羟化酶活性、DA和DOPAC水平及促炎性因子水平升高。而老年小鼠中其作用恰好相反,活化的小胶质细胞对DA能神经元表现为神经毒性作用。PD为好发于中老年人的神经变性疾病,随年龄增加,发病率增加。PD早期黑质区活化的小胶质细胞可能主要以M1型为主,或M1型和M2型小胶质细胞处于动态平衡状态,随着疾病不断进展,M1型小胶质细胞活化逐渐占据优势,后者通过分泌多种趋化因子,招募外周CD4+Th1淋巴细胞进入CNS,加剧神经炎性反应。
本研究中我们对PD患者外周血CD4+CD45RO+T淋巴细胞比例与血清RANTES水平进行相关性分析,结果表明二者呈正相关。RANTES可能通过CCR5依赖及IL-12依赖途径,促使血液中T淋巴细胞向CD4+Th1细胞类型分化。进一步将外周血CD4+CD45RO+T淋巴细胞比例与UPDRS评分进行相关性分析,结果表明二者无相关性。RANTES对T淋巴细胞有双重作用,即可使循环中的T淋巴细胞向CD4+Th1细胞类型分化,使其数目增加;又可与其表面CCR5受体结合,招募其进入CNS,致其在外周循环中数目下降。相比于CD4+Th2细胞,CD4+Th1细胞表面表达更多的RANTES受体CCR5和CCR1,这可能会促使RANTES倾向于选择性招募CD4+Th1细胞进入CNS。本研究中,我们还将PD患者按不同性别、年龄、病程及治疗状况进行分组,比较各组间血清RANTES水平及外周血CD4+CD45RO+T淋巴细胞比例,结果表明各组间均无统计学差异,提示其增高与性别、年龄、病程及治疗状况等因素无关,为疾病进展所致。
[1]Neher JJ,Nenikyte U,Brown GC,et al.Primary phagocytosis of neurons by inflamed microglia:potential roles in neurodegenerration[J].Front Pharmacol,2012,3(27):1-9.
[2]王聪杰,牛平,陈鑫,等.白藜芦醇对帕金森病大鼠黑质多巴胺能神经元损伤的保护作用[J].中国医科大学学报,2012,41(1):28-30,41.
[3]Benner EJ,Banerjee R,Reynolds AD,et al.Nitrated alpha-synuclein immunity accelerates degeneration of nigral dopaminergic neurons[J].PLOS One,2008,3(1):e1376.
[4]Kannarkat GT,Boss JM,Tansey MG.The role of innate and adaptive immunity in Parkinson′s disease[J].J Parkinson’s Dis,2013,3(4):493-514.
[5]Banks WA.Blood-brain barrier transport of cytokines:a mechanism for neuropathology[J].Curr Pharm Des,2005,11(8):973-984.
[6]中华医学会神经病学分会运动障碍及帕金森病学组.帕金森病的诊断[J].中华神经科杂志,2006,39(6):408-409.
[7]Mitchell SL,Harper DW,Lau A,et al.Patterns of outcome measurement in Parkinson’s disease clinical trials[J].Neuroepidemiology,2000,19(2):100-108.
[8]Iarlori C,Gambi D,Gambi D.Expression and production of two se-lected beta-chemokines in peripheral blood mononuclear cells from patients with Alzheimer’s disease[J].Exp Gerontol,2005,40(7):605-611.
[9]Andavolou RG,Comings DE.RANTES:a genetic risk marker for multiple sclerosis[J].Mult Scler,2004,10(5):536-539.
[10]Rentzos M,Nikolaou C,Andreadou E.Circulating interleukin-15 and RANTES chemokine in Parkinson’s disease[J].Acta Neurol Scand,2007,116(6):374-379.
[11]Wahner AD,Bronstein JM,Bordelon YM,et al.Nonsteroidal antiinflammatory drugs may protect against Parkinson disease[J].Neurology,2007,69(19):1836-1842.
[12]Whitton PS.Inflammation as a causative factor in the aetiology of Parkinson’s disease[J].Br J Pharmacol,2007,150(8):963-976.
[13]Kurkowska-Jastrzebska I,Wrońska A,Kohutnicka M,et al.The inflammatory reaction following 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine intoxication in mouse[J].Exp Neurol,1999,156(1):50-61.
[14]Brochard V.Infiltration of CD4+lymphocytes into the brain contributes to neurodegeneration in a mouse model of Parkinson’s disease[J].J Clin Invest,2009,119(1):182-192.
[15]Geissmann F.Blood monocytes:distinct subsets,how they relate to dendritic cells,and their possible roles in the regulation of T cell responses[J].Immunol Cell Biol,2008,86(5):398-408.
[16]Tanaka S,Ishii A,Ohtaki H.Activation of microglia induces symptoms of Parkinson′s disease in wild-type,but not in IL-1 knockout mice[J].J Neuroinflammation,2013,10(143):2-9.
[17]Mount MP.Involvement of interferon-gamma in microglial-mediated loss of dopaminergic neurons[J].J Neuro Sci,2007,27(12):3328-3337.
[18]Sawada H,Hashida R,Hirata Y,et al.Activated microglia affect the nigro-striatal dopamine neurons differently in neonatal and aged mice treated with 1-methy1-4-pheny1-1,2,3,6-tetra-hydropyridine[J].J Neurosis Res,2007,85(8):1752-1761.
(编辑武玉欣)
The Circulating Levelsof RANTES and CD4+CD45RO+TCellsin Parkinson’s Disease
ZHUYu-ling,NIUPing,SUCen
(DepartmentofNeurology,The GeneralHospitalofShenyang Military Region,Shenyang 110016,China)
ObjectiveTo detect the circulating concentrations of RANTES and the percentage of CD4+CD45RO+T cells in Parkinson’s disease,and to investigate the causes of those changes in PD as well as the influencing factors of them.MethodsThe serum RANTES levels of 43 PD patients and 33 healthy subjects with age and sex-matched were measured by enzyme-linked immunolsorbent assay(ELISA).And the percentage of circulating CD4+CD45RO+T cellswere detected by using two-colorflow cytometry.The united Parkinson’s disease rate scale partⅢscore(UPDRSⅢ)were evaluated in all studied PD patients.And all PD patients were divided into several subgroups according to the different gender,age,duration and treatmentstatus.ResultsThe mean serum RANTES levels and the percentage ofCD4+CD45RO+T cellsofPD group are significantly higher than the healthy subjects group(bothP<0.01),moreover,a strong and significant correlation between RANTES and UPDRSⅢscore was observed in patients with PD(r=0.74,P<0.00).The PD group were also divided into several different subgroups according to different the gender,age,duration and treatmentstatus,however,there is no significantdifferences in allsubgroups respectively(allP>0.05).There were positive correlations found between RANTES and the percentage of CD4+CD45RO+T cells observed in PD group(r=0.53,P<0.01).ConclusionThe PD group presented with significantly higher RANTES and the percentage of CD4+CD45RO+T cells levels.And the RANTES levels were strongly and significantly correlated with the PD clinical subjective evaluation.However,the gender,the age,the duration and the treatment status cannot interfere the circulating levels ofboth ofthem.In PD group,There were positive correlations between RANTES levelsand the percentage ofCD4+CD45RO+T cells.Our findings may suggest that activated microglia and the adaptive immunity responses induced by CD4+T lymphocytes may play an important role in the pathogenetic mechanisms ofPD.
Parkinson′s disease;regulated upon activation of normal T cell expressed and secreted;CD4+CD45RO+T cells
R472.5
A
0258-4646(2014)03-0217-05
辽宁省科技攻关课题(2010225003)
朱瑜龄(1986-),女,博士研究生.
牛平,E-mail:np0702@sina.com
2013-11-01
网络出版时间:
