HSP90和Sufu在甲状腺乳头状癌中的表达及意义
2014-03-21贾爱庆崔俊帅董文武王志宏贺亮张大林吕承洲张浩
贾爱庆,崔俊帅,董文武,王志宏,贺亮,张大林,吕承洲,张浩
(1.中国医科大学附属第一医院普通外科教研室,甲状腺外科,沈阳110001;2.大连医科大学附属第三医院普通外科,辽宁大连116023)
HSP90和Sufu在甲状腺乳头状癌中的表达及意义
贾爱庆1,崔俊帅2,董文武1,王志宏1,贺亮1,张大林1,吕承洲1,张浩1
(1.中国医科大学附属第一医院普通外科教研室,甲状腺外科,沈阳110001;2.大连医科大学附属第三医院普通外科,辽宁大连116023)
目的通过检测热休克蛋白90(HSP90)及Hedgehog信号通路关键负性调控因子Sufu在甲状腺乳头状癌(PTC)组织中的表达情况,探讨其与临床病理特征的关系及意义。方法应用Elivision两步法免疫组化检测152例PTC原发灶及其癌旁组织中HSP90和Sufu的表达情况,并分析其与临床病理特征的关系。结果HSP90和Sufu主要表达于细胞质中。HSP90在PTC组织中的阳性表达率为79.6%,明显高于癌旁组织(64.5%,P<0.01);伴有淋巴结转移PTC中HSP90的阳性表达率高于无淋巴结转移组(86.7%和69.4%,P<0.01)。Sufu在PTC组织中的阳性表达率明显低于癌旁组织(41.4%和78.3%,P<0.01);伴有淋巴结转移PTC中Sufu的阳性表达率低于无淋巴结转移组(30.0%和58.1%,P<0.01)。HSP90与Sufu在PTC中的表达呈负相关(r=-0.169,P=0.019)。结论HSP90和Sufu可能通过Hedgehog通路参与PTC的发生和淋巴结转移。
甲状腺乳头状癌;热休克蛋白90;Hedgehog
甲状腺乳头状癌(papillary thyroid carcinoma,PTC)是21世纪全球范围内发病率增长最快的实体恶性肿瘤。热休克蛋白90(heat shock protein 90,HSP90)与肿瘤细胞凋亡、肿瘤免疫和肿瘤患者预后的关系已经成为肿瘤学和免疫学研究的热点,有研究表明,HSP90在PTC中的表达异常增高,并且HSP90特异性抑制剂geldanamycin能够明显抑制PTC细胞的增殖和侵袭力[1,2]。然而,HSP90在PTC发生发展中的作用机制尚不清楚。现有研究表明,HSP90可激活前列腺癌细胞中Hedgehog(Hh)信号转导通路,并且活化的Hh信号能够促进PTC细胞的增殖[3,4]。本研究通过检测HSP90和Hh信号转导通路中的关键负性调控因子丝氨酸/苏氨酸激酶Fused抑制物(Sufu)在PTC中的表达情况,进一步了解它们在PTC发生发展中的作用机制。
1 材料与方法
1.1 实验标本与试剂
1.1.1 临床资料:选取中国医科大学附属第一医院普通外科2008年3月至2011年4月术后病理确诊为PTC的患者152例,获取其每例标本包括癌组织和癌旁组织(距肿瘤1 cm远,并经病理证实的非癌组织),石蜡包埋病理组织标本。其中男40例,女112例,男女比例1∶2.8;年龄7~82岁,中位年龄44岁;依据2010年AJCC[5]肿瘤分期:Ⅰ期91例,Ⅱ期13例,Ⅲ期19例,Ⅳ期29例;有淋巴结转移的患者90例,无淋巴结转移的患者62例;有周围组织侵袭的患者53例,无侵袭的患者99例。
1.1.2 主要试剂:鼠抗人HSP90单克隆抗体购自美国Santa Cruz公司,兔抗人Sufu单克隆抗体购自美国Abcam公司,ElivisionTMplus两步法免疫组化试剂盒及DAB染色试剂盒购自福州迈新生物技术开发有限公司。
1.2 方法
1.2.1 免疫组织化学:取石蜡包埋组织切片,脱蜡,水化,高压抗原修复5 min,用3%H2O2阻断内源性过氧化物酶,加入一抗(HSP90为1∶400稀释,Sufu为1∶200稀释),4℃孵育过夜,PBS漂洗3次,根据ElivisionTMplus两步法[6]免疫组织化学染色步骤进行操作,DAB显色。苏木素复染,1%盐酸乙醇分化,PBS返蓝,常规梯度乙醇脱水,二甲苯透明,中性树胶封固。用已知阳性的前列腺癌组织片作为阳性对照,用PBS代替一抗做阴性对照。
1.2.2 免疫组织化学检测结果判定标准:HSP90及Sufu蛋白的表达以细胞质出现棕黄色至棕褐色颗粒为染色阳性。确定阳性标准:在高倍镜下(400倍)对每张切片随机选择5个视野,每个视野计数100个细胞,共计500个。着色强度:无着色0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;按阳性细胞百分比:≤5%为0分,>5%~≤25%为1分,>25%~≤50%为2分,>50%~≤75%为3分,>75%为4分;两者积分的乘积作为染色结果的评判标准,并取5个高倍视野的平均值,得到范围是0~12的分数,按分数分为4个等级:0~1分为(-)、2~4分为(+)、5~8分为(++)、9~12分为(+++),≥2分为阳性。
1.3 统计学分析
用SPSS 13.0统计软件进行统计,采用χ2检验进行分析,两者的相关性采用Spearmann秩相关分析,以P<0.05为差异有统计学意义。
2 结果
2.1 HSP90和Sufu在PTC组织及癌旁组织中的表达情况

图1 HSP90在PTC组织和癌旁组织中的表达ElivisionTMplus×400Fig.1 Expression of HSP90 in PTC and paracancerous tissue ElivisionTMplus×400

图2 Sufu在PTC组织和癌旁组织的表达ElivisionTMplus×400Fig.2 Expression of Sufu in PTC and paracancerous tissue ElivisionTMplus×400
HSP90及Sufu主要表达于细胞质中,见图1、2。如表1所示,HSP90在PTC组织中的表达显著高于癌旁组织,差异有统计学意义(P<0.01),Sufu在PTC组织中的表达显著低于癌旁组织,差异有统计学意义(P<0.01)。
2.2 HSP90和Sufu表达与PTC临床病理特征的关系(表2)
HSP90在PTC中的高表达以及Sufu的低表达与淋巴结是否转移有关,与患者的性别、年龄、肿瘤大小、TNM分期以及是否侵犯周围组织无关。
2.3 PTC组织中HSP90与Sufu表达的相关性分析
HSP90和Sufu在PTC中的表达经Spearman秩相关分析发现,两者呈负相关(r=-0.169,P= 0.019)。
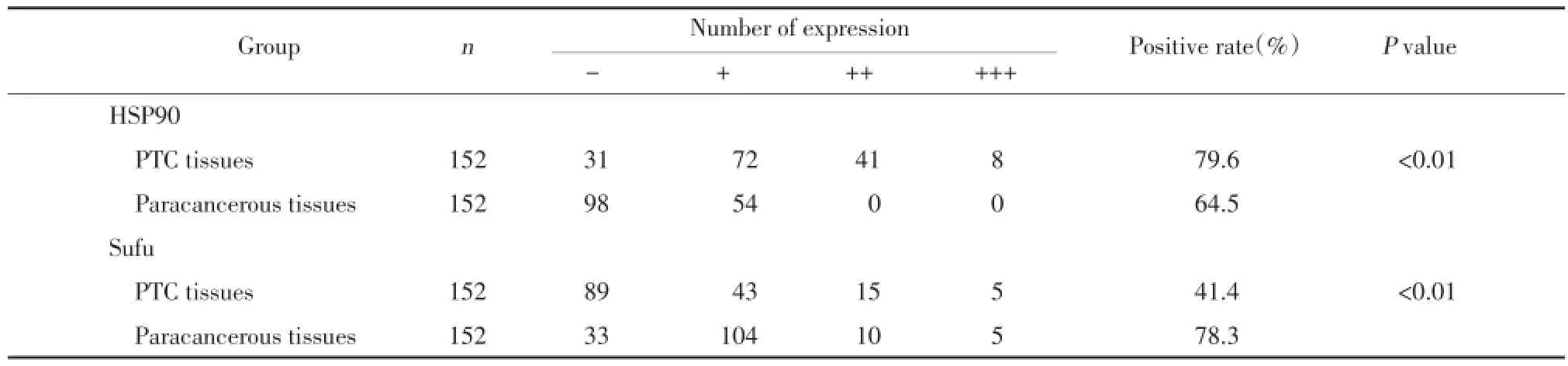
表1 HSP90和Sufu在PTC组织及癌旁组织中的表达情况Tab.1 Expression of HSP90/Sufu between PTC tissues and paracancerous tissues
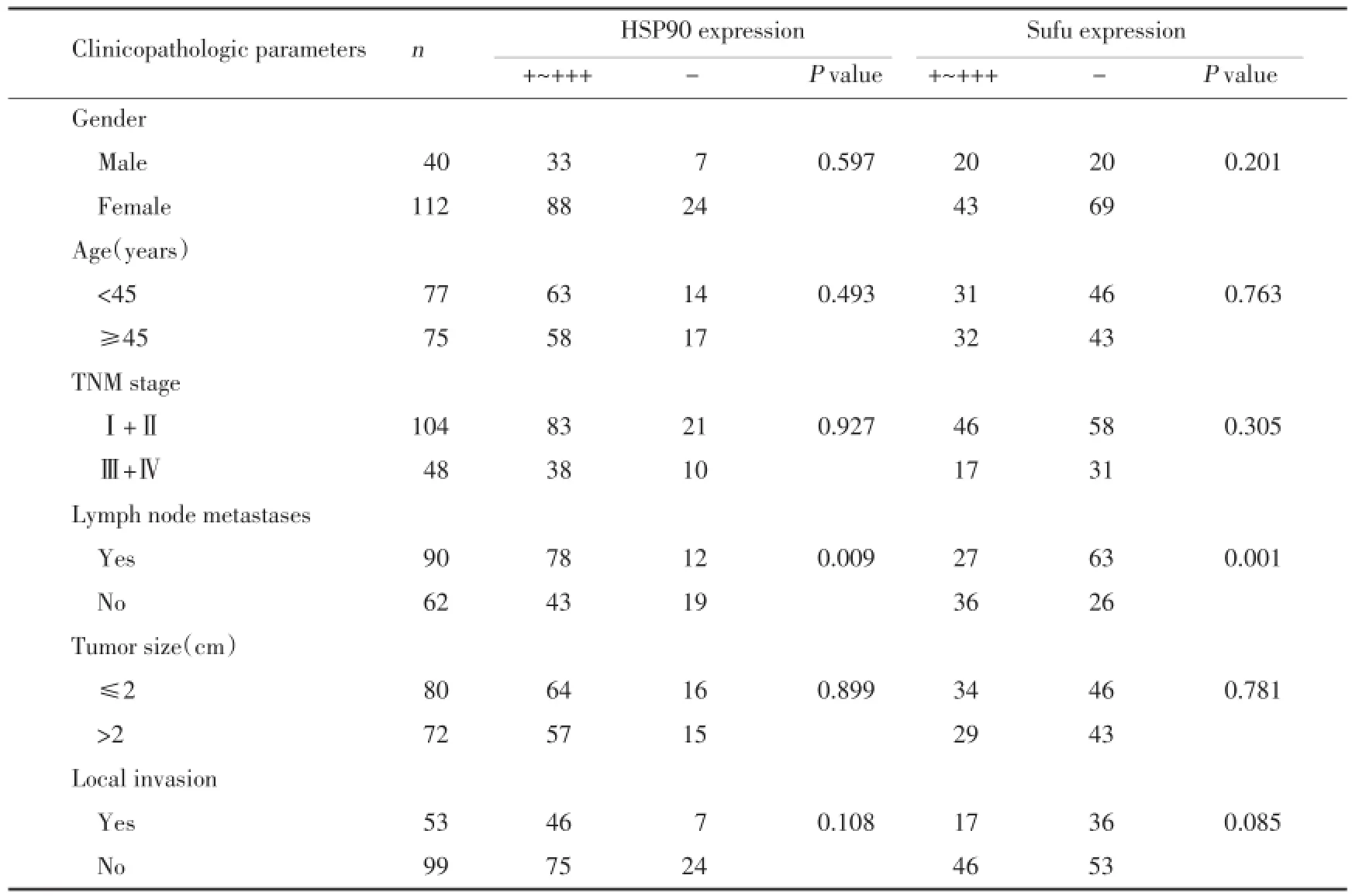
表2 PTC组织中HSP90和Sufu蛋白的表达与临床病理学特征的关系Tab.2 The relationship between HSP90 and Sufu expression and clinicopathologic parameters of PTC
3 讨论
HSP90是一类细胞含量丰富、高度保守的分子伴侣,对于众多底物蛋白的稳定和功能十分重要。目前的研究显示,经HSP90作用的底物蛋白有100多种,其多数可参与信号转导、细胞周期和翻译调控等过程。HSP90通过其分子伴侣作用与其客户蛋白结合,形成分子伴侣复合物,稳定客户蛋白构象,使其以活性形式存在,防止泛素化途径降解,从而维持肿瘤细胞的生长优势,HSP90在乳腺癌、黑色素瘤、结肠癌、白血病等表达异常增高并且与肿瘤的恶性程度关系密切[7]。Mo等[1]研究发现,HSP90在PTC细胞系中的表达也明显增高,并且通过作用于其客户蛋白HIF-1α,促进PTC的发生发展。孙春婷等[8]研究发现HSP90α在PTC中表达较甲状腺腺瘤和正常甲状腺明显增高,并且在淋巴结转移组的阳性表达率高于无淋巴结转移组,与年龄、性别无关。HSP90特异性抑制剂(如geldanamycin、17-AAG)可以通过与HSP90的N末端ATP位点特异结合,抑制内源性ATP酶活性,导致HSP90客户蛋白通过泛素-蛋白酶体途径降解,从而通过阻断多条信号转导通路而抑制肿瘤的发生和发展[2,9]。本研究中,HSP90的阳性表达率为79.6%,明显高于癌旁组织(64.5%),与Mo等[1]的研究一致。并且在有淋巴结转移组中的表达明显高于无淋巴结转移组,与患者的年龄、性别、肿瘤大小、TNM分期以及是否侵犯周围组织无关,可能是因为多数PTC分化程度较高,与其他恶性肿瘤相比恶性程度较低。
Hh信号转导通路参与正常的胚胎发育过程以及组织的创伤与修复,其持续的异常活化与人类多种肿瘤(如口腔鳞癌、基底细胞癌、前列腺癌、肺癌、乳腺癌和消化道肿瘤等)的发生发展密切相关[10~13]。Xu等[4]研究表明,而异常活化的Hh信号转导通路在PTC发生发展中起着重要作用。SuFu作为Hh信号转导通路中的负性调控因子,可通过结合转录因子Gli,抑制Gli与下游靶基因的亲和力,从而起到抑制Hh通路的作用[14]。Yue等[15]发现,激活的Hh信号转导通路可以促进Sufu泛素化,然后使其在蛋白酶体中迅速降解。本研究中,Sufu在PTC组织中的阳性表达率为41.4%,明显低于癌旁组织(78.3%),并且在有淋巴结转移组中的表达低于无淋巴结转移组。可能是由于Sufu基因突变,使其抑制Gli的能力减弱,则Gli与下游靶基因的亲和力增强,促进PTC的发生发展;也有可能是已经激活的Hh信号转导通路通过泛素蛋白酶体系统使Sufu降解,这样则使Sufu对Hh信号转导通路的负性调控能力下降,对PTC的发生发展起到促进作用,其具体机制尚待进一步研究。
Kise等[3]在前列腺癌细胞系PC3中发现,HSP90可以稳定Hh信号转导通路中的丝氨酸/苏氨酸激酶Fused(Fu),特异性抑制HSP90能够导致Fu蛋白快速降解,表明HSP90存在于Hh信号转导通路的胞质蛋白复合体中,并参与对Fu蛋白的调控。本研究提示HSP90与Sufu在PTC组织中的表达呈负相关(P<0.05)。有可能是HSP90通过作用于Fu蛋白,进而激活Hh信号转导通路,激活的Hh信号转导通路通过泛素蛋白酶体系统降解Sufu所致,然而两者之间是否存在相关,尚有待进一步的研究来证实。
[1]Mo JH,Choi IJ,Jeong WJ,et al.HIF-1α and HSP90:target molecules selected from a tumorigenic papillary thyroid carcinoma cell line[J].Cancer Sci,2012,103(3):464-471.
[2]Park JW,Yeh MW,Wong MG,et al.The heat shock protein 90-binding geldanamycin inhibits cancer cell proliferation,down-regulates oncoproteins,and inhibits epidermal growth factor-induced invasion in thyroid cancer cell lines[J].J Clin Endocrinol Metab,2003,88(7):3346-3353.
[3]Kise Y,Takenaka K,Tezuka T,et al.Fused kinase is stabilized by Cdc37/Hsp90 and enhances Gli protein levels[J].Biochem Biophys Res Commun,2006,351(1):78-84.
[4]Xu X,Ding H,Rao G,et al.Activation of the sonic hedgehog pathway in thyroid neoplasms and its potential role in tumor cell proliferation[J].Endocr Relat Cancer,2012,19(2):167-179.
[5]Edge SB,Byrd DR,Compton CC,et al.AJCC cancer staging manual[M].7th ed.New York:Springer,2010.
[6]Nikiel B,Chekan M,Jarzab M,et al.Endogenous avidin biotin activity(EABA)in thyroid pathology:immunohistochemical study[J]. Thyroid Res,2009,2(1):5-11.
[7]Barrott JJ,Haystead TA.Hsp90,an unlikely ally in the war on cancer[J].FEBS J,2013,280(6):1381-1396.
[8]孙春婷,杨俊芬,余勤,等.热休克蛋白70和热休克蛋白90α在甲状腺乳头状癌中的表达及其意义[J].中国现代医学杂志,2010(12):1829-1832.
[9]Bonvini P,Dalla RH,Vignes N,et al.Ubiquitination and proteasomal degradation of nucleophosmin-anaplastic lymphoma kinase induced by 17-allylamino-demethoxygeldanamycin:role of the cochaperone carboxyl heat shock protein 70-interacting protein[J]. Cancer Res,2004,64(9):3256-3264.
[10]Cavicchioli BM,Gurgel CA,Goncalves RE,et al.Activation of sonic hedgehog signaling in oral squamous cell carcinomas:a preliminary study[J].Hum Pathol,2011,42(10):1484-1490.
[11]Makinodan E,Marneros AG.Protein kinase A activation inhibits oncogenic Sonic hedgehog signalling and suppresses basal cell carcinoma of the skin[J].Exp Dermatol,2012,21(11):847-852.
[12]Kim TJ,Lee JY,Hwang TK,et al.Hedgehog signaling protein expression and its association with prognostic parameters in prostate cancer:a retrospective study from the view point of new 2010 anatomic stage/prognostic groups[J].J Surg Oncol,2011,104(5):472-479.
[13]Harris LG,Pannell LK,Singh S,et al.Increased vascularity and spontaneous metastasis of breast cancer by hedgehog signaling mediated upregulation of cyr61[J].Oncogene,2012,31(28):3370-3380.
[14]Cheng SY,Yue S.Role and regulation of human tumor suppressor SUFU in Hedgehog signaling[J].Adv Cancer Res,2008,101:29-43.
[15]Yue S,Chen Y,Cheng SY.Hedgehog signaling promotes the degradation of tumor suppressor Sufu through the ubiquitin-proteasome pathway[J].Oncogene,2009,28(4):492-499.
(编辑武玉欣)
Expression ofHSP90 and Sufu in Papillary Thyroid Carcinoma and Its ClinicalSignificance
JIA Ai-qing1,CUI Jun-shuai2,DONG Wen-wu1,WANG Zhi-hong1,HE Liang1,ZHANG Da-lin1,LÜ Cheng-zhou1,ZHANG Hao1
(1.Unit of Thyroid Surgery,Department of General Surgery,The First Hospital,China Medical University,Shenyang 110001,China;2.Department of General Surgery,The Third Hospital,Dalian MedicalUniversity,Dalian 116023,China)
ObjectiveTo investigate the expression ofHSP90 and Hedgehog signaling molecular Sufu in papillary thyroid carcinoma(PTC)and to explore the relationship between the HSP90,Sufu expression and clinicopathological parameters.MethodsThe expression of HSP90 and Sufu was examined in 152 cases of PTC tissues and paracancerous tissues using ElivisionTMplus.The relationship between the HSP90,Sufu expression and clinicopathologic parameters of PTC patients was analyzed.ResultsBoth HSP90 and Sufu expressed in cytoplasm.The positive rate of HSP90 expression in PTC tissues was 79.6%,which was significantly higher than the rate in paracancerous tissues(64.5%,P<0.01).The positive rate of HSP90 expression in the group with lymph node metastases was higher than in the group without lymph node metastases(86.7%vs 69.4%,P<0.01).The positive rate of Sufu expression in PTC tissues was significantly lower than the positive rate in paracancerous tissues(41.4%vs 78.3%,P<0.01).The positive rate of Sufu expression in the group with lymph node metastases was lower than in the group without lymph node metastases(30.0%vs 58.1%,P<0.01).In PTC tissues,HSP90 expression was negatively correlated with Sufu expression(r=-0.169,P=0.019).Conclu⁃sionHSP90 and Sufu mightplay a role in the occurrence and lymph node metastasisofPTC though Hedgehog signaling pathway.
papillary thyroid carcinoma;HSP90;Hedgehog
R736.1
A
0258-4646(2014)03-0231-04
辽宁省科学技术计划(2012225087)
贾爱庆(1987-),男,助教,硕士.
张浩,E-mail:haozhang@mail.cmu.edu.cn
2013-12-16
网络出版时间:
