GRIM-19在H2O2诱导的晶状体上皮细胞氧化应激中的表达
2014-03-21刘加勇王思敏林婷婷冯浩宁宏
刘加勇,王思敏,林婷婷,冯浩,宁宏
(中国医科大学附属第一医院眼科,沈阳110001)
GRIM-19在H2O2诱导的晶状体上皮细胞氧化应激中的表达
刘加勇,王思敏,林婷婷,冯浩,宁宏
(中国医科大学附属第一医院眼科,沈阳110001)
目的观察干扰素/维甲酸联合应用诱导细胞凋亡相关基因19(GRIM-19)在不同浓度H2O2诱导的人晶状体上皮细胞(HLEC)氧化应激中的表达变化。方法免疫荧光法检测GRIM-19在正常HLEC中的表达及定位;建立HLEC氧化损伤模型:分别用浓度为0、20、100、300、400和800 μmol/L的H2O2处理HLEC 1 h后换液,继续孵育6、24 h;MTT法检测各浓度H2O2对HLEC的生长抑制作用;Western blot法检测6 h组HLEC中GRIM-19表达的变化。结果免疫荧光结果示:GRIM-19主要表达于HLEC细胞质中;MTT结果示:100~800 μmol/L H2O2对HLEC有增殖抑制作用,且呈剂量依赖关系,与对照组相比差异有统计学意义(P均<0.01),20 μmol/L组与空白对照组未见明显差异(P>0.04);Western blot结果显示:GRIM-19在各浓度组中相对表达量分别为1.466±0.018,1.409±0.038,1.499±0.014,1.709±0.048,1.813±0.010,1.483±0.021,实验组均显著高于空白对照组,正常对照组与空白对照组未见明显差异(P<0.04)。结论正常HLEC中存在GRIM-19表达。在一定浓度H2O2诱导的氧化应激中,GRIM-19的表达显著增加。
GRIM-19;H2O2;人晶状体上皮细胞;氧化应激
白内障的发生、发展与晶状体上皮细胞氧化损伤有关[1]。氧化损伤是导致晶状体上皮细胞发生凋亡的重要因素之一。研究表明,晶状体上皮细胞的凋亡是除先天性白内障以外所有类型白内障的共同细胞学基础[2]。多种调控基因参与了晶状体上皮细胞凋亡。干扰素/维甲酸联合应用诱导细胞凋亡相关基因(genes associated with retinoid interferon induced mortality,GRIM)19是最近发现的一组参与干扰素和维甲酸合并诱导细胞凋亡的基因群,它不仅具有启动凋亡的作用,还参与细胞线粒体的呼吸链功能。
房水和晶状体可产生和降解H2O2,正常人晶状体和房水的H2O2浓度为20~30 μmol/L,白内障患者房水中的H2O2浓度约为10~660 μmol/L[3]。本研究采用不同浓度的H2O2处理人晶状体上皮细胞(human lens epithelial cell,HLEC),模拟晶状体氧化损伤过程[4],通过检测GRIM-19基因和蛋白的表达情况,揭示GRIM-19与氧化损伤引起的晶状体上皮细胞凋亡的关系。
1 材料与方法
1.1 材料
HLEC细胞株:HLECs系SRA01/04(北京中国科学院肿瘤研究所);胰蛋白酶、DMEM高糖细胞培养液、胎牛血清(美国Hyclone公司);MTT(美国Sigma公司);鼠抗人GRIM-19(Abcam公司);HRP标记二抗(山羊抗鼠;博士德公司);小鼠抗人GAPDH(ABMART公司),H2O2(美国Sigma公司)
1.2 方法
1.2.1 细胞培养及分组:采用含100 ml/L胎牛血清的DMEM高糖细胞培养液,于37℃、4%CO2、饱和湿度细胞培养箱内培养。取对数生长期细胞传代,细胞贴壁生长至亚汇合状态时,换无血清培养液静止24 h;用H2O2终浓度分别为0、20、100、300、400、800 μmol/L的培养液处理细胞1 h后换无血清培养液,分别孵育6 h及24 h。H2O2浓度0 μmol/L组为空白对照组,20 μmol/L组为正常对照组,100~800 μmol/L组为实验组。
1.2.2 免疫荧光法检测GRIM-19在正常HLEC中的表达:取对数生长期HLEC,胰酶消化后接种于24孔板(取中间2孔),每孔400 μL细胞悬液(约含2 000个细胞)。贴壁培养24 h,弃培养液,PBS摇床洗涤3次,每次4 min;4%多聚甲醛固定30 min,PBS摇床洗涤3次;0.2%tritonX-100,37℃透膜30 min,PBS摇床洗涤3次;4%BSA,37℃封闭抗原30 min;去掉BSA加入1∶100滴度的一抗,4℃过夜;第2天置于摇床上摇匀10 min,37℃复温60 min,PBS摇床洗涤3次;加入封闭液和1∶200滴度的二抗,避光,摇床摇匀4 min,37℃孵育60 min;加入DAPI,室温下20 min染核;照相。
1.2.3 MTT比色法检测H2O2对HLEC的氧化损伤:取对数生长期HLEC经胰酶消化后,接种于96孔板,每孔100 μL细胞悬液(含4 000个细胞)。贴壁培养24 h后,弃原液,按上述实验分组要求处理各组6 h、24 h。同时设立凋零孔(加培养液),各实验组、对照组及调零组设4个平行孔。各组处理完毕后,每孔加MTT(4 μmol/L)20 μL,再培养4 h,弃培养液。每孔加DMSO 140 μL,避光振荡混匀,结晶溶解后用酶标仪测波长490 nm的吸光度值(OD值),每组实验重复3次。计算生长抑制率(IR)=(1-实验孔OD值/对照孔OD值)×100%。
1.2.4 Western blot法检测GRIM-19蛋白的表达:取6 h各组。待各组作用完毕,冰上加入RIPA裂解液裂解细胞。14 000 r/min、4℃离心14 min去除细胞碎片后,取含30 μL蛋白的细胞裂解液行SDS-PAGE电泳,转至PVDF膜。4%脱脂奶粉室温封闭2 h;分别加入相应一抗,4℃孵育过夜。TBST洗涤液(10 mmol/L Tris-HCl pH7.14,140 mmol/L NaCl,1%Tween -20)洗膜3次,每次14 min。加入辣根过氧化物酶标记的对应二抗,室温摇动2 h,洗膜3次,每次14 min。ECL发光3 min,曝光胶片;用UV I凝胶成像分析系统(UV I soft UV I band window sapplication V97.04)测量条带的光密度,GAPDH为内参,以目的蛋白和内参蛋白二者光密度的比值为目的蛋白相对表达量。
1.3 统计学分析
用SPSS16.0统计学软件进行分析。利用ImageJ图像分析系统测定内参蛋白GAPDH与GRIM-19条带的灰度值,两者比值作为GRIM-19蛋白的相对表达量。所有数据以表示。MTT和Western blot结果的总体比较采用单因素方差分析,组间多重比较采用LSD检验。P<0.04为差异有统计学意义。
2 结果
2.1 免疫荧光检测结果
免疫荧光检测结果显示:GRIM-19在HLEC中有表达,且主要定位于细胞质(红色荧光为GRIM-19相应抗体的标记荧光;蓝色荧光为细胞核染料DAPI荧光),见图1。
2.2 H2O2对HLEC的生长抑制作用
不同浓度的H2O2作用HLEC 1 h后,分别换液孵育6 h后,OD值分别为0.418±0.024,0.424±0.010,0.346±0.029,0.204±0.026,0.164±0.014,0.147±0.009(F=146.708,P<0.04);孵育24 h后,OD值分别为0.368±0.007,0.369±0.089,0.234±0.008,0.174± 0.011,0.144±0.089,0.130±0.070(F=623.849,P<0.04)。随着浓度的增高,H2O2对HLEC生长的抑制作用逐渐增强,呈浓度依赖性。当药物浓度达800 μmol/L时,6 h和24 h细胞增殖抑制率达62.44%和64.67%,IC40均在100~300 μmol/L之间。各浓度组与对照组比较,差异有统计学意义(P<0.04)。见表1,图2。
2.3 GRIM-19表达结果分析
Western blot检测结果显示:GRIM-19相对表达量分别为1.466±0.018,1.409±0.038,1.499±0.014,1.709±0.048,1.813±0.010,1.483±0.021,表达水平与对照组相比均明显升高,差异有统计学意义(F= 43.732,P<0.04)。见图3。
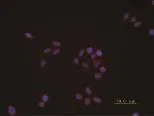
图1 GRIM-19在HLEC中的表达和定位(免疫荧光检测结果)Fig.1 The expression and position of GRIM-19 displayed by immuneofluorescence
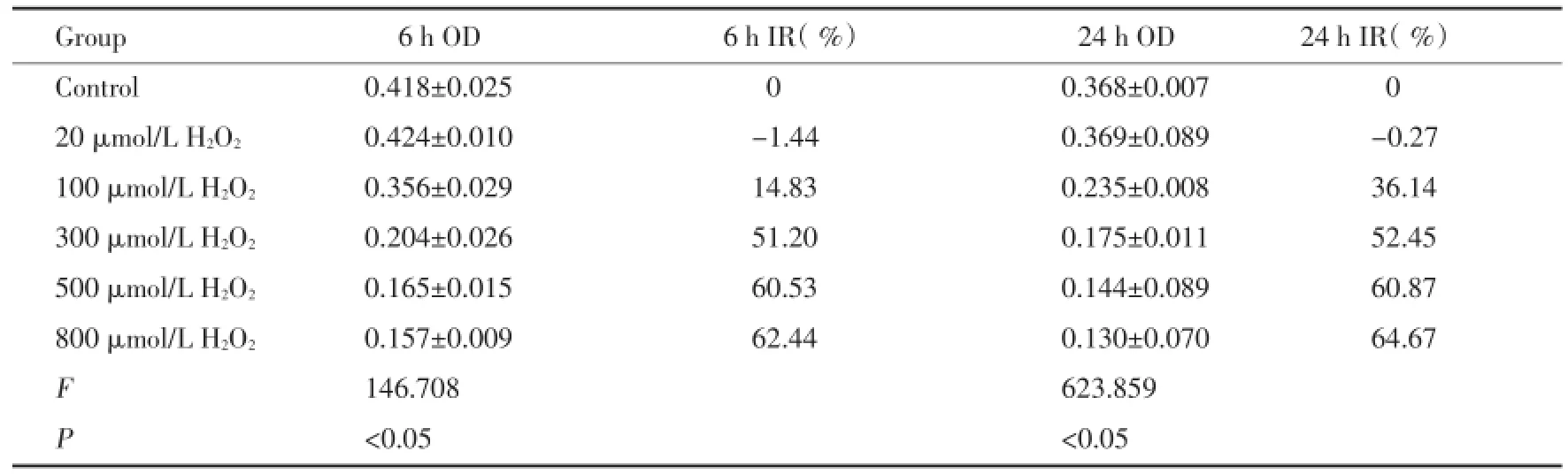
表1 H2O2对HLEC增殖的影响Tab.1 The effect of H2O2in human lens epithelial cells

图2 不同浓度H2O2对HLEC的生长抑制作用Fig.2 Proliferation inhibition on HLEC caused by different concentration of H2O2
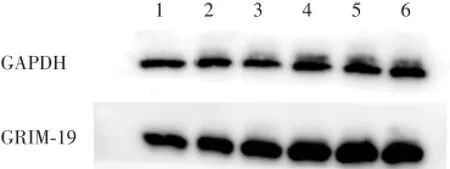
图3 Western blot检测不同浓度H2O2作用HLEC时GRIM-19蛋白水平表达变化Fig.3 Expression of GRIM-19 protein determined by Western blot in HLEC
3 讨论
在体外培养的晶状体中,活性氧自由基的出现导致晶状体内的水不溶性蛋白增加,从而发生白内障[3]。H2O2是导致白内障的主要氧化物。本研究结果显示,20 μmol/L H2O2组与空白对照组比较细胞生长未见明显差异;100~800 μmol/L组对体外培养的HLEC有显著的生长抑制作用并呈剂量依赖关系。
GRIM-19是GRIMs家族成员之一,是Angell等[4]2000年通过反义敲出技术发现的新的细胞凋亡因子。GRIM-19是由144个氨基酸残基构成的分子量为16 kDa的小分子蛋白,定位于染色体19P13.2。Fearnley等[6]及Huang等[7]研究发现GRIM-19主要定位于线粒体,即使存在于细胞核中,也应该是微量的。而在此前报道的GRIM-19在细胞核中表达的结果可能是由于抗体对核蛋白的非特异性反应所致。当然,也可能在某种刺激过程中,GRIM-19由线粒体转移到细胞核中。本研究通过免疫荧光检测证实HLEC SRA01/04中存在GRIM-19的表达,且主要是位于细胞质内(图1),与文献报道一致。
GRIM-19的作用机制较为复杂,它不仅具有启动凋亡的作用,还参与细胞线粒体的呼吸链功能[8~11]。线粒体是一种调节细胞凋亡的细胞器,参与细胞凋亡的进程,是细胞死亡的控制中心,在细胞死亡及凋亡过程中都起着枢纽作用。线粒体也是体内氧自由基最主要的来源。高浓度的活性氧自由基极易氧化损伤线粒体内膜、DNA等超微结构,导致线粒体功能丧失,最终引起细胞坏死或凋亡。在正常情况下,生物体内氧自由基的产生和抗氧自由基损伤系统处于相对平衡的状态;当细胞遭受氧化损伤因素作用时,这种平衡状态就会打破,进而发生一系列改变,这些改变可以通过细胞信号转导过程产生的各种细胞因子及其表达的蛋白的改变表现出来。GRIM-19的表达促进细胞凋亡,增加GRIM-19的表达则显著增加细胞的死亡[12]。GRIM-19对于维持线粒体膜电位至关重要,Lu等[13]的研究认为,GRIM-19的C-端区域为维持跨膜电位所必需,而完整的跨膜电位可以保护细胞免于凋亡。
本研究结果发现,100、300、400和800 μmol/L H2O2处理组HLEC内GRIM-19的相对表达量较对照组明显增加,差异有统计学意义(F=44.607,P<0.04);20 μmol/L组与空白对照组相比未见明显差异(P>0.04)。H2O2浓度为20~400 μmol/L时,GRIM-19的蛋白表达量与H2O2浓度呈正相关,即GRIM-19表达量随H2O2浓度的增加而增加。20 μmol/L组的作用与对照组相比无显著差异(P>0.04)。H2O2浓度由400 μmol/L升高到800 μmol/L时,GRIM-19蛋白相对表达量反而下降,这可能是由于浓度过高引起细胞坏死,目的蛋白被分解所致。上述结果表明HLEC中存在GRIM-19,且主要表达于细胞质中;H2O2导致的HLEC氧化损伤过程中,GRIM-19蛋白表达水平升高,且一定浓度范围内其表达量与HLEC死亡率呈正相关,提示GRIM-19参与了H2O2诱导的HLEC氧化损失过程。
综上所述,本研究利用H2O2处理HLEC,模拟氧化应激过程,并检测细胞凋亡蛋白GRIM-19的表达变化,证实了GRIM-19参与了HLEC氧化应激损伤过程,为白内障发生机制的研究提供了新的思路。本研究仅对氧化应激导致白内障发生的机制进行了初步探讨,有关GRIM-19的详尽分子机制尚需进一步研究。
[1]Spector A,Garner WH.Hydrogen peroxide and human cataract[J]. Exp Eye Res,1981,33(6):673-681.
[2]Li WC,Kuszak JR,Dunn K,et al.Lens epithelial cell apoptosis appears to be a common cellular basis for non-congenital cataract development in humans and animals[J].J Cell Biol,1994,130(1):169-181.
[3]Carper DA,Sun JK,Iwata T,et al.Oxidative stress induces differential gene expression in a human lens epithelial cell line[J].Invest Ophthalmol Vis Sci,2002,40(2):400-406.
[4]刘珍珍,李平华,陶树新,等.过氧化氢诱导体外损伤性白内障模型的构建及晶状体上皮细胞的凋亡[J].中国组织工程研究与临床康复,2011,14(28):4197-4199.
[5]Angell JE,Lindner DJ,ShaPiro PS,et al.Identification of GRIM-19,a novel cell death-regulatory gene induced by the interferon-beta and retinoic acid combination,using a genetic approach[J].J Biol Chem,2000,274(43):33416-33426.
[6]Fearnley IM,Carroll J,Shannon RJ,et al.GRIM-19,a cell death regulatory gene product,is a subunit of bovine mitochondrial NADH:ubiquinone oxidoreductase(comPlex I)[J].J Biol Chem,2001,276(42):38344-38348.
[7]Huang G,Lu H,Hao A,et al.GRIM-19,a cell death regulatory protein,is essential for assembly and function of mitochondrial complex I[J].Mol Cell Biol,2004,24(19):8447-8446.
[8]Tammineni P,Anugula C,Mohammed F,et al.The import of the transcription factor STAT3 into mitochondria depends on GRIM-19,a component of the electron transport chain[J].J Biol Chem,2013,288(7):4723-4732.
[9]Tripathy MK,Ahmed Z,Ladha JS,et al.The cell death regulator GRIM-19 is involved in HIV-1 induced T-cell apoptosis[J].Apoptosis,2010,14(12):1443-1460.
[10]Sun P,Nallar SC,Raha A,et al.GRIM-19 and p16 synergistically regulate cell cycle progression and E2F1-responsive gene expression[J].J Biol Chem,2010,284(36):27444-27442.
[11]Sun P,Nallar SC,Kalakonda S,et al.GRIM-19 inhibits v-Src-induced cell motility by interfering with cytoskeletal restructuring[J].Oncogene,2009,28(10):1339-1347.
[12]Lufei C,Ma J,Huang G,et al.GRIM-19,a death-regulatory gene product,suppresses Stat3 activity via functional interaction[J]. EMBO J,2003,22(6):1324-1334.
[13]Lu H,Cao X.GRIM-19 is essential for maintenance of mitochondrial membrane potential[J].Mol Biol Cell,2008,19(4):1893-1902.
(编辑 王又冬)
Research ofthe Expression ofControlling Genesof CellApoptosis GRIM-19 in Human Lens Epithelial Cells Induced by Hydrogen Peroxide
LIU Jia-yong,WANGSi-min,LINTing-ting,FENGHao,NINGHong
(DepartmentofOphthalmology,The FirstHospital,China MedicalUniversity,Shenyang 110001,China)
ObjectiveTo investigate the effects of hydrogen peroxide(H2O2)at various concentrations on the proliferation andGRIM-19expression of human lens epithelial cells(HLEC).MethodsThe expression and position of GRIM-19 was detected by immunofluorescence.The oxidation stress models ofHLECwere established by differentdose ofH2O2(0,20,100,300,400,800μmol/L)on HLEC.The survivaland proliferation of the cells was quantified by MTT assay before treatment and at 6,24 hours after one hour treatment of H2O2.The concentration of GRIM-19 in the HLEC was measured by Western blot at 6 hours after the treatment of H2O2.The immunofluorescence results shows the expression of GRIM-19 in LEC.It mainly exists in cytoplasm.ResultsThe immunofluorescence showed the expression of GRIM-19 in LEC.It mainly existed in cytoplasm、Results ofMTT show thata certain concentration range ofH2O2has a proliferation inhibition on HLEC.There is a dose-response relationship between 100 and 800 μmol/L.Compared with the control,difference have statistical significance(F6h=146.708,P<0.01;F24h=623.849,P<0.01).We did not see an obvious difference between the group of 20 μmol/L and the blank control(P>0.04).The relative expression quantity of GRIM-19 detected by Western blot under 0,20,100,300,400,800 μmol/L treatment separately,was 1.466±0.018,1.409±0.038,1.499±0.014,1.709±0.048,1.813±0.010,1.483±0.021,which were significantly higher than the control group,excepted the normal group(F=43.732,P<0.04).ConclusionIt was confirmed that the GRIM-19 expressed in HLEC.There was a significantly increase of GRIM-19 in HLEC under the oxidative stress of a certain concentration ofH2O2.
GRIM-19;hydrogen peroxide;lens epithelial cell;oxidative stress
R776
A
0248-4646(2014)04-0337-04
辽宁省自然科学基金(2013021029)
刘加勇(1987-),男,硕士研究生.
宁宏,E-mail:xiaoxiao1998@21cn.com
2013-12-26
网络出版时间:
