细胞外信号调节激酶对神经胶质瘤环氧合酶2基因表达的影响
2014-03-21王翀吴鹏飞王明昊刘济源
王翀,吴鹏飞,王明昊,刘济源
(1.沈阳市第四人民医院神经外科,沈阳110031;2.中国医科大学附属第一医院神经外科,沈阳110001)
细胞外信号调节激酶对神经胶质瘤环氧合酶2基因表达的影响
王翀1,吴鹏飞2,王明昊2,刘济源2
(1.沈阳市第四人民医院神经外科,沈阳110031;2.中国医科大学附属第一医院神经外科,沈阳110001)
目的探讨细胞外信号调节激酶(ERK)对神经胶质瘤组织中环氧合酶2(COX-2)基因表达的作用。方法60只大鼠被随机分成对照组、胶质瘤组和ERK抑制剂组,每组20只。采用注射C6胶质瘤细胞的方法制作小鼠胶质瘤模型。采用免疫组织化学和Western blot检测胶质瘤组织中COX-2蛋白表达水平的变化,并采用RT-PCR检测胶质瘤组织中COX-2mRNA表达水平的变化。结果免疫组织化学方法和Western blot结果显示,与对照组比较,胶质瘤组大鼠胶质瘤COX-2表达水平显著升高(P<0.01);而与胶质瘤组比较,ERK抑制剂组大鼠胶质瘤COX-2表达水平显著降低(P<0.01)。RT-PCR检测发现,与对照组比较,胶质瘤组大鼠胶质瘤COX-2mRNA表达水平显著升高(P<0.01);而与胶质瘤组比较,ERK抑制剂组大鼠胶质瘤COX-2mRNA表达水平显著降低(P<0.01)。结论ERK能够上调神经胶质瘤组织中COX-2基因的表达。
细胞外信号调节激酶;环氧合酶2;神经胶质瘤;大鼠
脑胶质瘤为中枢神经系统最常见的恶性肿瘤,其发生、发展及恶性生物学特征与肿瘤细胞内的异常信号转导网络相关,而且因为其临床手术全切除困难、易复发的特性,严重危害人类的健康。细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)信号传导通路参与了细胞生长、发育、增殖和分化以及细胞间的功能同步和细胞恶性转化等多种生理、病理过程。ERK可被各种生长因子等有丝分裂原激活,进入细胞核,促进某些特异基因的转录与激活,进而在细胞恶性转化及演进中起着重要作用[1~3]。研究并利用ERK在神经胶质瘤中的作用,能更好地指导神经胶质瘤治疗策略的制定。本研究通过阻断ERK后检测环氧合酶2(cyclooxygenase-2,COX-2)表达的变化来探讨ERK在神经胶质瘤中的作用机制。
1 材料与方法
1.1 实验材料
COX-2单克隆抗体,购自美国Santa Cruz公司;二抗山羊抗兔多克隆抗体,购自北京中杉金桥生物技术有限公司;MEK1/2抑制剂U0126,购自碧云天有限公司;免疫组化SP试剂盒和DAB试剂盒,购自迈新公司。
1.2 大鼠C6胶质瘤细胞培养和实验动物分组
大鼠C6胶质瘤细胞购自上海研域生物科技有限公司,在含10%胎牛血清、100 mg/mL链霉素及100 U/mL青霉素的高糖DMEM培养基中,37℃、湿度100%、4%CO2培养。
Wistar健康雄性大鼠60只,体质量180~200 g,购自中国医科大学实验动物中心。大鼠以10%水合氯醛(3.4 mL/kg)腹腔注射麻醉后,固定于大鼠脑立体定位仪上,取冠状缝前1.0 mm、矢状缝右侧3.0 mm钻骨孔。以微量注射器抽吸10 μL含有1×106个C6细胞的悬液,于骨孔处进针深达硬膜下4.4 mm,退针0.4 mm,注射时间为10 min,留针10 min,使细胞充分沉积于右侧尾状核区[4]。移植C6胶质瘤细胞14 d后,随机分为3组。胶质瘤组:解剖显微镜下分离并结扎右侧颈总、颈外动脉的近心端,经右侧颈总动脉远心端泵入无菌生理盐水10 μL,作用30 min。ERK抑制剂组:泵入10 μL DMSO稀释的U0126溶液(400 μmol/L)。对照组不作任何处理。
1.3 免疫组化方法
麻醉各组大鼠,经左心室用4%多聚甲醛灌注固定,断头取脑后固定6 h,浸入20%~30%蔗糖溶液中浸泡脱水72 h。常规等级乙醇脱水,二甲苯透明,石蜡包埋,作连续冠状脑切片,切片厚6 μm。采用SP方法检测COX-2的表达,按照试剂盒说明书操作,结果进行平均光密度值分析。
1.4 Western blot方法
麻醉各组大鼠后立即在冰上断头,开颅取肿瘤组织,加入裂解缓冲液,剪碎并匀浆,4℃、17 000 r/min离心14 min,取上清液。采用BCA方法测定蛋白浓度,计算蛋白上样量。SDS-PAGE电泳分离,转印,4%脱脂奶粉封闭,4℃孵育过夜,一抗COX-2,βactin(1∶400)室温摇床孵育2 h,加辣根过氧化物酶标记的二抗(1∶4 000),室温摇床孵育2 h,ECL(美国Santa Cruz公司)光化学法显色,曝光,胶片经透射扫描仪扫描获得图像,以凝胶图像扫描分析软件测定条带的积分光密度值,计算COX-2与β-actin的比值。
1.5 RT-PCR方法检测COX-2mRNA的表达
麻醉各组大鼠后立即在冰上断头,开颅取肿瘤组织,按RNAout说明书进行总mRNA提取,然后以逆转录合成cDNA,再进行PCR扩增。COX-2引物序列见表1。扩增产物进行1.4%琼脂糖电泳,UVP凝胶显像仪扫描并进行图像分析。
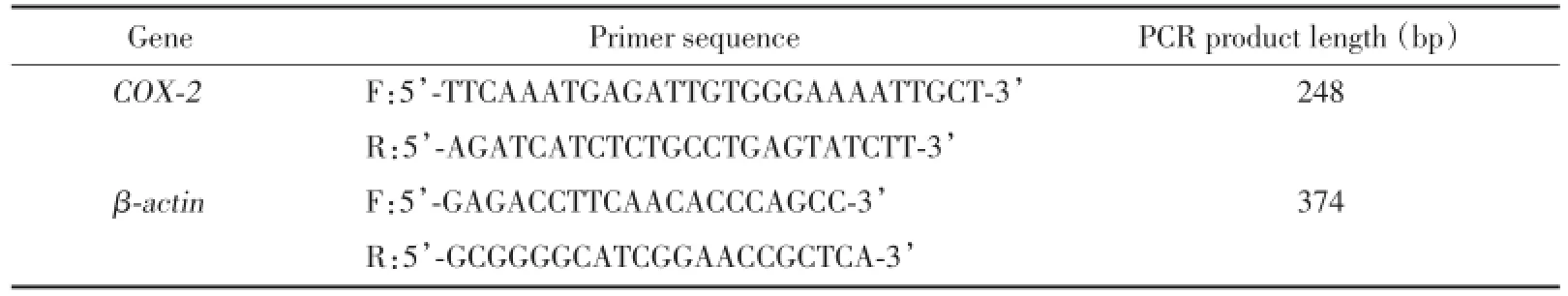
表1 引物设计及长度Tab.1 The designed primers and amplification length
1.6 统计学分析
2 结果
2.1 COX-2蛋白表达
免疫组化结果(图1)显示,对照组脑组织可见少量COX-2蛋白阳性细胞,胶质瘤组大鼠胶质瘤部位COX-2蛋白阳性细胞数明显增多,ERK抑制剂组大鼠胶质瘤COX-2蛋白阳性细胞数介于对照组与胶质瘤组之间。胶质瘤组与对照组比较、ERK抑制剂组与胶质瘤组比较,COX-2蛋白阳性表达平均光密度值的差异均有统计学意义(P<0.01)。见表2。
从Western blot结果(图2)可以看出,对照组大鼠COX-2蛋白表达量较低,与对照组比较,胶质瘤组大鼠COX-2蛋白表达水平显著升高,差异有统计学意义(P<0.01)。ERK抑制剂组COX-2蛋白表达水平介于对照组与胶质瘤组之间,与胶质瘤组比较,ERK抑制剂组COX-2蛋白表达水平显著降低,差异有统计学意义(P<0.01)。见表2。
2.3COX-2mRNA的表达结果
对RT-PCR(图3)结果进行分析发现,胶质瘤组与对照组比较,COX-2mRNA表达水平显著升高,差异有统计学意义(P<0.01);而ERK抑制剂组与胶质瘤组相比,COX-2mRNA表达水平显著降低,差异有统计学意义(P<0.01)。见表2。
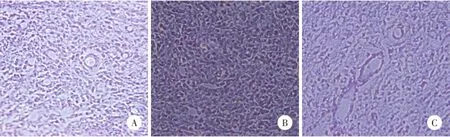
图1 免疫组化方法检测COX-2的表达×200Fig.1 The expression of COX-2 detected by immunohistochemistry×200
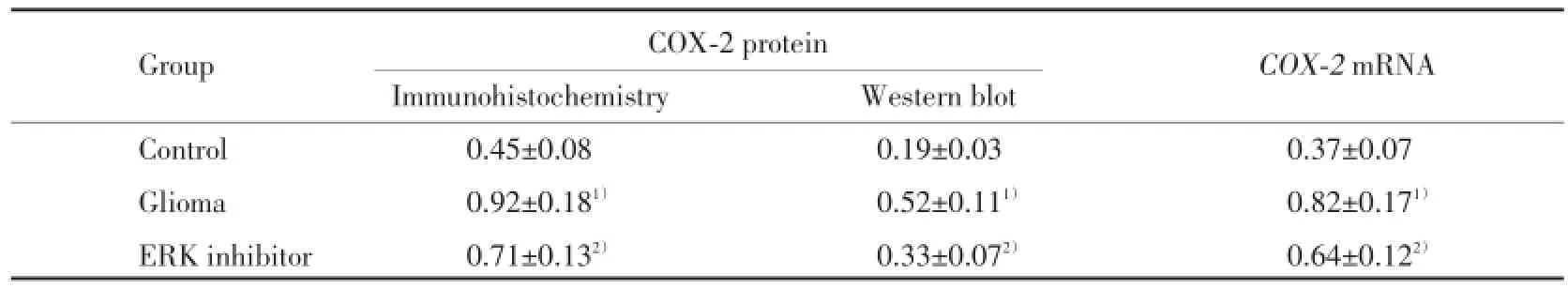
表2 各组大鼠COX-2蛋白和mRNA表达的平均光密度值Tab.2 The average optical density value of COX-2 protein and mRNA expressions in rats of each group
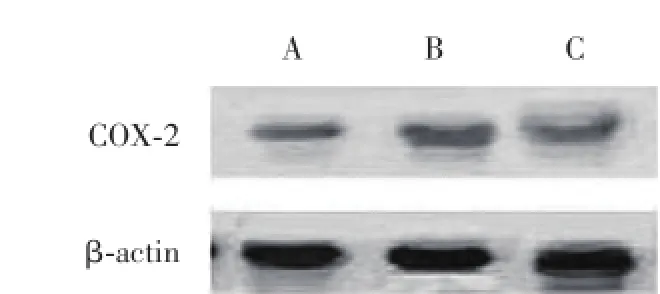
图2 Western blot检测COX-2的表达Fig.2 The expression of COX-2 determined by Western blot

图3 RT-PCR方法检测COX-2mRNA的表达Fig.3 The expression of COX-2mRNA analyzed by RT-PCR
3 讨论
脑胶质瘤起源于神经间质细胞,是最常见的颅内原发性肿瘤,占成人所有恶性肿瘤的2%,具有浸润性生长、易复发、侵袭性强、血管丰富等恶性生物学特征。胶质瘤的发病原因目前尚不清楚,但有证据表明胶质瘤的形成与一定的内环境改变和基因变异有关,是一个多因素、多步骤的多种癌基因失调及抑癌基因缺失导致的信号转导失调的协同积累过程[4]。近年来,一些与胶质瘤发生、发展密切相关的异常信号通路成为研究热点[6]。
ERK信号通路是普遍存在于真核细胞的一条高度保守的细胞信号传导通路,该信号传导通路的异常激活与多种肿瘤的发生及恶性进展密切相关。ERK受体信号转导途径其级联中一般包括Ras、Raf、MAPKK和p42/44 MAPK(ERK1/ERK2)。ERK有两条主要激活途径:(1)经受体酪氨酸激酶途径激活ERK:Ras活化Raf,Raf作为MAPKK将MEK磷酸化激活,进而使ERK磷酸化活化;(2)G蛋白耦联受体途径:配体与膜上G蛋白耦联受体结合引起受体构型改变,激活磷脂酶C,使磷脂酰胺醇4、4二磷酸水解生成三磷酸肌醇和二酰基甘油。二酰基甘油激活蛋白激酶C,通过Ras或不依赖Ras激活ERK[7]。研究发现,Ras/Raf/MEK/ERK信号通路的异常激活几乎见于所有胶质瘤中,与胶质瘤的发生、发展及其恶性生物学特性密切相关,抑制该信号通路可能成为干预胶质瘤的有效措施[8~10]。
环氧化酶是由2种基因型即COX-1和COX-2组成的催化前列腺素合成的限速酶。其中COX-2在大多数组织正常生理条件下并不存在,仅在细胞受到刺激时迅速合成,催化花生四烯酸产生多种前列腺素类物质,通过多种途径参与包括炎症、肿瘤等多种病理生理过程。
COX-2是花生四烯酸代谢、前列腺素和血栓素A2生物合成过程中重要的诱导性酶,在正常生理状态下几乎不表达或甚少表达,具有广泛的生理功能,对炎性反应、肿瘤的发生发展、炎性疼痛、血管生成及栓塞和骨代谢等都具有重要的作用。研究发现,乳腺癌、前列腺癌、结肠癌、肺癌、头颈部肿瘤、膀胱癌、淋巴瘤等多种肿瘤组织中均可见COX-2过度表达[11~13],可见COX-2过度表达与肿瘤的发生、发展密切相关。COX-2过度表达可抑制肿瘤细胞凋亡,促进肿瘤细胞的过度增殖,使细胞增殖和凋亡之间的平衡失调,从而促进肿瘤恶性行为的发生。研究认为其可能机制有:(1)COX-2的催化产物前列腺素E2能增加凋亡抑制蛋白Bcl-2的表达,从而抑制肿瘤细胞的凋亡[14];(2)促进Survivin基因产生凋亡抑制蛋白,从而抑制细胞凋亡,加速肿瘤细胞生长[14];(3)降低神经酰胺水平,神经酰胺是众所周知的死亡信号,因此神经酰胺水平下降可促进肿瘤细胞死亡;(4)影响一氧化氮通路,COX-2催化产物前列腺素E2可通过减弱和抑制一氧化氮途径抑制细胞凋亡。
研究表明,缓激肽能够通过B2受体诱导COX-2mRNA和蛋白的表达介导炎性反应,MAPK家族的p38MAPK和ERKl/2通过调节COX-2的表达调节炎症信号从细胞膜到细胞核的传递[16]。本研究利用显微注射C6胶质瘤细胞制作大鼠脑胶质瘤模型,检测发现脑胶质瘤组大鼠COX-2蛋白及mRNA表达显著高于对照组,结果说明COX-2可能在脑胶质瘤的发生发展中发挥着重要作用,但是ERK是否能够通过COX-2的表达参与神经胶质瘤的病理机制尚不清楚。
为了进一步研究ERK信号通路对COX-2的作用,我们通过泵入ERK抑制剂U0126阻断ERK信号通路,进一步检测COX-2的表达变化。结果发现,与胶质瘤组相比,ERK抑制剂组大鼠胶质瘤COX-2蛋白及mRNA表达水平显著降低。结果提示,ERK很可能通过调节其下游蛋白COX-2参与神经胶质瘤的病理机制。综上所述,本研究结果有利于更好地指导神经胶质瘤治疗策略的制定。
[1]Chi AS,Sorensen AG,Jain RK,et al.Angiogenesis as a therapeutic target in malignant gliomas[J].Oncologist,2009,14(6):621-636.
[2]Hjelmeland AB,Lattimore KP,Fee BE,et al.The combination of novel low molecular weight inhibitors of RAF(LBT613)and target of rapamycin(RAD001)decreases glioma proliferation and invasion[J].Mol Cancer Ther,2007,6(9):2449-2447.
[3]Sathornsumetee S,Hjelmeland AB,Keir ST,et al.AAL881,a novel small molecule inhibitor of RAF and vascular endothelial growth factor receptor activities,blocks the growth of malignant glioma[J]. Cancer Res,2006,66(17):8722-8730.
[4]李振,刘云会,薛一雪,等.内皮—单核细胞激活多肽酶Ⅱ增强血肿瘤屏障通透性的机制[J].解剖科学进展,2012,18(1):34-39.
[5]Hambardzumyan D,Squatrito M,Carbajal E,et al.Glioma formation,cancer stem cells,and akt signaling[J].Stem Cell Rev,2008,4(3):203-210.
[6]丛子翔,王汉东.Ras/Raf/Mek/Erk信号通路在胶质瘤中的研究进展[J].中国微侵袭神经外科杂志,2012,17(9):430-434.
[7]Inagami T,Eguchi S,Numaguchi K,et al.Cross-talk between angiotensinⅡreceptors and the tyrosine kinases and phosphatases[J].J Am Soc Nephrol,1999,10(Suppl 11):S47-S61.
[8]Lyustikman Y,Momota H,Pao W,et al.Constitutive activation of Raf-1 induces glioma formation in mice[J].Neoplasia,2008,10(4):401-410.
[9]Robinson JP,Vanbrocklin MW,Lastwika KJ,et al.Activated MEK cooperates with Ink4a/Arf loss or Akt activation to induce gliomas in vivo[J].Oncogene,2011,30(11):1341-1340.
[10]Nakada M,Kita D,Watanabe T,et al.Aberrant signaling pathways in glioma[J].Cancers,2011,3(3):3242-3278.
[11]Zha S,Yegnasubramanian V,Nelson WG,et a1.Cyclooxygenases in cancer:progress and perspective[J].Cancer Lett,2004,214(1):1-20.
[12]Nie D.Cyclooxygenases and lipoxygenases in prostate and breast cancers[J].Front Biosci,2007,12:1474-1484.
[13]李杰,郝洪岭,薛丽英,等.Cox-2、bcl-2、caspase-3在弥漫大B细胞淋巴瘤中表达的意义[J].白血病·淋巴瘤,2009,18(4):223-224.
[14]王鲁建,孙丽梅.肺癌组织中COX-2和Bcl-2蛋白的相关性及对预后的影响[J].中国组织化学与细胞化学杂志,2007,16(3):308-311.
[15]张惠忠,魏益平,华平,等.Survivin蛋白在非小细胞肺癌组织表达及与COX-2蛋白的关系[J].中国热带医学,2006,6(10):1774-1777.
[16]Lee SJ,Lim KT.Inhibitory effect of 30 kDa phytoglycoprotein on expression of TNF-alpha and COX-2 via activation of PKCalpha and ERK 1/2 in LPS-stimulated RAW 264.7 cells[J].Mol Cell Biochem,2008,317(1-2):141-149.
(编辑 陈姜)
EffectofExtracellular Signal-regulated Kinase on Cyclooxygenase-2 Expression in Glioma
WANGChong1,WUPeng-fei2,WANGMing-hao2,LIUJi-yuan2
(1.Department of Neurosurgery,The Fourth People′s Hospital of Shenyang City,Shenyang 110031,China;2.Department of Neurosurgery,The First Hospital,China MedicalUniversity,Shenyang 110001,China)
ObjectiveTo study the effectofextracellularsignal-regulated kinase(ERK)on the expression ofcyclooxygenase-2(COX-2)in glioma.MethodsA total of 60 rats were randomly divided into control group,glioma group and ERK inhibitor group(n=20 each group).The expression ofCOX-2 protein was detected by and Western blotand immunohistochemistry.The expression ofCOX-2mRNA was detected by RT-PCR.Re⁃sultsThe results of immunohistochemistry Western blot showed that the expression level of COX-2 in rats of glioma group was higher than control group(P<0.01).Compared with glioma group,the expression of COX-2 was significantly decreased in rats of ERK inhibitor group.The level ofCOX-2mRNA in rats of glioma group was higher than the control group(P<0.01).Compared with glioma group,the expression ofCOX-2mRNA in rats of ERK inhibitor group was significantly decreased detected by RT-PCR(P<0.01).ConclusionERK could up-regulate the expression ofCOX-2in glioma.
extracellular signal-regulated kinase;cyclooxygenase-2;glioma;rat
R730.264
A
0248-4646(2014)04-0333-04
辽宁省博士科研启动基金(20131149)
王翀(1976-),男,副主任医师,本科. E-mail:wangchong197644@126.com
2013-12-29
网络出版时间:
