低强度脉冲超声促进不同接种密度骨髓间充质干细胞增殖的实验研究
2014-03-21于海生王宁
于海生,王宁
(1.重钢总医院超声科,重庆400084;2.重庆市肿瘤医院超声科,重庆400030)
低强度脉冲超声促进不同接种密度骨髓间充质干细胞增殖的实验研究
于海生1,王宁2
(1.重钢总医院超声科,重庆400084;2.重庆市肿瘤医院超声科,重庆400030)
目的探讨低强度脉冲超声(LIPUS)促进骨髓间充质干细胞(BMSCs)增殖的可行性及筛选骨髓间充质干细胞适宜的接种密度。方法选取体外培养第3代兔骨髓间充质干细胞接种至20块6孔板,接种密度分别为4×103/mL,1×104/mL,2×104/mL,4×104/mL,8×104/mL。选用频率0.6 MHz,强度为0.2 W/cm2的LIPUS每天分别辐照10 min。辐照前、辐照1 d、2 d、3 d、4 d、4 d后观察细胞生长情况。MTT法检测LIPUS辐照后各密度组细胞增殖活性并绘制OD值曲线。结果BMSCs经过LIPUS辐照后,较空白对照组细胞集落更为密集,细胞分裂增殖活性明显活跃。其中以接种密度为2×104/mL辐照后BMSCs增殖活性曲线更加稳定,细胞增殖活性明显高于空白对照组(P<0.04)。结论LIPUS辐照一定时间后能够促进BMSCs增殖,不同的接种密度的骨髓间充质干细胞增殖活性不一,其中接种密度为2×104/mL细胞增殖活性曲线更加稳定,为更加适宜的接种密度。
低强度脉冲超声;骨髓间充质干细胞;细胞接种密度;细胞增殖
目前骨髓间充质干细胞(bone mesenchymal stem cells,BMSCS)体外培养增殖速度慢,培养条件复杂,使其在组织工程学和医学细胞增殖治疗学发展受到很大限制[1],同时细胞培养接种密度及生长空间对细胞生长有很大影响作用。因此寻找一种安全高效的技术手段和选择适宜的接种密度对体外扩增BMSCs增殖越来越重要。低强度脉冲超声具有促进细胞快速增殖生物学特殊作用使其应用越来越受到重视[2]。本实验通过低强度脉冲超声促进兔BMSCs增殖效应的研究,探讨LIPUS体外促进BMSCs增殖的可行性,同时筛选后续实验BMSCs适宜的接种密度。
1材料与方法
1.1 材料
实验动物新西兰大白兔,兔龄3个月,清洁级,体质量2~2.4 kg,由重庆医科大学动物中心提供。主要试剂α-MEM培养基(Hyclone公司,美国),胎牛血清(Gibco公司,美国),percoll分离液(Pharmacia公司,美国),四甲基偶氮唑蓝(MTT)(Sigma公司,美国),六孔板(Sigma公司,美国)。
主要仪器低强度脉冲超声仪(重庆海扶,中国),全自动酶标读数仪ELX800(Bio-Tek公司,奥地利)。
1.2 方法及内容
1.2.1 BMSCs的分离、纯化及扩增:具体方法和步骤见文献[3]。
1.2.2 LIPUS辐照不同接种密度BMSCs:将体外分离培养第3代的BMSCs分别以4×103/mL,1×104/mL,2×104/mL,4×104/mL,8×104/mL接至20块6孔板中,每个密度组4块板,每块板各孔接种密度相同,第一排3个孔为低强度脉冲超声辐照组(LIPUS组),另外3个孔为空白对照组。辐照方式为每块板培养24 h待细胞贴壁后,采用辐照探头涂适当耦合剂紧贴6孔板底部进行照射。LIPUS选取辐照强度为0.2 W/cm2,每天辐照10 min[3],辐照后各密度组细胞立即换新鲜培养液继续培养。空白对照组进行超声假照处理。
1.2.3 细胞形态学观察:观察记录各接种密度BMSCs辐照前、辐照后1~4 d细胞生长、增殖及形态特征与空白对照组比较变化。
1.2.4 MTT检测细胞增殖活性:常规MTT法检测BMSCs增殖活性,具体方法和步骤见实验研究[3]。酶标仪在490 nm波长处测量OD值,并绘制各密度组BMSCs的吸光度曲线,观察比较各密度组和空白对照组OD值变化走向趋势。
1.3 统计学分析
使用SPSS12.0软件对数据进行整理和分析。组间比较单因素方差分析或studentt检验对数据进行分析,P<0.04为有统计学差异。
2 结果
2.1 观察各接种密度组细胞生长情况
辐照前各密度组BMSCs贴壁后均呈长梭形分布生长。随着LIPUS辐照时间延长,各密度组的细胞生长情况不尽相同。(1)4×103/mL密度组:辐照后各天2组细胞生长均呈散在分布,未见明显细胞集落,无明显差异;(2)1×104/mL密度组:辐照1 d后LIPUS组BMSCs即形成小簇状增生,而空白对照组细胞呈单个贴壁生长。辐照2 d后LIPUS组BMSCs团簇状集落开始增多,而空白对照组细胞簇状呈散在分布。辐照3 d后2组细胞集落均呈漩涡状排列生长,但LIPUS组细胞排列更加紧密,细胞集落更多。辐照4 d后2组细胞生长集落均较为丰富。辐照4 d后镜下观察2组细胞生长情况基本相似;(3)2×104/mL密度组:辐照后1,2,3,4,4 d LIPUS组细胞分裂增殖活性均较空白对照组明显活跃,细胞体积较大,细胞生长速度明显加快,细胞排列紧密,呈漩涡状,细胞集落更加密集,某些细胞集落细胞呈紧密重叠排列,但未观察到细胞间互相接触抑制情况。镜下观察各密度组细胞,其中以2×104密度组细胞生长变化更为显著;(4)4×104/mL密度组:LIPUS组于辐照后1 d、2 d细胞分裂增殖活性更加活跃,细胞集落排列更加紧密,但3~4 d两组未见明显差异;(4)8×104/mL密度组:辐照后1 d~4 d两组细胞生长未见明显差异,均成簇状排列紧密生长、周围细胞卷曲生长,细胞老化严重(图1)。
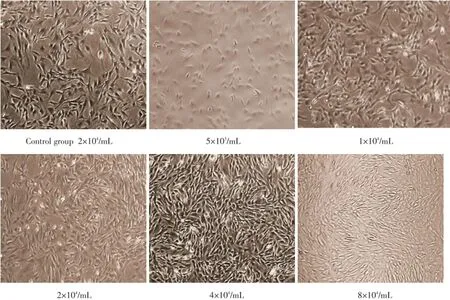
图1 各密度组辐照后5 d BMSCs×100Fig.1 BMSCs of different seeding density groups 5 d post-irradiation×100
2.2 MTT法检测细胞增殖活性及绘制细胞增殖曲线
4×103/mL组:两组BMSCs增殖活性比较在各天均无统计学差异(P>0.04);1×104/mL组:辐照0 d、1 d、4 d后LIPUS组和空白对照组细胞增殖活性比较无统计学差异(P>0.04),2 d、3 d、4 d LIPUS组细胞增殖活性高于空白对照组,差异有统计学意义(P<0.04);2×104/mL组:辐照1,2,3,4,4 d后LIPUS组细胞增殖活性均明显高于空白对照组,差异有统计学意义(P<0.04);4×104/mL组:LIPUS组和空白对照组细胞增殖活性比较在0 d、2~4 d无统计学差异(P>0.04),辐照1 d后LIPUS组细胞增殖活性高于空白组,差异有统计学意义(P<0.04);8×104/mL组:LIPUS组和空白对照组细胞增殖活性无统计学差异(P>0.04,图2)。

图2 各密度组LIPUS组和空白对照组细胞增殖活性曲线Fig.2 The cell proliferation activity curves of LIPUS and control groups with different seeding density
2.3 LIPUS促进兔BMSCs增殖的适宜接种密度
通过观察各密度组细胞生长情况及细胞增殖活性曲线,其中以2×104/mL组BMSCs增殖曲线较稳定,变化趋势与空白对照组比较基本相同,辐照后1,2,3,4,4 d细胞增殖活性明显高于空白对照组,有统计学差异(P<0.04)。
3 讨论
目前随着低强度脉冲超声研究逐渐深入,LIPUS能够促进多种细胞的增殖,其在细胞生物学领域的安全高效的作用越来越得到重视[4~6]。同时LIPUS在医学领域中已经应用于临床上骨与软组织损伤的治疗,效果十分显著[7,8]。
近些年来,骨髓间充质干细胞已成为组织工程学及临床组织修复、替代治疗学理想的种子细胞,BMSCs具有多向分化潜能,可在不同细胞诱导因子调节下定向分化成为多种组织细胞[9,10]。但随着研究不断深入,很多学者发现BMSCs采用常规培养增殖速度无法满足实验研究和临床应用需求,并且采取了很多技术手段来体外扩增BMSCs,但是效果都不够理想[11]。因此,如何体外大规模扩增BMSCs来满足其发展的需求已成为首要课题。
细胞接种密度及生长空间对细胞生长快慢有很大的影响,适宜的生长密度有利于细胞的快速增殖,接种密度过小,细胞生长缓慢,接种密度过大,影响细胞伸展生长,细胞容易老化,增殖能力下降[12]。同时,由于受到培养瓶底板面积的限制,适宜的BMSCs接种密度更能说明实验结果的准确性和客观性。因此筛选LIPUS辐照BMSCs适宜的接种密度是十分必要的,可为后续实验提供技术依据。
由此,本研究应用前期实验筛选出最佳参数的LIPUS辐照不同接种密度的BMSCs。辐照后各天镜下观察不同接种密度细胞生长增殖情况,接种密度2×104/mL细胞增殖活性较其他密度组和空白对照组明显活跃,细胞生长集落更加密集,排列紧密;MTT法检测细胞增殖活性结果提示辐照后2×104/mL密度组细胞增殖活性明显高于空白对照组(P<0.04)。通过观察2×104/mL密度组增殖曲线,我们可以看出经过LIPUS辐照后的细胞增殖活性曲线和对照组细胞增殖活性曲线变化趋势基本相同,相比其他密度组细胞增殖活性曲线变化趋势更加稳定,说明接种密度2×104/mL是LIPUS促进BMSCs增殖适宜的接种密度。
综上所述,低强度脉冲超声能够明显促进体外分离培养骨髓间充质干细胞增殖,接种密度2×104/mL相比其他密度组BMSCs增殖更加活跃稳定,是适宜的接种密度。
[1]Mohammadian M,Shamsasenjan K,Lotfi Nezhad P,et al.Mesenchymal stem cells:new aspect in cell-based regenerative therapy[J]. Adv Pharm Bull,2013,3(2):433-437.
[2]Lv Y,Zhao P,Chen G,et al Effects of low-intensity pulsed ultrasound on cell viability,proliferation and neural differentiation of induced pluripotent stem cells-derived neural crest stem cells[J]. Biotechnol Lett,2013,34(9):2201-2212.
[3]于海生,陈文直,王嫣,等.不同参数低强度脉冲超声促进骨髓间充质干细胞增殖的实验研究[J].中国超声医学杂志,2011,27(11):967-970.
[4]Xu P,Gul-Uludag H,Ang WT,et al.Low-intensity pulsed ultrasound -mediated stimulation of hematopoietic stem/progenitor cell viability,proliferation and differentiation in vitro[J].Biotechnol Lett,2012,34(10):1964-1973.
[5]Li L,Yang Z,Zhang H,et al.Low-intensity pulsed ultrasound regulates proliferation and differentiation of osteoblasts through osteocytes[J].Biochem Biophys Res Commun,2012,418(2):296-300.
[6]Kinami Y,Noda T,Ozaki T.Efficacy of low-intensity pulsed ultrasound treatment for surgically managed fresh diaphyseal fractures of the lower extremity:multi-center retrospective cohort study[J].J Orthop Sci,2013,18(3):410-418.
[7]El-Bialy T,Alhadlaq A,Lam B.Effect of therapeutic ultrasound on human periodontal ligament cells for dental and periodontal tissue engineering[J].Open Dent J,2012,6:234-239.
[8]Ying ZM,Lin T,Yan SG.Low-intensity pulsed ultrasound therapy:a potential strategy to stimulate tendon-bone junction healing[J].J Zhejiang Univ Sci B,2012,13(12):944-963.
[9]Yue Y,Yang X,Wei X,et al.Osteogenic differentiation of adiposederived stem cells prompted by low-intensity pulsed ultrasound[J]. Cell Prolif,2013,46(3):320-327.
[10]Sudo K,Kanno M,Miharada K,et al,Mesenchymal progenitors able to differentiate into osteogenic,chondrogenic,and/or adipogenic cells in vitro are present in most primary fibroblast-like cell populations[J].Stem Cells,2007,24(7):1610-1617.
[11]Mueller SM,Glowacki J.Age-related decline in the osteogenic potential of human bone marrow cells cultured in three-dimensional collagen sponges[J].J Cell Biochem,2001,82(4):483-490.
[12]Eigenmann DE,Xue G,Kim KS,et al.Comparative study of four immortalized human brain capillary endothelial cell lines,hCMEC/ D3,hBMEC,TY10,and BB19,and optimization of culture conditions,for an in vitro blood-brain barrier model for drug permeability studies[J].Fluids Barriers CNS,2013,10(1):33.
(编辑 裘孝琦)
ExperimentalStudy on the Effectsof Low-intensity Pulsed Ultrasound on the Proliferation of Bone MesenchymalStem CellsatDifferent Densities
YUHai-sheng1,WANGNing2
(1.Department of Ultrasound,The General Hospital of Chongqing Steel Company,Chongqing 400084,China;2.Department of Ultrasound,Chongqing Cancer Hospital,Chongqing 400030,China)
ObjectiveTo investigate the feasibility of promoting bone mesenchymal stem cells(BMSCs)proliferation by low intensity pulsed ultrasound(LIPUS),and screen out the suitable seeding density of BMSCs.MethodsRabbit BMSCs(P3)were seeded in 20 6-well plates and divided into 4 groups according to their seeding density:4×103/mL,1×104/mL,2×104/mL,4×104/mL,8×104/mL.The cells received LIPUS at intensity of 0.2 W/cm2and frequency of 0.6 MHz for 10 min every day.Cell growth was observed under light microscope.Proliferation activity was determined by MTT and the curve of OD pre-irradiation and 1 d,2 d,3 d,4 d,4 d post-irradiation was determined.ResultsCell proliferation of LIPUS groups was significantly more active than that of the control-group with more intensive cell colonies formed in LIPUS groups post-irradiation.The cell proliferation activity was significantly higher than that in the control group(P<0.04)and the curve of proliferation activity was more stable with seeding density of 2×104/mL after irradiation of LIPUS.ConclusionsLIPUS can promote proliferation of BMSCs.The proliferation activity is different with the seeding density ofBMSCs.The seeding density of2×104/mL is more suitable.
low-intensity pulsed ultrasound;bone mesenchymal stem cells;cell seeding density;cell proliferation
R318
A
0248-4646(2014)04-0344-04
于海生(1984-),男,硕士研究生.
王宁,E-mail:43729046@qq.com
2013-12-30
网络出版时间:
