大鼠谷氨酰胺转运蛋白EGFP-SNAT3融合蛋白的表达与鉴定
2014-03-20闵伟勇
李 敏,闵伟勇,张 舟
(1.上海师范大学 生命与环境科学学院,上海 200234;2.沈阳药科大学 生命科学与生物制药学院,沈阳 110016)
0 引 言
Na+依赖的中性氨基酸转运蛋白(Sodium-coupled Neutral Amino Acid Transporters,SNATs)属于SLC38基因家族.根据功能特性和调控模式,SLC38家族分为System A和System N两个亚型,其中SNAT1、SNAT2、SNAT4属于System A;SNAT3、SNAT5属于System N[1-4].SNAT1和SNAT3是SLC38家族中首先发现的Na+偶联的中性氨基酸转运蛋白[4-6].除了SNAT4外,SLC38家族中的成员均偏爱转运L-谷氨酰胺[1].
谷氨酰胺(Glutamine,Gln)是人血浆中浓度最高的氨基酸[7],系统性的Gln缺乏将引起多系统疾病和致命的多器官功能衰竭[8].作为蛋白质的组成成分之一,Gln在胚胎的生长过程中有着多重作用[9].它参与了柠檬酸循环、核苷酸和蛋白质的生物合成以及氨代谢,也是神经递质γ-氨基丁酸(GABA)和抗氧化剂谷胱甘肽的前体物质[10].在大脑和肝脏中,由谷氨酰胺合成酶合成Gln是氨代谢中的关键环节[11].Gln通过谷氨酸-谷氨酰胺循环为大脑兴奋性神经递质谷氨酸的合成提供底物,参与大脑能量代谢,直接关系到大脑的兴奋性和抑制性调控[12-13].胎盘中也存在谷氨酸-谷氨酰胺循环,Gln从胎盘释放进入胎儿的血液循环,提供胎儿生长所需的氨基酸[14-15].Gln发挥以上这些作用均离不开转运蛋白的协助,而在Gln的摄取和释放过程中,SLC38家族的成员SNAT3扮演着关键角色.
SNAT3由SLC38A3基因编码,主要定位于星形胶质细胞的细胞质膜上[4,16],为 System N中的标志性成员.SNAT3对pH敏感[17],它通过反向转运一个H+的方式共转运氨基酸[4,18-20].研究发现,SNAT3和SNAT5共同起作用,在大脑中参与谷氨酸-谷氨酰胺循环,介导Gln从星形胶质细胞输出[5,16,20-21],这是胶质细胞和神经元之间谷氨酸-谷氨酰胺循环的关键一步.已有报道表明,SNAT3是Gln从星形胶质细胞输出的主要推动者[4,19].在伯格曼神经胶质细胞(BGC)中,SNAT3和GLAST/EAAT1相互作用,介导Gln的输出[22],这一生理过程也可以为抑制性神经递质GABA的生物合成提供Gln[23-24].SNAT3通过介导Gln的输出还参与了大脑、肝脏的氨解毒过程[4,5,25],以及大鼠肾脏的酸中毒反应[26].SNAT3在分离的人类原始滋养层细胞中也有表达,表达量会随后者分化成合胞体滋养层细胞而降低;胚胎发育早期,SNAT3可为胚胎提供Gln,并随妊娠的进展,其表达水平呈显著下降的趋势[7].
鉴于SNAT3在各种生理和病理活动中的重要性,深入探索SNAT3的结构和功能具有重要意义.目前,将一些标签蛋白与目的蛋白构建在一起,通过标签蛋白与目的蛋白的融合共表达来研究蛋白质的表达与定位的方法受到了越来越多研究者的亲睐.绿色荧光蛋白(Green Fluorescent Protein,GFP)最早从维多利亚水母体内克隆得到,大小为27 kDa,它在蓝光或紫外光的激发下可产生清晰明亮的绿色荧光,且荧光有抗光漂白作用,很容易与自身荧光区别.增强型绿色荧光蛋白(Enhanced Green Fluorescent Protein,EGFP)是一种优化的GFP的突变体,与GFP相比具有更强的荧光信号,是一种通用的分子标签.
本研究采用三片段连接的方法将EGFP连接到了真核生物表达载体pBK-CMVΔ-SNAT3中SNAT3的N端,构建了pBK-CMVΔ-EGFP-SNAT3重组质粒,通过检测EGFP而检测SNAT3的表达和定位.结果表明,EGFP-SNAT3融合蛋白能在HEK293T细胞中正常表达并正确定位于细胞膜上,为检测SNAT3在细胞膜上的表达与定位提供了一种新而有效的研究工具,并为今后进一步研究SNAT3的结构和功能奠定基础.
1 材料与方法
1.1 材 料
1.1.1 质粒,菌种和细胞株
pBK-CMV(Δ[1098-1300])-EGFP-SNAT2和pBK-CMV(Δ[1098-1300])-SNAT3(以下简称pBK-CMVΔ-EGFP-SNAT2和pBK-CMVΔ-SNAT3)质粒由本实验室保存;大肠杆菌DH5α感受态细胞购自天根生物技术有限公司;人体胚肾细胞(HEK293T/17,ATCC number CRL 11268)购自中科院生物化学和细胞生物学研究所细胞库.
1.1.2 工具酶和生化试剂
限制性内切酶BamHI-HF、EcoRI-HF、SacI、T4 DNA Ligase、CIP(去磷酸化酶)购自美国NEB公司;2×Taq MasterMix,无内毒素质粒大提试剂盒和琼脂糖凝胶DNA回收试剂盒购自天根生物技术有限公司;细胞培养基(DMEM)、胎牛血清(FBS)、0.25%Trypsin-EDTA(1×)购自美国Gibco公司;LipofectamineTM2000 Reagent购自美国Invitrogen公司;PVDF膜、ECL化学发光试剂盒购自美国Millipore公司;Cocktail蛋白酶抑制剂(PI)购自美国Roche公司;兔源抗GFP多克隆抗体,鼠源抗GAPDH单克隆抗体,HRP标记的羊抗兔IgG(H+L) 抗体和HRP标记的羊抗鼠IgG(H+L)抗体购自中科英沐公司;GeneRulerTM1 kb DNA Ladder(SM0311/2/3)和PageRuler Prestained Protein Ladder(SM0671/2)购自美国Fermentas公司 ;RIPA裂解液和Pierce®BCA Protein Assay Kit购自美国Thermo公司.本研究所用引物由上海生工生物工程有限公司合成,测序由上海杰李生物技术有限公司完成.
1.2 方 法
1.2.1 引物设计和PCR扩增
利用NEBcutter V2.0在线软件工具查得pBK-CMVΔ-SNAT3质粒中的单酶切位点BamHI、EcoRI和SacI,分别以pBK-CMVΔ-EGFP-SNAT2和pBK-CMVΔ-SNAT3质粒为模板,根据引物设计原则设计引物(表1).由于进一步克隆的需要,在扩增EGFP的上下游引物中分别引入限制性内切酶BamHI和EcoRI的酶切序列,在扩增SNAT3的上下游引物中分别引入限制性内切酶EcoRI和SacI的酶切序列.应用Taq MasterMix通过PCR扩增EGFP和SNAT3基因,扩增产物经1%琼脂糖凝胶电泳检测并回收.
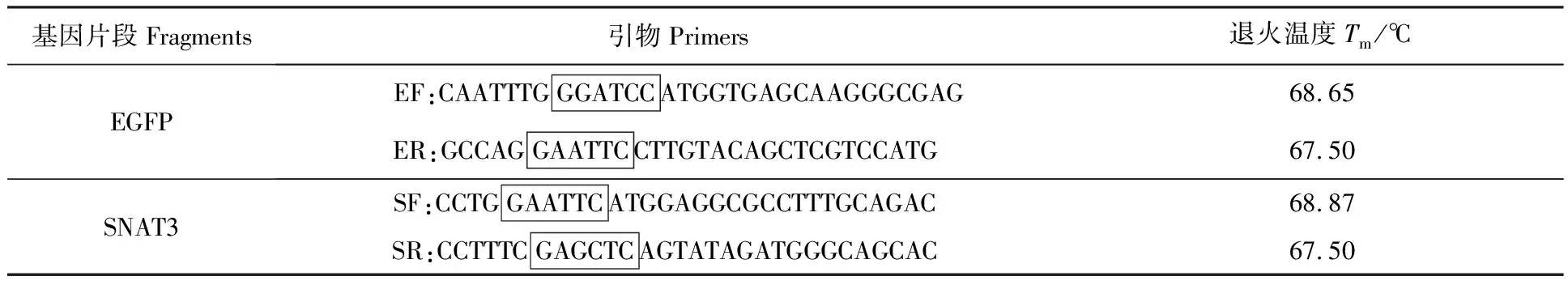
表1 PCR扩增基因的引物序列(5′-3′)
1.2.2 pBK-CMVΔ-EGFP-SNAT3重组质粒的构建与鉴定
PCR扩增得到的EGFP和SNAT3基因片段用琼脂糖凝胶DNA回收试剂盒回收纯化.EGFP进行BamHI-HF和EcoRI-HF双酶切反应;SNAT3进行EcoRI-HF和SacI双酶切反应;pBK-CMVΔ-SNAT3载体质粒进行BamHI-HF和SacI双酶切反应,并用碱性磷酸酶CIP去磷酸化1 h.分别对双酶切回收好的EGFP、SNAT3和载体大片段进行浓度测定,按照3∶3∶1的摩尔比在16 ℃下用T4 DNA Ligase连接10 h.将连接产物转化到大肠杆菌DH5α感受态细胞中,铺含Kan(30 μg/mL)的琼脂平板,37 ℃恒温培养箱中培养15 h后挑取大肠杆菌单菌落接种于含Kan(30 μg/mL)的LB培养基中,放入37 ℃摇床270 r/min条件下进行摇菌培养,并通过菌液PCR(引物见表1)初步鉴定.提取质粒DNA后经酶切和测序获得序列正确的pBK-CMVΔ-EGFP-SNAT3重组质粒.
1.2.3 Western blot检测重组质粒的表达
分别收集pBK-CMVΔ-SNAT3和pBK-CMVΔ-EGFP-SNAT3质粒瞬时转染36 h后的HEK293T细胞,用预冷的RIPA裂解液裂解细胞后,于4 ℃,1 500 r/min,离心15 min,收集上清液,即总蛋白.将上清液于4 ℃,35 000 r/min,离心30 min,弃上清后用蛋白重悬液(40 mmoL/L Tris-Hcl pH7.4,5 mmoL/L Mgcl2,0.4 mmoL/L EGTA)重悬沉淀即得膜蛋白.用BCA试剂盒测定蛋白浓度.取20 μg总蛋白和20 μg膜蛋白用10%SDS-PAGE进行电泳分离,将凝胶中蛋白转移至PVDF膜上,5%脱脂奶粉封闭1.5 h后用兔源抗GFP多克隆抗体(1∶6 500)和HRP标记的羊抗兔IgG二抗(1∶5 500)各孵育1.5 h,通过放射自显影检测EGFP-SNAT3融合蛋白的表达.同时用鼠源抗GAPDH单克隆抗体(一抗1∶3 000)检测GAPDH作为对照.
1.2.4 转染和激光扫描共聚焦显微镜检测蛋白表达
转染前,HEK293T细胞培养于37 ℃恒温培养箱中(DMEM+10%FBS,5% CO2),待细胞汇合度达到80%左右时,用脂质体转染法将构建好的pBK-CMVΔ-EGFP-SNAT3重组质粒DNA瞬时转染进HEK293T细胞中,同时转染pBK-CMVΔ-SNAT3质粒作为对照.质粒DNA与脂质体LipofectamineTM2000的比例为1∶3.转染36 h后,用Leica激光扫描共聚焦显微镜(LSCM)观察荧光并拍照.
2 实验结果
2.1 重组质粒pBK-CMVΔ-EGFP-SNAT3的构建
图1为正确构建的重组质粒示意图,由CMV promoter启动EGFP-SNAT3融合基因在HEK293T细胞中的表达.分别以pBK-CMVΔ-EGFP-SNAT2和pBK-CMVΔ-SNAT3质粒为模板,用表1中的引物进行PCR扩增,获得EGFP和SNAT3基因片段.琼脂糖凝胶电泳显示PCR产物与EGFP和SNAT3的预期大小一致(图2A),分别约为729 bp和936 bp,阴性对照无条带.用限制性内切酶BamHI和SacI对pBK-CMVΔ-SNAT3质粒载体进行双酶切,获得一个大小约为5 692 bp的载体大片段和一个1 051 bp的小片段,电泳证实其大小正确(图2B).
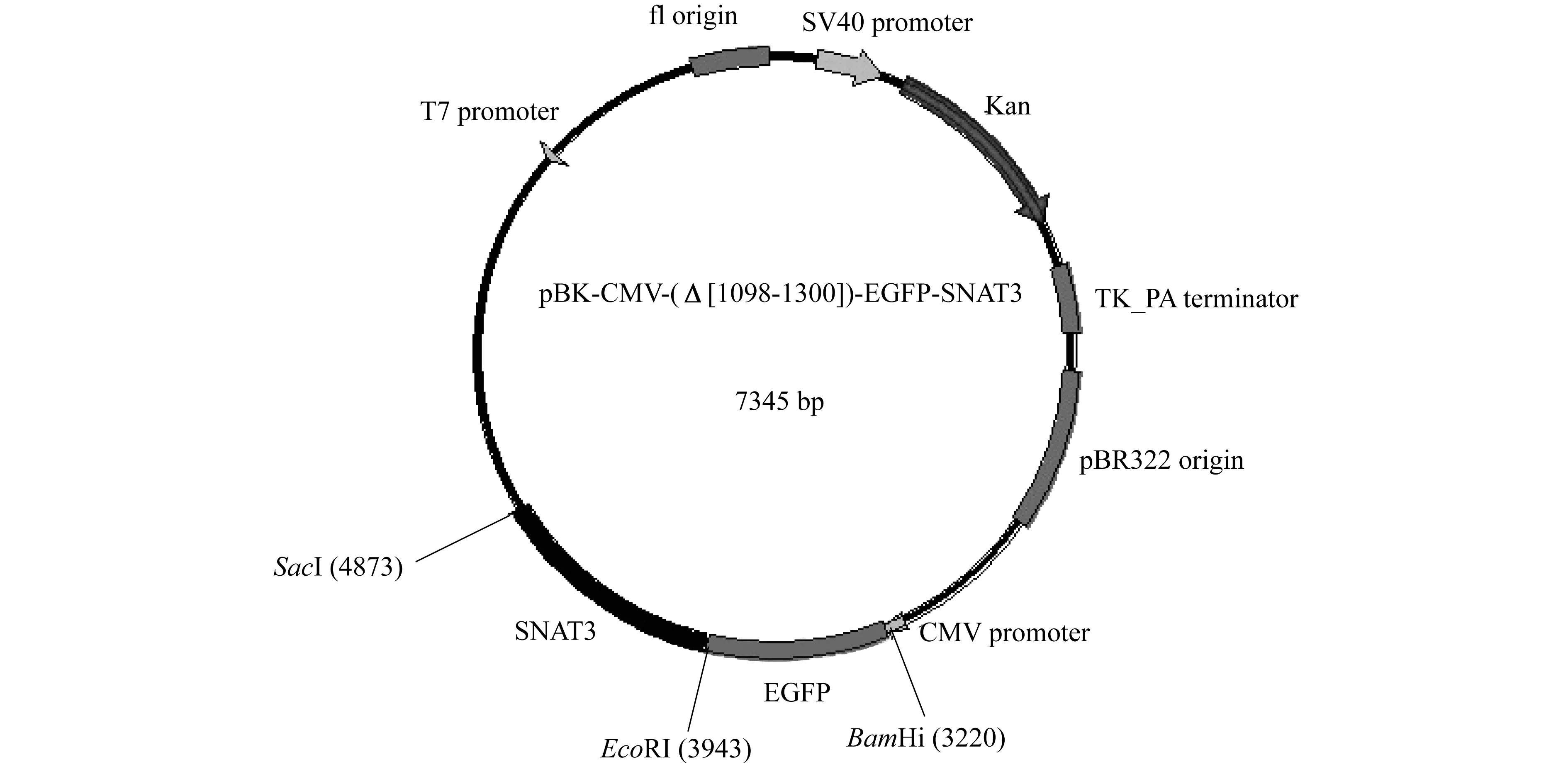
图1 重组质粒pBK-CMVΔ-EGFP-SNAT3(7 345 bp)图谱
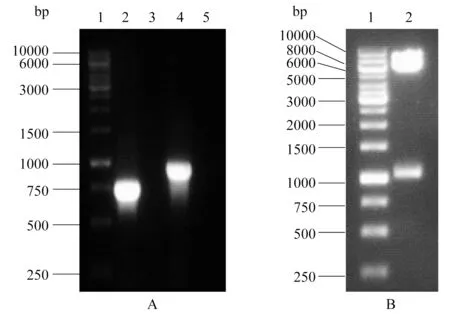
A:1:DL 10000 DNA Marker; 2:EGFP基因; 3:阴性对照; 4:SNAT3基因; 5:阴性对照; B:1:DL 10000 DNA Marker; 2:pBK-CMVΔ-SNAT3大片段(5 692 bp)和小片段(1 051 bp).
将PCR扩增得到的EGFP和SNAT3基因片段双酶切产物与载体大片段连接后转化至大肠杆菌DH5α感受态细胞中,利用Kanr筛选阳性转化菌落,并用不同引物(见表1)进行菌液PCR初步鉴定(图3A),获得了729、930和1 659 bp左右的片段,分别与EGFP、SNAT3和EGFP-SNAT3的大小一致.菌液PCR结果表明EGFP和SNAT3基因片段已连接到了pBK-CMV载体上.
提取质粒DNA后,通过酶切对pBK-CMVΔ-EGFP-SNAT3重组质粒做进一步验证(图3B).不同的酶切反应分别得到了大小约为5 692、930和723 bp的片段,长度分别与载体大片段、SNAT3和EGFP相符合.琼脂糖凝胶电泳结果表明,EGFP和SNAT3基因片段已插入到载体大片段中.经菌液PCR和酶切鉴定后,对获得的重组质粒pBK-CMVΔ-EGFP-SNAT3进行DNA测序,测序结果证明其序列完全正确.
2.2 EGFP-SNAT3融合蛋白的表达鉴定
2.2.1 Western blot检测重组质粒的表达
将pBK-CMVΔ-SNAT3质粒和构建好的pBK-CMVΔ-EGFP-SNAT3重组质粒用脂质体转染法瞬时转染进HEK293T细胞36 h后,收集细胞,用RIPA裂解法提取总蛋白,并在总蛋白的基础上用高速离心法进一步提取膜蛋白.通过10%SDS-PAGE电泳分离、转膜,利用抗GFP多克隆抗体检测EGFP-SNAT3融合蛋白在细胞膜上的表达,同时用抗GAPDH单克隆抗体检测GAPDH作对照.EGFP-SNAT3的融合蛋白的理论大小为82 kDa,Western blot结果显示的目的蛋白在55~90 kDa之间和40 kDa,对照组中总蛋白和膜蛋白均未见任何特异性条带(结果见图4),由此可以说明EGFP-SNAT3在细胞内及细胞膜上正常表达和定位.
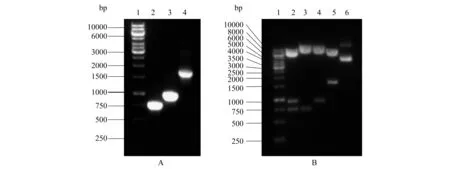
A:1:DL 10000 DNA Marker; 2:PCR扩增片段(引物EF、ER); 3:PCR扩增片段(引物SF、SR); 4:PCR扩增片段(引物EF、SR); B:1:DL 10000 DNA Marker; 2:BamHI/EcoRI/SacI三酶切pBK-CMVΔ-EGFP-SNAT3; 3:BamHI/EcoRI双酶切pBK-CMVΔ-EGFP-SNAT3; 4:EcoRI/SacI双酶切pBK-CMVΔ-EGFP-SNAT3; 5:BamHI/SacI双酶切pBK-CMVΔ-EGFP-SNAT3; 6:pBK-CMVΔ-EGFP-SNAT3.
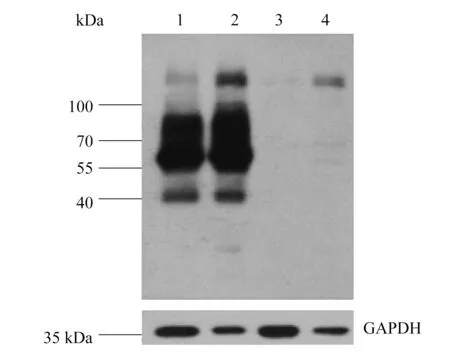
1:pBK-CMVΔ-EGFP-SNAT3瞬时转染HEK293T细胞的总蛋白; 2:pBK-CMVΔ-EGFP-SNAT3瞬时转染HEK293T细胞的膜蛋白; 3:对照:pBK-CMVΔ-SNAT3 瞬时转染HEK293T细胞的总蛋白; 4:对照:pBK-CMVΔ-SNAT3 瞬时转染HEK293T细胞的膜蛋白.
2.2.2 激光扫描共聚焦显微镜检测重组质粒的表达
用pBK-CMVΔ-SNAT3和pBK-CMVΔ-EGFP-SNAT3质粒DNA瞬时转染HEK293T细胞,取转染36 h后的培养皿在Leica LSCM下观察EGFP-SNAT3融合蛋白在细胞中的表达和定位.观察结果显示,在细胞膜上和内质网上均分布有绿色荧光(图5),说明重组质粒pBK-CMVΔ-EGFP-SNAT3构建成功,并在HEK293T细胞中正常表达,同时证明EGFP-SNAT3融合蛋白定位于细胞膜上.对照组未见任何荧光.
3 讨 论
SLC38家族转运蛋白在神经递质和氨基酸的转运及疾病治疗中表现出关键作用,引起了很多科研工作者对这一家族成员的关注和投入.对SLC38家族的研究已经持续了40多年,主要探求其在基因调控和蛋白转运过程中所承担的生理学角色[27].该家族转运蛋白现已被认为是肿瘤形成过程中的治疗靶点[1,28].本研究中在SLC38家族转运蛋白SNAT3的N端加入了EGFP标签,成功构建了pBK-CMVΔ-EGFP-SNAT3重组质粒,既可以用商业化的GFP多克隆抗体间接检测SNAT3的表达,又可以通过LSCM观测荧光的方法直接确定SNAT3在细胞膜上的表达和定位.将荧光蛋白与目的蛋白基因融合共表达来研究蛋白质的相关特性具有重要的生物学意义.GFP作为一种基因标志在生命科学研究中有着无限潜力,它与目的蛋白基因相融合后既能保持目的蛋白原有的活性,又不影响自身的发光能力,从而使之作为一种通用的融合分子标签被广泛应用于蛋白质的位置、活性和相互作用研究以及活细胞体内的示踪研究,并取得了较好的效果.目前,将免疫学相关技术应用于蛋白质的表达定位、结构和动力学特性等方面的研究方法也正在被很多科研工作者采用.Wang等[29]利用间接免疫荧光法确定了人类乳腺癌耐药蛋白(BCRP)的膜拓扑结构;有报道应用免疫组化和免疫共沉淀的方法阐明了SNAT3在BGC细胞中的表达定位及其在BGC细胞Gln释放过程中的生理学作用[22].
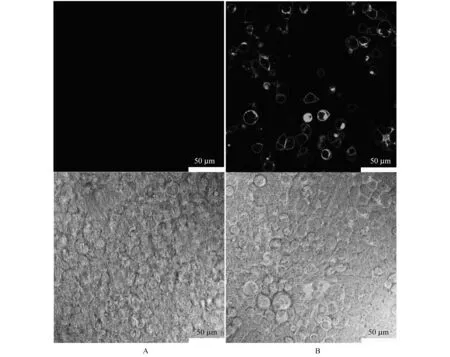
A:对照:pBK-CMVΔ-SNAT3转染的HEK293T细胞; B:pBK-CMVΔ-EGFP-SNAT3转染的HEK293T细胞.
与已有SNAT3结构和功能的相关研究中使用的方法不同,本研究首先采用PCR扩增和酶切连接技术将EGFP、SNAT3基因片段克隆到了真核生物表达载体pBK-CMV(Δ[1098-1300])中,从而构建了EGFP-SNAT3融合表达基因.实验中用菌液PCR、酶切以及DNA测序3种方法对重组质粒的构建进行了鉴定,并最终获得了EGFP正确连接于SNAT3上游的重组质粒pBK-CMVΔ-EGFP-SNAT3.通过激光扫描共聚焦显微镜技术和Western blot技术证实了EGFP-SNAT3融合蛋白能够在细胞中表达并正确定位于细胞膜上,其分子量大小为82 kDa,介于70 kDa和100 kDa之间.Western blot结果显示,在目的蛋白条带下方出现了两条特异性条带,第一条分子量大小在55 kDa和70 kDa之间,第二条在40 kDa左右,推测其可能是EGFP-SNAT3融合蛋白的N端在翻译及翻译后加工过程中形成的产物.Western blot结果显示的蛋白条带比较弥散的原因可能是该融合蛋白为糖蛋白或者是部分蛋白发生了降解.
目前,阐明SLC38家族转运蛋白在一些生理和病理过程中的功能、动力学特性和调控模式方面的材料日渐积累,但关于其结构和更多生物学意义方面的报道尚不多见.已有的研究预测了SNAT3的拓扑结构,显示其具有11个跨膜结构域,N端在细胞内侧而C端位于细胞外侧[30].pBK-CMVΔ-EGFP-SNAT3重组质粒的成功构建在为检测SNAT3在细胞膜上的表达和定位提供一条新途径的同时,也为今后结合免疫学、统计学或定点突变等技术深入研究SNAT3的精细结构和潜在的生物学功能提供借鉴,进而为临床诊断和疾病治疗提供依据.
参考文献:
[1] MACKENZIE B,ERICKSON J D.Sodium-coupled neutral amino acid(System N/A) transporters of the SLC gene family[J].Pflugers Arch-Eur J Physiol,2004,447:784-795.
[3] SHOTWELL M A,JAYME D W,KILBERG M S,et al.Neutral amino acid transport systems in Chinese hamster ovary cells[J].J Biol Chem,1981,256(11):5422-5427.
[4] CHAUDHRY F A,REIMER R J,KRIZAJ D,et al.Molecular analysis of system N suggests novel physiological roles in nitrogen metabolism and synaptic transmission[J].Cell,1999,99(7):769-780.
[5] GU S,RODERICK H L,CAMACHO P,et al.Identification and characterization of an amino acid transporter expressed differentially in liver[J].Proc Natl Acad Sci USA,2000,97(7):3230-3235.
[6] VAROQUI H,ZHU H,YAO D,et al.Cloning and functional identification of a neuronal glutamine transporter[J].J Biol Chem,2000,275(6):4049-4054.
[7] YOSHIKA C,YASUDA S,KIMURA F,et al.Expression and role of SNAT3 in the placenta[J].Placenta,2009,30(12):1071-1077.
[8] HABERLE J,GORG B,TOUTAIN A,et al.Inborn error of amino acid synthesis:human glutamine synthetase deficiency[J].J Inherit Metab Dis,2006,29(2-3):352-358.
[9] BELL A W,KENNAUGH J M,BATTAGLIA F C,et al.Uptake of amino acids and ammonia at mid- gestation by the fetal lamb[J].Q J Exp Physiol,1989,74(5):635-643.
[10] ALEDO J C,GóMEZ-FABRE P M,OLALLA L,et al.Identification of two human glutaminase loci and tissue-specific expression of the two related genes[J].Mamm Genome,2000,11(12):1107-1110.
[11] SUáREZ I,BODEGA G,FERNáNDEZ B.Glutamine synthetase in brain:effect of ammonia[J].Neurochem Int,2002,41(2-3):123-142.
[12] ROTHMAN D L,BEHAR K L,HYDER F,et al.In vivo NMR studies of the neurotransmitter flux and neuroenergetics:implications for brain function[J].Annu Rev Physiol,2003,65:401-427.
[14] CETIN I,DE SANTIS M S,TARICCO E,et al.Maternal and fetal amino acid concentrations in normal pregnancies and in pregnancies with gestational diabetes mellitus[J].Am J Obstet Gynecol,2005,192(2):610-617.
[15] BATTAGLIA F C.Glutamine and glutamate exchange between the fetal liver and the placenta[J].J Nutr,2000,130(4S Suppl):974S-977S.
[16] NAKANISHI T,SUGAWARA M,HUANG W,et al.Structure,function,and tissue expression pattern of human SN2,a subtype of the amino acid transport system N[J].Biochem Biophys Res Commun,2001,281(5):1343-1348.
[17] SIDORYK M,OBARA M,ALBRECHT J.Selective decrease of SN1(SNAT3) mRNA expression in human and rat glioma cells adapted to grow in acidic medium[J].Neurochem Int,2006,48(6-7):547-552.
[18] BRÖER A,ALBERS A,SETIAWAN I,et al.Regulation of the glutamine transporter SN1 by extracellular pH and intracellular sodiumions[J].J Physiol,2002,539(Pt 1):3-14.
[19] CHAUDHRY F A,KRIZAJ D,LARSSON P,et al.Coupled and uncoupled proton movement by amino acid transport system N[J].EMBO J,2001,20(24):7041-7051.
[20] NAKANISHI T,KEKUDA R,FEI Y J,et al.Cloning and functional characterization of a new subtype of the amino acid transport system N[J].Am J Physiol,2001,281(6):C1757-C1768.
[21] CUBELOS B,GONZáLEZ-GONZáLEZ I M,GIMéNEZ C,et al.Amino Acid Transporter SNAT5 Localizes to Glial Cells in the Rat Brain[J].GLIA,2005,49(2):230-244.
[22] MARTíNEZ-LOZADA Z,GUILLEM A M,FLORES-MéNDEZ M,et al.GLAST/EAAT1-induced Glutamine release via SNAT3 in Bergmann glia cells:evidence of a functional and physical coupling[J].J Neurochem,2013,125(4):545-554.
[23] BOULLAND J L,OSEN K K,LEVY L M,et al.Cell-specific expression of the glutamine transporter SN1 suggests differences in dependence on the glutamine cycle[J].Eur J Neurosci,2002,15(10):1615-1631.
[24] BOULLAND J L,RAFIKI A,LEVY L M,et al.Highly differential expression of SN1,a bidirectional glutamine transporter,in astroglia and endothelium in the developing rat brain[J].Glia,2003,41(3):260-275.
[25] FEI Y J,SUGAWARA M,NAKANISHI T,et al.Primary structure,genomic organization,and functional and electrogenic characteristics of human system N1,a Na+and H+coupled glutamine transporter[J].J Biol Chem,2000,275(31):23707-23717.
[26] KARINCH A M,LIN C-M,WOLFGANG C L,et al.Regulation of expression of the SN1 transport during renal adaptation to chronic metabolic acidosis in rats[J].Am J Physiol,2002,283(5):F1011-F1019.
[27] VAN WINKLE L J,CAMPIONE A L,GORMAN J M.Na+independent transport of basic and zwitterionic amino acids in mouse blastocysts by a shared system and by processes which distinguish between these substrates[J].J Biol Chem,1988,263(7):3150-3163.
[28] SCHIÖTH H B,ROSHANBIN S,HGGLUND M.Evolutionary origin of amino acid transporter families SLC32,SLC36 and SLC38 and physiological,pathological and therapeutic aspects[J].Molecular Aspects of Medicine,2013,34(2-3):571-585.
[29] WANG H,LEE E W,CAI X,et al.Membrane topology of the human breast cancer resistance protein(BCRP/ABCG2) determined by epitope insertion and immunofluorescence[J].J Biol Chem,2008,47(52):13778-13787.
[30] SCHNEIDER H P,BÖER S,BROER A,et al.Heterologous expression of the glutamine transporter SNAT3 in xenopus oocytes is associated with four modes of uncoupled transport*[J].J Biol Chem,2007,282(6):3788-3798.
