渍涝胁迫下抗坏血酸对玉米幼苗生长的影响
2014-03-19常云霞
张 菊,常云霞,杨 丹,周 琳
(1.周口师范学院 植物遗传与分子育种重点实验室,河南 周口466001;2.周口师范学院 生命科学与农学学院,河南 周口466001)
渍涝是影响全球作物分布和产量的主要生态因子之一[1].据估算,全球渍涝耕地约占总耕地的12%[2],中国发生渍涝的土地面积约为国土面积的2/3,其中超过3/4的受灾面积为黄淮平原和长江中下游平原两大粮食主产区,严重制约中国粮食的生产发展[3].玉米是中国重要的粮食作物,玉米需水量大但又不耐渍涝,在其生育期内极易受到由季风气候引起降雨而引发的渍涝胁迫.抗坏血酸(AsA)是植物体内一种水溶性抗氧化剂,直接参与体内超氧阴离子、单线态氧、过氧化氢等活性氧的清除,在提高植物抗逆性方面有着广泛的应用[4,5].研究表明,AsA具有提高植物对非生物逆境的抗性,如缓解高温对猕猴桃幼苗的伤害[6]、提高小麦及大豆的抗盐性[4,7].目前,外施AsA缓解渍涝胁迫对玉米幼苗生长影响的研究报道却较少.本实验以玉米幼苗为材料,研究了外源AsA对渍涝胁迫下玉米幼苗生长抑制的缓解效应及其机制,为建立新的抗渍涝胁迫调控方法奠定基础.
1 材料与方法
1.1 实验材料
供试材料为玉米郑单958品种,种子由河南省周口市种子公司提供.
1.2 实验设计
精选粒大饱满整齐一致的玉米种子,清除种子外包衣,用0.1%HgCl2表面消毒10min,蒸馏水反复冲洗5次,置于32℃恒温箱中浸种24h.浸种后,取300mm×200mm×50mm规格的托盘21个,分别铺两层滤纸加两层纱布(纱布起保水作用),每盘中播入饱满整齐一致的种子100粒.每天上午9点、下午5点分别用50mL处理液处理使滤纸保持湿润,处理液分别为0.1,0.2,0.3,0.4,0.5mmol/L AsA,每个浓度重复3次,进行幼苗生长实验,以蒸馏水培养作为对照1(CK1).培育15 d后,玉米长出3片子叶时,开始对玉米幼苗做渍涝胁迫处理,胁迫期间必须保证水淹没幼苗根部约2cm.以渍涝胁迫且未加AsA处理作为对照2(CK2).培养室内光照强度为4000~4500lx,恒温30℃,光/暗周期为14h/10h.胁迫处理5d后取样进行形态指标和生理指标的测定.
1.3 测定指标与方法
各处理浓度随机取30株幼苗,利用直尺分别测量其根长和株高[8].采用称重法测量玉米幼苗的鲜重以及干重.选取生长健壮的同一叶位(从顶部叶数第3片叶)功能叶,蒸馏水反复冲洗后,剪碎、混匀.可溶性糖含量采用蒽酮比色法测定[9],可溶性蛋白含量采用考马斯亮蓝G-250法测定[10],丙二醛含量采用硫代巴比妥酸法测定[9].过氧化氢酶(CAT)活性采用紫外吸收法测定,以每分钟吸光度减少0.1所需酶量为1个酶活力单位[10].POD活性采用愈创木酚法测定[10].
1.4 数据分析
所得数据均三次测量求平均值,并且采用Excel软件进行分析和作图.
2 结果与分析
2.1 渍涝胁迫下AsA对玉米幼苗生长的影响
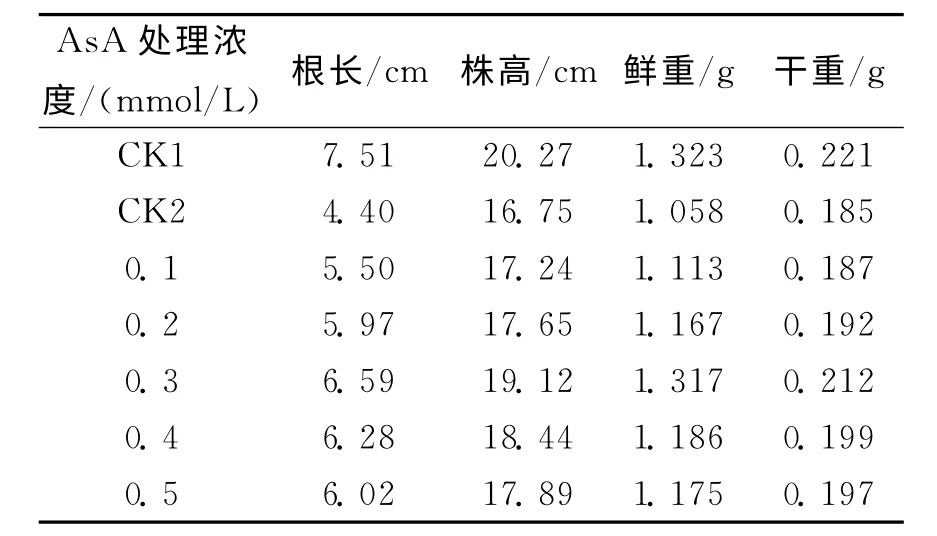
表1 渍涝胁迫下AsA对玉米幼苗生长的影响
表1为不同浓度AsA对渍涝胁迫下玉米幼苗生长的影响.由表1可知:渍涝胁迫下玉米生长受抑制,幼苗矮弱,根长、株高、鲜重和干重与CK1相比下降显著,其中幼苗根长降低41.4%,株高降低17.4%,鲜重降低20.0%,干重降低16.3%.外施不同浓度AsA后,玉米幼苗的株高、根长、鲜重和干重均有一定程度增加.与CK2相比,幼苗根长分别增 加25%,35.7%,49.8%,42.7%,36.8%;株高分别增加2.9%,5.4%,14.1%,10.1%,6.8%;鲜重分别增加5.2%,10.3%,24.5%,12.1%,11.1%;干重分别增加1.1%,3.8%,14.6%,7.6%,6.5%.这表明适宜浓度AsA处理能够减轻渍涝胁迫对植株生长的抑制作用,且效果随着AsA浓度的升高而增强.0.3mmol/L AsA处理组与CK2相比增强效果较明显,缓解效果相对最好.
2.2 渍涝胁迫下AsA对玉米幼苗叶片内可溶性糖含量的影响
可溶性糖是碳水化合物中能够直接运转和利用的主要形式,其含量的变化可反映植株体内碳水化合物的合成与运输的基本情况,在植物碳代谢中具有重要作用[11],且可溶性糖的变化大致能够反映植株碳素营养状况[12].图1为不同浓度AsA对渍涝胁迫下玉米幼苗叶片内可溶性糖含量的影响.由图1可知:渍涝胁迫下玉米幼苗叶片内可溶性糖含量与CK1相比增加3.3%.外施不同浓度AsA后,玉米幼苗叶片中可溶性糖含量与CK2相比明显增加,分别增加了17.5%,36.7%,72.7%,64.7%,40.7%.这表明AsA处理能明显提高渍涝胁迫下玉米幼苗体内可溶性糖含量,增强了玉米幼苗对渍涝胁迫的适应性.
2.3 渍涝胁迫下AsA对玉米幼苗叶片内可溶性蛋白含量的影响

图2 渍涝胁迫下AsA对玉米幼苗叶片内可溶性蛋白含量的影响
图2为不同浓度AsA对渍涝胁迫下玉米幼苗叶片内可溶性蛋白含量的影响.由图2可知:渍涝胁迫下玉米幼苗叶片内可溶性蛋白含量与CK1相比降低37.7%.外施不同浓度AsA后,玉米幼苗叶片中可溶性蛋白含量与CK2相比明显增加,与CK2相比分别增加了15.2%,24.0%,53.9%,38.9%,32.1%.这表明AsA处理能明显提高渍涝胁迫下玉米幼苗体内可溶性糖含量,增强了玉米幼苗对渍涝胁迫的适应性.
2.4 渍涝胁迫下AsA对玉米幼苗叶片内CAT活性的影响
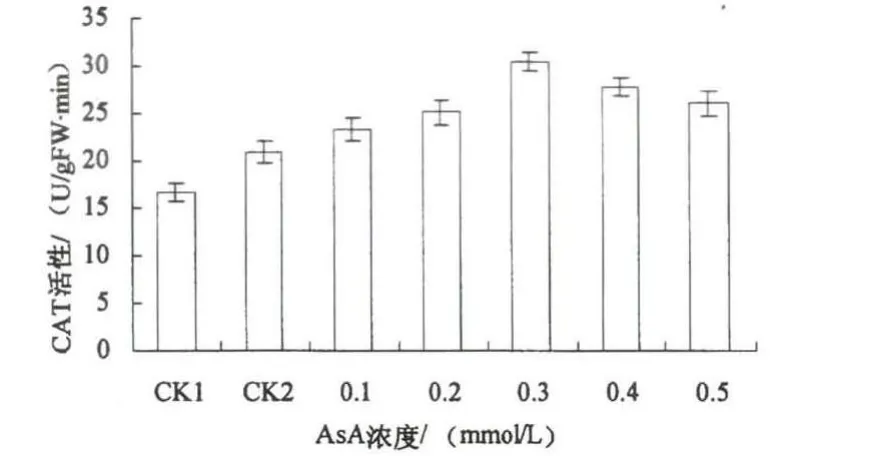
图3 渍涝胁迫下AsA对玉米幼苗叶片内CAT活性的影响
CAT是生物抗氧化系统的重要成员之一,在清除自由基方面发挥重要作用.图3为不同浓度AsA对渍涝胁迫下玉米幼苗叶片内CAT活性的影响.由图3可知:渍涝胁迫后玉米幼苗叶片内CAT活性增加,与CK1相比增加了25.5%.外施不同浓度AsA后,CAT活性随着AsA处理浓度增加呈现先增加后降低的趋势,与CK2相比CAT活性分别增加了11.4%,20.2%,45.7%,33.4%,24.8%.说明AsA能增加玉米幼苗体内的CAT活性,有效清除玉米体内的活性氧,从而减轻渍涝胁迫伤害.
2.5 渍涝胁迫下AsA对玉米幼苗叶片内POD活性的影响

图4 渍涝胁迫下AsA对玉米幼苗叶片内POD活性的影响
图4为不同浓度AsA对渍涝胁迫下玉米幼苗叶片内POD活性的影响.由图4可知:渍涝胁迫下玉米幼苗叶片内POD活性增加,与CK1相比增加了24.8%.外施不同浓度AsA后,POD活性随着AsA处理浓度增加呈现先增加后降低的趋势,与CK2相比POD活性分别增加了9.2%,22.9%,42.4%,33.2%,26.7%.说明AsA能有效增加玉米幼苗体内的POD活性,与CAT一起有效清除玉米体内的活性氧,减轻渍涝胁迫伤害.
2.6 渍涝胁迫下AsA对玉米幼苗叶片中MDA含量的影响
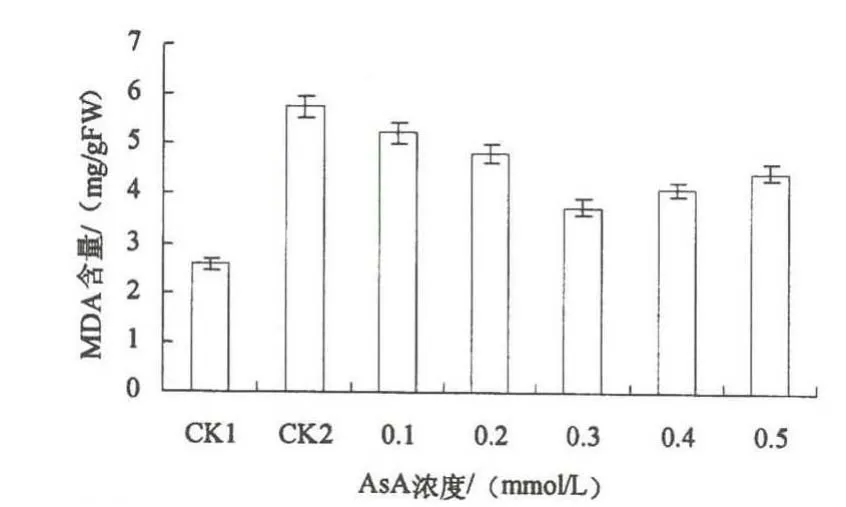
图5 渍涝胁迫下AsA对玉米幼苗叶片内MDA含量的影响
图5为不同浓度AsA对渍涝胁迫下玉米幼苗叶片中MDA含量的影响.MDA是膜脂过氧化的产物,其含量的变化可以衡量植物受伤害的程度[13].由图5可知:渍涝胁迫下MDA含量与CK1相比显著增加了122.9%,说明渍涝胁迫对玉米幼苗伤害程度很深.外施不同浓度AsA后,MDA含量随AsA浓度增加呈现先下降后上升的趋势,与CK2相比MDA含量分别下降了9.0%,15.8%,34.6%,28.3%,22.4%.说明AsA处理可以缓解渍涝胁迫对玉米叶片质膜伤害的程度,维持膜结构的稳定性.
3 讨论
水分过多对植物的危害并不在于水分本身,而是由于水分过多引起缺氧,使植物地上部分与根系的生长均受到阻碍[14].本实验结果表明,渍涝胁迫抑制了玉米幼苗地上部及根系的生长,表现在玉米幼苗株高、根长、单株鲜重、干重等指标显著低于对照.外施不同浓度AsA后,使玉米幼苗的株高、根长、单株鲜重及干重有所增加,从而缓解了渍涝胁迫的伤害作用.
植物体内可溶性蛋白质多为参与代谢的酶类,而且可溶性蛋白质大多是未与膜系统特异性结合的酶,其含量越高,植株的代谢活动与生理生化反应就越旺盛[15].可溶性糖是种子发芽过程中最重要的能量供应物质,其含量越高,能量供应越足[16].本实验表明,在渍涝胁迫下,经不同浓度AsA溶液处理后,玉米幼苗叶片中可溶性蛋白和可溶性糖含量均比对照组增加,说明适宜浓度AsA溶液处理提高了玉米幼苗体内可溶性糖和可溶性蛋白质的含量,促进了玉米幼苗的生长发育.
植物细胞内具有活性氧系统和活性氧清除系统(包括非酶促抗氧化剂和酶促抗氧化剂),在正常代谢条件下,活性氧(ROS)的产生与清除处于平衡状态,ROS保持在非伤害的低水平[14].逆境条件下ROS的产生与清除的平衡会被打破.渍涝胁迫引起O2-,H2O2等ROS活性增加,这些自由基的积累可导致蛋白质、核酸分子发生交联反应和变性,使MDA含量明显提高,破坏膜和生物大分子物质,最终导致细胞代谢失调而死亡[3].植物需动员活性氧清除系统抵抗渍涝胁迫诱导的氧化伤害,而清除系统中POD和CAT活性高低就成为控制伤害的决定因素[17,18].POD和CAT是植物体内分解H2O2的关键酶,使H2O2生成没有毒害的H2O,避免植物因H2O2的累积而造成伤害.所以,增加抗氧化酶活性,均可降低自由基含量,减少细胞膜损伤.本实验结果表明,渍涝胁迫下,玉米幼苗叶片中POD与CAT活性增强,并且AsA处理使两种酶活性进一步增强,及时清除ROS的积累,减少MDA的生成,从而减轻对植物的伤害.AsA缓解渍涝胁迫是一个复杂的调控系统,还需进一步探讨.
4 结论
综上所述,渍涝胁迫对玉米幼苗生长有很大程度的伤害作用.外施AsA后,促进了玉米幼苗的生长,使玉米幼苗叶片渗透调节物质含量增加.同时能诱导幼苗体内POD,CAT抗氧化酶的产生,及时清除ROS,使MDA含量下降,缓解氧化损伤,从而减轻渍涝胁迫对玉米幼苗的伤害,使玉米幼苗更好地适应渍涝环境.以0.3mmol/L AsA缓解效果相对较好.
[1]李林,刘登望,邹冬生,等.自然湿涝条件下花生种子主要性状与产量的相关性[J].中国油料作物学报,2008,30(1):62-70.
[2]李金才.小麦湿害生理及其与小麦生产力的相关性[J].植物生理学通讯,1997,33(4):304-312.
[3]葛均筑,展茗,赵明,等.渍涝胁迫对玉米生理生化的影响研究进展[J].中国农学通报,2012,28(21):7-11.
[4]常云霞,徐克东,李俐俐,等.抗坏血酸对大豆愈伤组织抗渗透胁迫的影响[J].大豆科学,2014,33(1):66-69.
[5]刘锴栋,敬国兴,袁长春,等.外源抗坏血酸对圣女果采后生理和抗氧化活性的影响[J].热带作物学报,2012,33(10):1851-1855.
[6]耶兴元,范宏伟,汪新娥.抗坏血酸对高温胁迫下猕猴桃苗抗热性相关生理指标的影响[J].植物生理学通讯,2009,45(3):267-269.
[7]常云霞,徐克东,周琳,等.抗坏血酸对盐胁迫下小麦幼苗生长抑制的缓解效应[J].麦类作物学报,2013,33(1):151-155.
[8]贾桂平,边大红,蔡丽君,等.土壤耕作方式对夏玉米抗茎倒伏能力的影响[J].华北农学报,2013,28(4):163-168.
[9]张志良.植物生理学实验指导[M].北京:科学出版社,2003.
[10]刘萍,李明军.植物生理实验技术[M].北京:科学出版社,2008.
[11]韩旭,宋述尧.矮生菜豆叶片衰老过程中碳氮代谢指标的变化[J].长江蔬菜,2009(10):42-44.
[12]刘浩荣,宋海星,刘代平,等.油菜茎叶可溶性糖与游离氨基酸含量的动态变化[J].西北农业学报,2007,16(1):123-126.
[13]湛灵芝,铁柏清,曾桂华.Cd2+、乙草胺单一及其复合污染对少根紫萍生理生化特性的影响[J].安全与环境学报,2013,13(3):9-13.
[14]王宝山.植物生理学[M].北京:科学出版社,2004:289.
[15]王保莉,杨春.环境因素对小麦苗期SOD、MDA及可溶性蛋白的影响[J].西北农业大学学报,2000,28(6):72-77.
[16]宋小林,刘强,宋海星,等.不同处理条件下油菜茎叶可溶性糖和游离氨基酸总量及其对籽粒产量的影响[J].西北农业学报,2010,19(6):187-191.
[17]Jiang Y,Huang B.Drought and heat stress injury to two cool season turf grasses in relation to antioxidant metabolism and lipid peroxidation[J].Crop Sci,2001(41):436-442.
[18]张智猛,戴良香,宋文武,等.干旱处理对花生品种叶片保护酶活性和渗透物质含量的影响[J].作物学报,2013,39(1):133-141.
