离子共存的知识点梳理与试题研究
2014-03-18杨孝会衷明华
杨孝会 衷明华
(韩山师范学院化学系,广东 潮州 521041)
一、知识梳理
1.离子共存
在同一溶液中,各离子不相互发生反应生成气体、沉淀、弱电解质、络合物等,则各离子在此溶液能共存。
2.离子不能大量共存的规律
(1)与H+不能大量共存的离子:OH-、弱酸根离子、弱酸酸式根离子(弱酸根离子和水反应生成弱酸,弱酸酸式根离子和H+反应生成相应的弱酸)。
(2)与OH-不能大量共存的离子:H+、大部分金属离子、弱酸酸式根离子、NH4+。
(3)与SO42-不能大量共存的离子:Ca2+、Ag+、Ba2+、Pb2+。
(4)与Cl-不能大量共存的离子:Ag+、Hg2+。
(5)与CO32-不能大量共存的离子:H+、大部分金属离子。
(6)常见因发生氧化还原反应不能大量共存的离子组:
a.与Fe3+不能大量共存的有:I-、S2-、SO33-、HS-、HSO3-。
b.与NO3-(H+)不能大量共存的有:I-、S2-、SO32-、HS-、HSO3-、Fe2+、Br-。
c.与MnO42-(H+)不能大量共存的有:I-、S2-、SO32-、HS-、HSO3-、Fe2+、Br-。
d.与ClO-(H+)不能大量共存的有:I-、S2-、SO32-、HS-、HSO3-、Fe2+、Br-。
(7)常见因发生双水解反应不能大量共存的离子组:
a.与Fe3+不能大量共存的有:CO32-、HCO3-、AlO2-。
b.与Al3+不能大量共存的有:CO32-、HCO3-、AlO2-、SO32-、HSO3-、S2-、HS-。
c.与AlO2-不能大量共存的有:大部分金属离子、NH4+。
(8)常见因发生络合反应不能大量共存的离子组:与Fe3+不能大量共存的有:SCN-、F-。
3.高分拦路虎之隐含条件
(1)若题目限定溶液为“无色”,则不含有色离子,即Fe2+(浅绿色)、Fe3+(棕黄色)、Cu2+(蓝色)、MnO2-(紫色)等有色离子;若为“透明”,则溶液不形成混浊液或沉淀(与溶液有无颜色无关)。
(2)能使酚酞变红的溶液:含大量OH-。
(3)能使石蕊试纸变蓝的溶液:含大量OH-。
(4)能使石蕊试纸变红的溶液:含大量H+。
(5)由水电离出的H+浓度小于1x10-7mol/L含大量的H+或OH-。
(6)加铝能放出氢气的溶液:强酸或强碱。
(7)能使pH试纸变红的溶液:含大量H+。
(8)能使pH试纸变黑的溶液:含大量的OH-。
二、离子共存常见题型及解法
1.“无色透明”条件型
例:下列各组离子中,在无色透明溶液中能大量共存的是( )。
A.Cu2+、Ag+、NO3-、Cl-
C.Ca2+、Na+、Cl-、CO32-
D.Fe3+、Na+、SO42-、NO3-
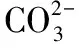
2.“氧化还原”条件型
例:下列离子组在同一溶液中因发生氧化还原反应不能大量共存的是( )。
A.H+、NO3-、Fe2+、Na+
B.Ag+、NO3-、Cl-、K+
C.K+、Ba2+、OH-、SO42-
D.Cu2+、NH4+、Br-、OH-
解析:A项中H+、NO3-、Fe2+能发生氧化还原反应,故选A。
3.“双水解反应”条件型
例:下列离子在同一溶液中因发生双水解反应不能大量共存的是( )。
A.Na+、K+、CO32-、Cl-
B.Fe3+、Cu2+、NH4+、HCO3-
C.Mg2+、H+、Cl-、NO3-
D.K+、Ag+、Cl-、NO3-
解析:A项中,若溶液为非酸性溶液则能大量共存;B项中因Fe3+与HCO3-发生双水解不能大量共存;C项中各离子能大量共存;D项中Ag+与Cl-反应生成AgCl沉淀。故选B。
4.“络合反应”条件型
例:在同一溶液中,因发生络合反应不能大量共存的离子组是( )。
A.Fe3+、Na+、SCN-、NO3-
B.CO32-、Mg2+、NO3-、Cl-
C.Ca2+、Na+、Cl-、SO42-
D.Ba2+、NO3-、Cl-、H+
解析:A项中因Fe3+与SCN-发生络合反应生成络合物Fe(SCN)3不能大量共存,故选A。
5.“酸性”条件型
例:在酸性无色透明溶液中能大量共存的离子组是( )。
A.Fe2+、Na+、NO3-、Cl-
B.K+、Na+、Cl-、CO32-
C.H+、Mg2+、NO3-、Cl-
D.Na+、OH-SO42-、NO3-
解析:A项中Fe2+为浅绿色,溶液为酸性,Fe2+与NO3-不能大量共存;B项中CO32-与H+反应生成HCO3;D项中OH-与H+不能大量共存,故选C。
6.“碱性”条件型
例:下列各组离子中,在碱性无色透明溶液中能大量共存的是( )。
A.Ba2+、NO3-、Cl-、H+
B.NH4+、Mg2+、NO3-、Cl-
C.Cu2+、Na+、SO42-、NO3-
D.K+、Na+、Cl-、CO32-
解析:A项中Ba2+、H+均能与OH-反应不能大量共存;B项中NH4+与OH-反应不能大量共存;C项中Cu2+为蓝色,故选D。
[1]普通高中课程标准实验教科书必修Ⅰ(人民教育出版社出版).
