关于溶液的那些事
2014-03-18马泽琼衷明华
马泽琼 衷明华
(韩山师范学院化学系,广东 潮州 521041)
通过对近五年广东化学高考题的分析,除了2014年关于溶液知识的考题融入了图像,前四年关于该知识题目的出题方式都比较直接,但是所考察的内容基本不变,其涉及的知识点比较多,属于中等难度的题型。
一、考点分析
1、考查溶液离子积常数的应用;
2、考查溶液酸碱性的判断以及pH的计算;
3、考查溶液中离子浓度大小的比较;
4、弱电解质的电离平衡;
5、考查溶液三大平衡(电荷守恒、物料守恒、质子守恒)的应用。
二、例题分析
例1(2010.广东)HA为酸性略强于醋酸的的一元弱酸,在0.1mol/L的NaA中,离子浓度关系正确的是( )。
A.c(Na+)>c(A-)>c(H+)>c(OH-)
B.c(Na+)>c(OH-)>c(A-)>c(H+)
C.c(Na+)+c(OH-)=c(A-)+c(H+)
D.c(Na+)+c(H+)=c(A-)+c(OH-)
解析:因HA为一元弱酸,则A-+H2O=HA+OH-,所以溶液显碱性,c(OH-)>c(H+),而由于水解程度一般都很弱,所以c(A-)>c(OH-)>c(H+),之后由电荷守恒则可以很简单地得出答案。
分析:该题涉及了考点2、3、4。
例2(2011.广东)对于0.1mol/L的Na2SO3溶液,正确的是( )。
A.升高温度,溶液的pH降低
B.c(Na+)=2c(SO32-)+c(HSO3-)+c(H2SO3)
C.c(Na+)+c(H+)=2c(SO32-)+2c(HSO3-)+c(OH-)
D.加入少量NaOH固体,c(SO32-)与c(Na+)均增大
解析:解该题时,先列出SO32+H2O=HSO3-+OH-的水解反应,水解属于吸热反应,升温,平衡右移,所以pH升高,根据物料守恒和电荷守恒可以知道B、C是错的,所以选D。
分析:该题涉及考点2、4。
例3(2012.广东)对于常温下pH为2的盐酸,叙述正确的是( )。
A.C(H+)=c(Cl-)+c(OH-)
B.与等体积pH=12 的氨水混合后所得溶液显酸性
C.由H2O电离出的c(H+)=1.0×10-12mol·L-1
D.与等体积0.01mol·L-1乙酸钠溶液混合后所得溶液中:c(Cl-)=c(CH3COO-)
解析:根据电荷守恒可知道A是正确的;由于一水合氨是弱电解质,在溶液中存在电离平衡,所以溶液混合后,一水合氨会继续电离出OH-离子,所以溶液呈碱性,B错;由题可知溶液中的OH-都是由水电离出来的,利用水溶液的离子积常数可求出OH-的浓度是10-12mol·L-1c(H+)水=c(OH-)水,C正确;D中由于存在着电离平衡,所以错误。
分析:该题涉及考点1、4、5。
例4(2013.广东)50℃时,下列各溶液中,离子的物质的量浓度关系正确的是( )。
A.pH=4的醋酸中:c(H+)=4.0mol L-1
B.饱和小苏打溶液中:c(Na+)=c(HCO3-)
C.饱和食盐水中:c(Na+)+c(H+)=c(Cl-)+c(OH-)
D.pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol L-1
解析:A.c(H+)=10-PH,B.HCO3-会水解,B错误;C.根据电荷守恒可知正确电荷守恒;D.由于50℃时,水的离子积大于10-14,所以c(OH-)>1.0×10-2mol L-1。
涉及考点1、2、3、5。
例5(2014.广东)常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中微粒组分及浓度如图所示,下列说法正确的是( )。
A.HA为强酸
B.该混合液pH=7
C.图中X表示HA,Y表示OH-,Z表示H+
D.该混合溶液中:c(A-)+c(Y)=c(Na+)
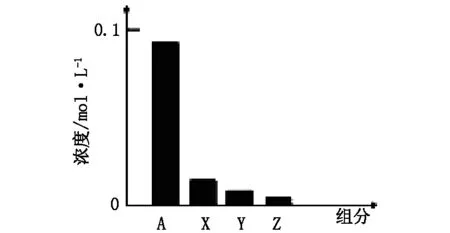
图 所得溶液中微粒组分及浓度
解析:一元酸的HA和NaOH溶液等体积,等浓度0.2mol/L混合,HA+NaOH=NaA+H2O,所得溶液中A-浓度小于0.1mol/L,说明在溶液中存在着水解,HA为弱酸,则NaA溶液呈碱性,排除AB,X、Y、Z的判断其实只是离子浓度大小的比较,最后根据物料守恒可以得出答案。
分析:该题涉及的考点2、3、5。
三、解题归纳
1、溶液酸碱性判断
(1)pH相同的酸溶液,酸越弱,酸物质的量浓度就越大;pH相同的碱溶液,碱越弱,碱物质的量浓度就越大。
(2)pH相同的强酸弱酸溶液,稀释相同的倍数,强酸溶液pH变化较大,碱也是如此。
(3)酸溶液与碱溶液的pH之和等于14,且等体积混合时,强酸与强碱混合pH=7,强酸与弱碱混合,pH>7,强碱与弱酸混合pH<7。
2、pH的计算
首先,必须记得常温下溶液的离子积常数是10-14。
(1)单一溶液
C(H+)=10-pH;c(OH-)=10-pOH
(2)强酸、强碱混合溶液
①强酸与强酸:c(H+)=(c1(H+)V1+c2(H+)V2)/(V1+V2)
②强碱与强碱:c(OH+)=(c1(OH-)V1+c2(OH+)V2)/(V1+V2)
③强酸与强碱:若恰好完全反应,则pH=7,
若酸过量,则c(H+)=(c酸(H+)V酸-c碱(OH-)V碱)/(V酸+V碱);
若碱过量,则c(OH+)=(c碱(OH-)V碱-c酸(H+)V酸)/(V碱+V酸)
3、离子浓度大小的比较
遵循电离程度小和水解程度小的原则
(1)多元弱酸溶液,根据多不电离分析,如:
H3PO4溶液中c(H+)>c(H2PO4-)>c(HPO42-)>(PO43-)
(2)多元弱酸的正盐溶液,则根据若酸根的分步水解分析,如Na2CO3溶液中:
c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)
(3)不同溶液中的离子比较则需考虑溶液中其他离子对其影响因素。
(4)混合溶液中各离子的浓度比较,则需考虑电离因素和水解因素。
①以电离为主原则的大概适用范围:一元弱酸与该弱酸的强碱盐等体积等浓度混合;
②以水解为主原则的大概适用范围:除NaHSO3、NaH2PO4的多元弱酸强碱的酸式盐。
4、三大守恒
以c mol/L的Na2CO3为例:
溶液中存在的离子:Na+、CO32-、HCO3-、OH-、H+。
(1)电荷守恒:在电解质溶液中,阳离子的总电荷数与阴离子的总电荷数必须相等:
c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(oH-)
书写要求:电荷数与浓度前的系数要保持一致。
(2)物料守恒:在平衡体系中,某一组分的总浓度一定等于他所解离的多种形式的平衡浓度之和:
c(Na+)=2c(CO32-)+2c(HCO3-)+2(H2CO3)
书写技巧:假设不存在水解,则c(Na+)=2c(CO32-),但事实上CO32-会水解成HCO3-、H2CO3所以
c(Na+)=2[c(CO32)-+c(HCO3-)+c(H2CO3)]
(3)质子守恒:弱电解质水解得到质子后的产物得到质子的物质的量应该与失质子后的产物失去质子的物质的量相等:
c(OH-)=c(HCO3-)+2(H2CO3)+c(H+)
书写技巧:(三线法)
得到质子 HCO32-2 H2CO3H+
CO32H2O
失去质子 OH-
