MBL 调节白假丝酵母菌相态转化的作用及机制的初步分析①
2014-03-18翟晶晶王明永凌明智王凡平宋士军段巨洪李梦杰左萌洁赵雯瑕
翟晶晶 王明永 凌明智 王凡平 郭 康 宋士军 段巨洪 张 娜 李梦杰 左萌洁 赵雯瑕
(新乡医学院医学检验学院,新乡 453003)
甘露聚糖结合凝集素(Mannan-binding lectin,MBL)是由肝细胞分泌的血浆蛋白,为天然免疫系统中的关键分子[1],除了通过激活补体促进对C.albicans 的调理吞噬外,近年来研究发现MBL 在调节机体免疫应答中也发挥着重要作用[2-10]。白假丝酵母菌(Candida albicans,C.albicans,白色念珠菌)是临床上最常见的致病性真菌,正常情况下C.albicans 是正常菌群,存在于人的皮肤和口腔、上呼吸道、阴道及肠道黏膜,当免疫功能受到损害或正常菌群失调时,C.albicans 即成为条件致病菌,引起各种念珠菌病。C.albicans 由酵母相(Yeast form,Y)向菌丝相(Hyphal form,H)转化是其感染性转变的关键因素,故其菌相转变与引起机体感染密切相关[11]。影响C.albicans 相态转化的理化因素很多,血清、37℃、中性pH 值、乙酰葡萄糖胺、营养缺乏、脯氨酸等因素可以促进C.albicans 从酵母相向菌丝相转化。但至今没有免疫分子调节C.albicans 相态转化的相关报道。
本研究选择天然免疫分子MBL 为研究对象,首先从形态学分析MBL 对C.albicans 相态转化的影响;又进一步从基因水平分析MBL 调控C.albicans相态转化的机制,旨在进一步阐述 MBL 抗C.albicans 感染的作用及机制。
1 材料与方法
1.1 材料 人血浆天然MBL 按文献[12]制备。牛血清白蛋白(BSA,北京鼎国公司),FITC(Sigma公司),琼脂糖(Agarose,西班牙Biowest),胰蛋白胨(Tryptone powder,BIO BASIC),酵母提取物(Yeast extract,Oxoid),RPMI1640 购自Gibco 公司,HEPES购自Solarbio 公司,Yeast RNAiso Kit、PrimeScriptTMRT reagent Kit、SYBR®Premix Ex TaqTMⅡ、6 ×Loading Buffer 均购自TaKaRa 公司。结合缓冲液:20 mmol/L Tris-HCl (pH8.0)、150 mmol/L NaCl、1 mmol/L CaCl2、2 mmol/L MgCl2、5 g/L BSA、1 g/L 叠氮钠。其他化学试剂均为进口或国产分析纯产品,倒置相差显微镜为Nikon(TS100),核酸蛋白分析仪(Eppendorf),FACS Calibur 流式细胞仪为美国BD公司产品。
1.2 方法
1.2.1 C.albicans 的培养 取C.albicans 标准菌株ATCC 10231,四区划线于酵母膏胨葡萄糖(Yeast extract peptone dextrose,YEPD)琼脂培养基28℃培养16 h,传代一次,将16 h 传代培养物悬浮于RPMI1640 培养基中,调整菌液浓度为5 ×107个/ml,设MBL 处理组和对照组,MBL 处理组加100 μl 过滤除菌的MBL(10 mg/L),对照组加100 μl 无菌生理盐水,37℃200 r/min 震荡培养;在不同时间点取培养物于倒置相差显微镜下观察C.albicans 菌丝形成情况,余下菌悬液用于提取总RNA。
1.2.2 制备FITC-MBL 根据文献[13],采用透析法,以FITC 标记MBL,标记产物FITC-MBL 的F/P比值为2.4。
1.2.3 结合试验 将C.albicans 用结合缓冲液(调整Ca2+浓度分别为1 mmol/L、5 mmol/L,或者用5 mmol/L EDTA 代替CaCl2)重悬并调整菌液浓度为5 ×109个/L,于200 μl 菌悬液中加入FITCMBL,37℃避光反应30 min。选择人血浆MBL 生理浓度的上限10 mg/L 作为实验中MBL 用量。PBS 洗涤3 次,FACS 分析。以加未标记FITC 的MBL 为阴性对照。
1.2.4 RT-PCR 分析C.albicans HWP1、DDR48 mRNA 的表达 C.albicans 总RNA 的制备:分别取上述MBL 处理组和对照组C.albicans 1 ×107个,用无菌PBS 洗1 次,按Yeast RNAiso Kit 说明书操作提取总RNA。以1%琼脂糖凝胶电泳鉴定其完整性,用核酸蛋白分析仪测定RNA 浓度及A260 nm/A280 nm 比值。统一调整总RNA 浓度为0.20 mg/ml,立即反转录合成cDNA。PCR 引物的设计与合成:参考文献[14]并经Primer premier 5.0 软件分析,由上海生工公司合成HWP1、DDR48 和β-actin 等3 对特异性引物(序列见表1)。β-actin 作为内参照。cDNA 合成:分别取对照组和MBL 处理组C.albicans总RNA 各1 μg、5 ×Prime Script®Buffer 4 μl、Prime-Script®RT Enzyme Mix I 1 μl、Oligo dT Primer (50 μmol/L)1 μl 和Random 6 mers (100 μmol/L)1 μl,加RNase Free H2O 至总反应体积20 μl。37℃反应15 min 合成cDNA 第一链,85℃5 s 灭活反转录酶终止反应,4℃ 5 min 复性。PCR:反应体系为:SYBR®Premix Ex TaqTMⅡ(2 ×)10 μl,上、下游引物各0.8 μl (10 μmol/L),模板cDNA 2 μl,加灭菌蒸馏水至总反应体积20 μl。PCR 反应条件为:95℃预变性30 s,95℃变性5 s,60℃延伸30 s,循环40次。取 各 PCR 扩 增 产 物 5 μl 于 1%琼脂糖凝胶电泳,溴化乙锭染色,紫外灯下观察、拍照,并用凝胶成像仪分析DNA 片段的灰度值。

表1 引物序列及RT-PCR 产物的大小Tab.1 Primer sequence and sizes of RT-PCR products
1.3 统计学分析 应用SPSS17.0 软件包进行统计处理,数据采用单因素方差分析方法(one-way ANOVA),P <0.05 时具有显著性差异。
2 结果
2.1 MBL 抑制C.albicans 酵母相(Y)向菌丝相(H)转化 取MBL 处理组与对照组C.albicans 培养物于400 × 倒置相差显微镜下观察,与对照组相比,MBL处理组C.albicans在2、4h时,菌丝生长明显被抑制,至8 h 时,两组菌丝生长基本一致,无明显差异(见图1)。

图1 MBL 抑制C.albicans 酵母相(Y)向菌丝相(H)转化Fig.1 MBL inhibits C.albicans Yeast form transform to Hyphal form
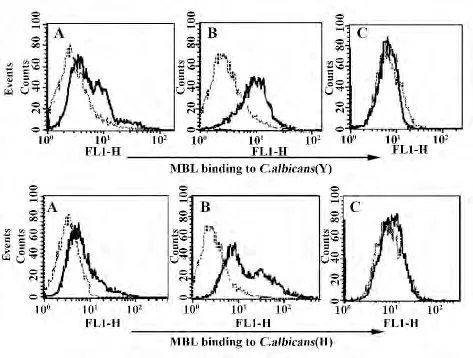
图2 MBL 以钙离子依赖形式结合C.albicansFig.2 Ca2+-dependent binding underlying interaction of MBL with C.albicans cells
2.2 MBL 以Ca2+依赖方式结合C.albicans FACS分析表明,MBL 在无Ca2+、或含EDTA 的结合缓冲液中几乎不与酵母相、菌丝相C.albicans 结合,而在分别含1 mmol/L、5 mmol/L Ca2+的结合缓冲液中,MBL 与酵母相、菌丝相C.albicans 的结合逐渐增强,呈Ca2+浓度依赖关系(见图2)。当加入Ca2+离子螯合剂EDTA 以后,MBL 的结合作用几乎消失(见图2)。
2.3 MBL 对C.albicans HWP1、DDR48 mRNA 表达的影响 用1%琼脂糖凝胶电泳鉴定总RNA 显示28S 和18S rRNA 两条清晰带,核酸蛋白分析仪测得RNA 样品A260 nm/A280 nm 比值均大于1.8,表明提取的总RNA 均具有较高的纯度和完整性。RT-PCR 结果(见图3)显示:PCR 扩增产物为预期大小;与对照组相比,加MBL 处理2、4 h,C.albicans HWP1 mRNA 表达明显减少,于相应位置泳带减弱,MBL 处理8 h,HWP1 mRNA 表达较多,与对照组无明显差异;而在各时间段,MBL 处理组与对照组DDR48 mRNA 表达无明显差异,由此可见MBL 在早期抑制C.albicans 相态转化基因HWP1 mRNA 的表达。凝胶成像仪DNA 片段灰度分析亦显示:MBL 处理2、4 h 时,C.albicans HWP1的RT-PCR 扩增片段灰度明显弱于相应对照组,MBL 处理8 h,灰度与对照组相当,无明显差异;在各时间段,MBL 处理组和对照组C.albicans DDR48的RT-PCR 扩增片段灰度均无明显差异(见图4)。
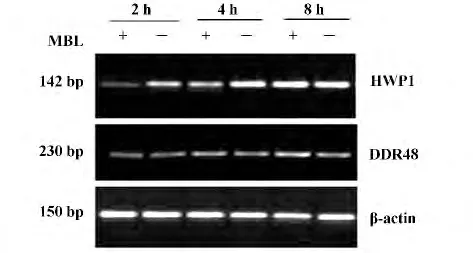
图3 不同实验组C.albicans HWP1、DDR48 mRNA 的表达Fig.3 mRNA expressions of C.albicans HWP1,DDR48 in different experiment groups
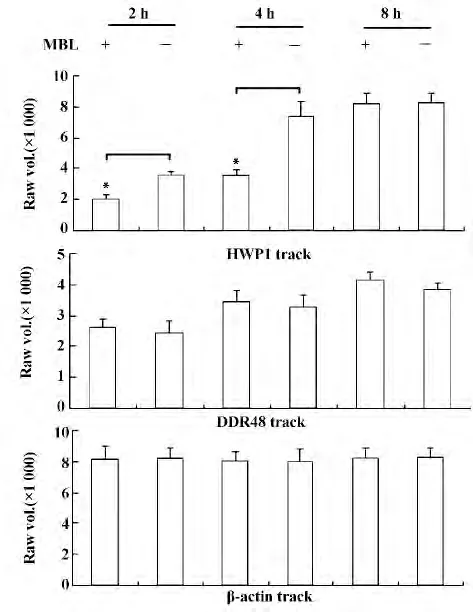
图4 不同实验组C.albicans HWP1、DDR48 DNA 扩增片段灰度值Fig.4 Raw vol.of C.albicans HWP1,DDR48 DNA fragments in different experiment groups
3 讨论
C.albicans 是临床上最常见的致病性真菌,生长环境改变时C.albicans 可由酵母相转变为菌丝相,被称为二态性真菌。酵母相C.albicans 通常不具有感染性,转变为菌丝相就具备了较强的感染性,酵母相向菌丝相转化是C.albicans 适应不同生长环境的重要转换方式,也是其感染性转变的关键因素。因此,抑制C.albicans 酵母相向菌丝相转化是控制C.albicans 感染较好的切入点,免疫系统对抗C.albicans 感染有重要作用,但免疫分子对C.albicans 相态转化是否有调节作用尚未见报道。
MBL 是一种急性期蛋白,在C.albicans 感染早期由肝细胞合成并分泌,在正常人血清中浓度为0.01~10 mg/L,应激状态下MBL 水平可大幅升高[15],在抗感染免疫中起重要作用。本课题组前期一直在研究MBL 在抗C.albicans 感染免疫中的作用,发现MBL 对C.albicans 诱导的免疫反应有抑制作用[5]。本研究发现,C.albicans 培养过程中加入MBL,在早期(4 h 以内)可明显抑制C.albicans 菌丝相的生长,但这种抑制作用并非完全阻止酵母相向菌丝相转化,随着时间延长这种抑制作用逐步减弱,因此推测,在C.albicans 感染早期,机体MBL 能够通过抑制C.albicans 菌丝的形成,起抗C.albicans 感染的作用。
为了进一步研究MBL 抑制C.albicans 酵母相向菌丝相转化的机制,我们又分析了MBL 与C.albicans 的结合情况。FACS 分析显示,MBL 能够与酵母相和菌丝相C.albicans 结合,且这种结合与Ca2+浓度呈依赖关系,由此推测,酵母相和菌丝相C.albicans 表面均存在Ca2+依赖的MBL 结合配体。
HWP1 是编码C.albicans 菌丝胞壁蛋白HWP1的基因,研究表明其编码一种膜外甘露糖可与细胞壁β-甘露糖以共价键结合,进而促进菌丝形成[16]。RT-PCR 分析发现:与对照组相比,MBL 处理早期(4 h 以内),HWP1 基因表达量明显减少(P <0.05),提示MBL 在早期抑制C.albicans 菌丝生长,可能与抑制HWP1 基因表达有关。但这种作用是MBL 特异性的通过HWP1 调节C.albicans 相态转化,还是与其他因素共同作用的?尚需进一步深入研究。
DDR48 编码的Ddr48 蛋白是一种损伤反应蛋白,被认为是C.albicans 的必需蛋白,在C.albicans包膜和菌丝形成过程中表达均增加[17];并被认为与DNA 破坏相关,环境温度、钙离子、渗透压等升高时其表达也增多[18]。与对照组比较,MBL 处理组DDR48 表达无显著性差异(P >0.05),提示MBL 抑制C.albicans 菌丝生长不是通过调控DDR48 基因的表达发挥作用的。
综上所述,MBL 能够与C.albicans 以Ca2+依赖方式结合,在C.albicans 感染早期,通过减弱调控基因HWP1 的表达,从而抑制C.albicans 酵母相向菌丝相转化。本研究进一步丰富了 MBL 在抗C.albicans 感染中的调节作用。
[1]Thompson C.Protein to proves to be a key link in innate immunity[J].Science,1995,269(5222):301-302.
[2]张雅妮,王明永,雷 鸣,等.MBL 与THP1/CD14 细胞结合特性的研究[J].现代免疫学,2008,28(2):121-125.
[3]王明永,张雅妮,雷 鸣,等.MBL 抑制Jurkat 细胞增殖和分泌IL-2[J].现代免疫学,2010,30(6):448-452.
[4]王明永,张雅妮,张丽芸,等.MBL 与Raji 细胞结合特性的研究[J].生物化学与生物物理进展,2008,35(3):335-340.
[5]王明永,王凡平,郭晓芳,等.MBL 抑制白假丝酵母菌刺激THP1/CD14 细胞产生TNF-α 和IL-8[J].中华微生物学和免疫学杂志,2011,31(1):14-19.
[6]Wang M,Chen Y,Zhang Y,et al.Mannan-binding lectin directly interacts with Toll-like receptor 4 and suppresses lipopolysaccharide-induced inflammatory cytokine secretion from THP-1 cells[J].Cell Mol Immunol,2011,8(3):265-275.
[7]Wang M,Zhang Y,Chen Y,et al.Mannan-binding lectin regulates dendritic cell maturation and cytokine production induced by lipopolysaccharide[J].BMC Immunol,2011,12(1):1-10.
[8]王凡平,王明永,杨建斌,等.甘露聚糖结合凝集素抑制肽聚糖刺激THP1/CD14 细胞产生的炎性反应及机制[J].中华微生物学和免疫学杂志,2012,32(11):977-982.
[9]王凡平,王明永,杨建斌,等.MBL 诱导DC 成熟机制分析[J].中国免疫学杂志,2012,28(12):1059-1062.
[10]王凡平,王明永,郭晓芳,等.MBL 抑制LPS 诱导DC 成熟机制的研究[J].中国实验血液学杂志,2013,21(3):770-774.
[11]Wang Y.CDKs and the yeast-hyphal decision[J].Curr Opin Microbiol,2009,12(6):644-649.
[12]王明永,张丽芸,张雅妮,等.联合应用配体和单克隆抗体亲和层析纯化人血浆天然MBL 蛋白[J].免疫学杂志,2008,24(2):119-122.
[13]Bohlson SS,Fraser DA,Tenner AJ.Complement proteins C1q and MBL are pattern recognition molecules that signal immediate and long-term protective immune functions[J].Mol Immunol,2007,44(1):33-43.
[14]Lane S,Birse C,Zhou S,et al.DNA array studies demonstrate convergent regulation of virulence factors by Cph1,Cph2,and Efg1 in Candida albicans[J].Biol Chem,2001,276(52):48988-48996.
[15]Garred P,Larsen F,Seyfarth J,et al.Mannose-binding lectin and its genetic variants[J].Genes Immun,2006,7(2):85-94.
[16]Padovan AC,Chaves GM,Colombo AL,et al.A novel allele of HWP1,isolated from a clinical strain of Candida albicans with defective hyphal growth and biofilm formation,has deletions of Gln/Pro and Ser/Thr repeats involved in cellular adhesion[J].Med Mycol,2009,47(8):824-835.
[17]Cleary IA,MacGregor NB,Saville SP,et al.Investigating the function of Ddr48p in Candida albicans[J].Eukaryot Cell,2012,1(6):718-724.
[18]Roche H,Ramachandran K,Kunz BA.Failure to detect an antimutator phenotype following disruption of the Saccharomyces cerevisiae DDR48 gene[J].Curr Genet,1995,27(6):496-500.
