母-胎界面免疫细胞交互对话参与蜕膜化的分子机制①
2014-03-18周文洁王晓秋李大金复旦大学附属妇产科医院暨妇产科研究所上海200011
周文洁 王晓秋 李大金 (复旦大学附属妇产科医院暨妇产科研究所,上海 200011)
妊娠是一个复杂的生理过程,作为同种移植物的胎儿能够在母体内正常发育、生长是一个在细胞与分子水平上受到严密调控的过程。受精卵经输卵管运行到达母体宫腔后,要经过定位、黏附、穿入完成着床过程,着床后的囊胚开始不断地从母体吸取营养。在这一过程中,母体的子宫内膜增殖,内膜新生血管形成,在一系列因素的调控下,母体的子宫内膜发生蜕膜化,这一生理变化对于胚泡正常着床是至关重要的,异常的蜕膜化过程将导致着床失败,妊娠早期流产,甚至影响胎盘的血管重铸导致子痫、胎儿宫内发育迟缓、早产等严重的产科并发症。而在目前的IVF-ET 术(体外受精-胚胎移植)中,亦有相当一部分病人由于子宫内膜蜕膜化不良导致胚胎移植失败。因此,阐明妊娠期子宫内膜的蜕膜化分子机制将有助于我们理解妊娠的生理过程,并为因蜕膜化不良导致的异常妊娠结局提供潜在的治疗靶点。在这篇综述中,我们总结了近几年有关母胎界面免疫细胞在子宫内膜蜕膜化中作用机制的最新研究进展,希望能得到启示,从中发现新的研究方向,以期进一步深入细致的解析蜕膜化的生理及病理分子机制。母-胎界面的免疫微环境对于正常妊娠的维持具有重要意义,妊娠是对母体免疫系统的一个重大挑战,一方面母体免疫系统必须保护母亲和胎儿免受病原体的攻击,另一方面母体还需防止免疫介导的胎儿排斥反应。胎儿作为同种异体移植物,使母体免疫系统发生一定程度的改变,使其能够容忍胚胎的存活并维持到足月生产。孕早期母胎界面富集了大量的免疫细胞,包括自然杀伤细胞(NK)、单核巨噬细胞(MΦ)、树突状细胞(DCs),还包括不同T 细胞亚群,这些免疫细胞被募集至蜕膜局部,并被局部的细胞因子如GM-CSF、CSF-1、IL-11、IL-15 和TNF-α 等所调节,这些免疫细胞不仅在维持母胎免疫耐受中发挥重要作用,部分(尤其是DCs 细胞和NK 细胞)还具有“营养”作用参与子宫内膜蜕膜化,促进蜕膜新生血管形成,并有助于滋养细胞的生长、侵袭,有利于妊娠维持。母-胎界面免疫细胞之间以及免疫细胞与蜕膜基质细胞、滋养细胞之间的交互对话在蜕膜化中扮演着不可或缺的角色,本文就母胎界面几种重要的免疫细胞群在蜕膜化中发挥的作用分别加以综述。
1 NK 细胞
子宫NK 细胞不仅发挥着母-胎界面免疫调节作用,且被认为具有促进蜕膜化、胎盘形成和滋养细胞侵袭的作用。不明原因流产患者的子宫局部NK细胞的功能是失调的[1]。
1.1 母-胎界面NK 细胞的来源、分化和表型 母-胎界面的NK 细胞主要来自外周NK 细胞向局部的募集,NK 细胞表达高水平的CXCR4,重组人趋化因子SDF-1α 和滋养细胞培养上清均能够诱导CD56brightCD16-NK 细胞的趋化。我们的研究表明,人早孕期滋养细胞可通过分泌CXCL12 趋化蜕膜CD56brightCD16-NK 细胞[2]。子宫内膜也能够驻留CD34+的造血干细胞并在局部促进其向NK 细胞分化,用蜕膜基质细胞的培养上清补充以IL-15 能够促进造血干细胞向NK 细胞分化。蜕膜基质细胞能够表达TGF-β1,用蜕膜基质细胞的培养上清或重组TGF-β1 细胞因子均能诱导CD16+NK 细胞向CD16-NK 细胞转变,后者更接近于蜕膜NK 细胞的表型[3]。
外周血90% 的 NK 细胞表型是 CD56dimCD16+,另外10%是CD56brightCD16-,而蜕膜NK 细胞的表型主要是CD56brightCD16-,细胞毒性强的CD56dimCD16+亚群含量极少。CD56brightNK 细胞在蜕膜局部的大量募集受到妊娠相关激素的调节,从而有利于蜕膜化反应[4]。蜕膜NK 细胞不同于外周血的NK 细胞,蜕膜NK 细胞含有丰富的胞质颗粒,除分泌颗粒酶、穿孔素等细胞毒性物质外,还可分泌大量细胞因子如血管内皮生长因子(VEGF)、胎盘生长因子(PLGF)、粒细胞-巨噬细胞集落刺激因子(GM-CSF)、肿瘤坏死因子(TNF)-α、干扰素(IFN)-γ、转化生长因子(TGF)-β 等。这些特性使蜕膜NK细胞的杀伤活性明显降低,而具有促进蜕膜血管重塑、新生血管形成和调控滋养细胞侵入的功能。Lukassen 等人[5]发现IVF 治疗时用激素处理能够影响人子宫内膜CD56bright/CD56dimNK 细胞在种植窗口期的比率,临床样本分析表明CD56bright的NK 细胞更有利于胚胎种植和蜕膜化。
1.2 NK 细胞通过促进内膜血管形成参与蜕膜化进程 很多研究认为NK 细胞对蜕膜化的影响主要是因为其促进了内膜血管形成增加了蜕膜血供。IL-15 能够调节子宫NK 细胞的成熟,后者能够重塑子宫螺旋动脉,并参与胎盘血管形成和蜕膜化。子宫NK 细胞在IL-15 的作用下也会上调VEGF 和PLGF 的表达,从而有利于血管形成[6]。滋养细胞向血管内的侵袭参与调节复杂的血管重铸过程,而子宫NK 细胞对滋养细胞侵袭力的正向调节作用则间接地调节了血管重铸。蜕膜NK 细胞被募集至母胎界面后,可能通过分泌多种细胞因子(如IL-8,VEGF)、趋化因子和生长因子发挥基质细胞样作用参与蜕膜化[7]。
IL-15 是对NK 细胞的分化起到关键作用的细胞因子,IL-15 基因敲除的小鼠其子宫局部是不存在NK 细胞的,蜕膜化也明显受损,也没有螺旋动脉的重铸[8]。子宫NK 细胞是蜕膜中SPP1(分泌型磷蛋白1)的主要来源,SPP1 可能在NK 细胞参与蜕膜化中发挥重要作用,在IL-15 基因缺陷的小鼠由于NK细胞的发育异常,SPP1 的水平极大地降低了[9]。虽然NK 细胞在母胎界面的数量众多,且在蜕膜化中发挥明显作用,但是Barber 等人发现缺乏NK 细胞并没有显著的影响妊娠结局,虽然他们在动物实验中观察到了NK 细胞清除小鼠所产的幼鼠出生体重明显下降,但他们认为NK 细胞的缺乏是造成了次优的子宫环境从而影响了胚胎的生长[10]。
1.3 NK 细胞对子宫内膜基质细胞的直接调节作用 子宫NK 细胞的缺陷常导致蜕膜化异常,如蜕膜基质细胞的结构异常、坏死和水肿。子宫内膜基质细胞在向蜕膜基质细胞分化过程中,形态学和分子表达谱上均发生了一系列改变。研究表明,蜕膜中白细胞(主要是NK 细胞)来源的可溶性因子能够改变内膜基质成纤维细胞的基因表达谱,其中最大的一群表达上调基因为趋化因子和细胞因子,包括IL-8、CCL8 和CXCL1,同时基质成纤维细胞也表达相应的受体CXCR1 和CXCR2,由此形成了一个正反馈环路,而这些细胞因子在基质成纤维细胞和滋养细胞相互作用中也能够被刺激表达,表明子宫NK 细胞能够协同滋养细胞促进其在胚胎种植过程中迁移。另外,蜕膜白细胞培养介质也能够上调基质细胞表达IL-15,IL-15 是NK 细胞发育的重要调节因子,从而进一步上调NK 细胞的功能,形成另一个正反馈环路。这些改变很可能主要是由于蜕膜白细胞群中NK 细胞分泌的细胞因子的作用,因为NK细胞在蜕膜白细胞群中至少占85%,但也不能排除其他占比较小的包括T 细胞和DCs 细胞的作用[11]。
1.4 蜕膜化的关键功能分子对NK 细胞的反向调节作用 Hoxa-10 是蜕膜化中的一个重要功能分子,主要调节与细胞周期相关分子的表达参与蜕膜化。Hoxa-10 对子宫NK 细胞的分化也具有一定调节作用,在从外周募集至母胎界面后,子宫NK 细胞快速的增殖并分化为一群终极分化细胞,最终获得各种胞浆细胞毒颗粒,包括穿孔素、丝氨酸蛋白酶如颗粒酶、磷酸酶、黏蛋白-1 和IFN-γ。子宫NK 细胞的成功分化对于胚胎发育、正常胎盘形成和子宫组织重塑都具有重要作用,在Hoxa-10 敲除小鼠,几种颗粒酶(如颗粒酶A、C、E 和G)和穿孔素的表达与野生小鼠相比在蜕膜床中极大地下降了,表明在小鼠子宫内膜蜕膜化中子宫NK 细胞的分化是Hoxa-10 的下游事件[12]。另有研究发现,小鼠Hoxa-10 的敲除也能够通过增加T 淋巴细胞的增殖诱导免疫失衡[13]。另一个在蜕膜化中起到关键作用的细胞因子IL-11 也能够对母胎界面NK 细胞的分化起到重要作用,下面将会另外阐述,这些结果提示,在母胎界面,NK 细胞不仅能够影响血管重铸,参与蜕膜化过程,反之,蜕膜基质细胞也能够调节NK 细胞的功能,说明在蜕膜基质细胞和NK 细胞之间存在环路调节作用。
2 树突状细胞
2.1 母-胎界面DCs 细胞的免疫调节功能 母胎界面大部分DCs 细胞是CD11c+的DCs,在妊娠期具有诱导免疫耐受的潜能[14]。DCs 细胞可通过表达TGF-β1 诱导调节性T 细胞(Treg 细胞)形成,Treg细胞在建立和维持母胎免疫耐受中具有重要作用,Treg 细胞的缺乏会导致妊娠失败,而DCs 细胞的缺失会导致Treg 细胞形成异常[15]。
2.2 DCs 细胞参与蜕膜化的作用机制 母胎界面的DCs 细胞对于蜕膜化发挥着重要作用,清除子宫内的DCs 细胞会阻止蜕膜化的发生。DCs 细胞参与蜕膜化的作用是不依赖于其经典的免疫调节作用的。研究发现,清除小鼠的DCs 细胞影响了胚胎种植,内膜基质细胞的增殖受损,蜕膜局部的血流减少,影响了蜕膜血管形成,相应伴有内皮细胞标记物PECAM-1 和内皮素的表达下降,并影响了胎盘发育,DCs 细胞的清除会导致早期妊娠失败,同时发现DCs 细胞还能够影响蜕膜局部NK 细胞的成熟,清除DCs 细胞由于降低了IL-15 和IL-12 的水平会导致子宫NK 细胞的募集和成熟受损[16,17]。
DCs 细胞的缺乏会导致蜕膜化异常和胚胎吸收,即使在实验诱导的蜕膜化反应而没有胚胎存在的条件下,缺乏DCs 细胞也会导致蜕膜化异常,蜕膜DCs 细胞通过表达两个关键的因子sFlt1(可溶性的VEGF 受体1)和TGF-β1 促进血管形成,sFlt1 调节VEGF,TGF-β1 影响内皮细胞的活力和血管的成熟,这种血管生成过程是蜕膜化及胚胎着床所必需的。DCs 细胞影响子宫容受性的能力是通过调节组织重塑和血管形成来实现的,而非依赖于自身的免疫耐受作用。在蜕膜化的发生中,血管形成对于基质细胞的增殖是很重要的。DCs 细胞的缺乏增加了血管的通透性并抑制了血管成熟从而影响了正常的血管重铸。DCs 细胞能够表达TGF-β1,子宫DCs 细胞的清除会导致TGF-β1 的表达明显下降,而TGFβ1 的作用之一即参与内皮细胞的存活和血管的成熟,这与子宫DCs 细胞在血管形成中的作用进一步吻合。DCs 细胞对蜕膜化的作用除了通过促进蜕膜血管形成外,可能还有不为人知的通过直接作用于蜕膜基质细胞的机制[18]。另外,研究发现循环中的血管形成因子和抗血管形成因子的比率对于子痫前期是具有预测价值的,血浆中的sFLT1 是一个重要的能够预测先兆子痫发生的决定因子,循环中的sFLT1 水平升高以及升高的sFLT1∶PLGF 的比率都提示着可能发生子痫前期,由于子宫DCs 细胞是sFLT1 的主要来源,因此需进一步深入研究子宫DCs 细胞在子痫前期中的病理作用[18,19]。
2.3 NK 细胞和DCs 细胞协同作用参与蜕膜化NK 细胞和DCs 细胞间具有协同作用共同参与蜕膜化进程,清除了NK 细胞的小鼠依然能够妊娠,而NK 细胞和DCs 细胞双清除的小鼠则表现为严重的蜕膜化发育缺陷。这种内膜基质细胞的增殖和分化受损可能源自NK 细胞和DCs 双细胞清除模型小鼠的细胞因子IL-11 的表达缺陷,目前研究已经证实IL-11 是在子宫内膜蜕膜化中发挥重要作用的细胞因子之一,NK 细胞和DCs 双细胞清除对IL-11 表达的影响在小鼠的胚胎种植部位最为明显,提示NK细胞和DCs 细胞通过调节基质细胞合成IL-11 发挥其在蜕膜化中的作用[20]。更有研究发现,IL-11 不仅参与蜕膜化且对母胎界面NK 细胞的分化也很重要,IL-11 对子宫NK 细胞的分化调节是间接性的,因为IL-11 的缺陷并未影响IL-15 的表达,也没有影响NK 细胞的募集以及NK 细胞对IL-15 的反应性[21],因此IL-11 可能通过影响蜕膜基质细胞的生物学行为间接调节了NK 细胞的功能。滋养细胞的作用是促进蜕膜化的另一个重要因素,而只有在DCs 细胞和NK 细胞均存在的情况下,滋养细胞才能够最大程度地促进基质细胞的增殖。DCs 细胞和NK 细胞之间的交互对话对于妊娠早期蜕膜化的形成具有重要作用[22]。
3 单核巨噬细胞
虽然单核巨噬细胞在蜕膜化中的作用少有报道,但已有的研究表明,母胎界面的单核巨噬细胞能够表达多种趋化因子,对于其他免疫细胞包括NK细胞等的募集和发育可能具有重要作用,从而间接地参与了蜕膜化反应。另有发现,单核巨噬细胞不仅在蜕膜免疫反应中起到对抗病原体的作用,在分娩中还具有促宫颈成熟的作用,在小鼠实验中发现,胎鼠在近成熟期胎肺能够产生表面活性蛋白SP-A,这种表面活性剂能够募集单核巨噬细胞到达宫颈局部,并促进其表达IL-1β,激活NK-kappaB 信号通路,促进分娩发动[23]。
4 T 细胞
对母胎界面T 细胞的研究主要聚焦于其在妊娠的建立与维持中的免疫调节作用,有关T 细胞在蜕膜化中的作用鲜有报道。孕期母胎界面呈现Th2型免疫偏移,在妊娠相关激素及局部存在的细胞因子的影响下,炎症性辅助性T 细胞(Th1 型细胞,以分泌TNF-α、IFN-γ、IL-12、IL-2 为主)向保护性T 细胞(Th2 型细胞,以分泌IL-10、IL-4 为主)转变。我们课题组的研究表明,滋养细胞分泌的CXCL16 能够募集T 淋巴细胞和单核巨噬细胞到达蜕膜局部[24],蜕膜基质细胞(DSCs)分泌的趋化因子CCL2能够诱导母胎界面Th2 型免疫偏移,上调Th2 型转录因子GATA-3 的表达,促进Th2 型细胞因子IL-4和IL-10 的分泌,同时降调节Th1 型转录因子T-bet的表达,降低Th1 型细胞因子TNF-α 和IFN-γ 的分泌。反之,Th2 型细胞因子IL-4 和IL-10 也能够增加DSCs 分泌CCL2[25]。CXCL12/CXCR4 轴也能够诱导母胎界面免疫反应向Th2 型偏移[26]。滋养细胞来源的TSLP 能够通过促进DCs 细胞分泌IL-10和CCL-17 诱导蜕膜Th2 型免疫偏移[27]。另外,我们发现,Treg 细胞在孕早期妇女的外周血和母胎界面数目明显增加,其免疫抑制功能也上调了,而在孕早期流产患者Treg 细胞在其外周血和母胎界面数目是下降的,免疫抑制性功能分子CTLA-4 的表达也是下降的[28]。Liu 等[29]的研究表明,IGFBP7 能够上调蜕膜化标记物IGFBP1 的表达,且能够诱导母胎界面Th2 型免疫偏移,这提示蜕膜化反应和母胎界面Th2 型免疫优势的形成是同步的,而对于不同T 细胞亚群在蜕膜化中的作用机制还有待进一步研究。
5 结语及展望
我们对本文内容做了如图1 所示的示意图。综上所述,在复杂的妊娠生理过程中,存在于母胎界面的免疫细胞各自发挥着不同的作用同时又相互调节,一方面维持母胎免疫耐受保护胎儿不被母体免疫系统所排斥,一方面通过不同的作用机制参与孕早期蜕膜化反应,如NK 细胞促进子宫血管修复,新生血管形成,帮助蜕膜生长,而DCs 细胞则能够直接调节子宫内膜基质细胞的增殖,血管生成和NK细胞的成熟。单核巨噬细胞和T 细胞则更主要在免疫稳态的维持中发挥重要作用,在蜕膜化中的作用还需进一步研究。因此,成功的胚胎着床需要蜕膜化的子宫内膜细胞各成分之间的共同作用。阐明母胎界面免疫细胞交互对话在蜕膜化中的分子机制将帮助我们寻找更加有效的治疗措施以解决由异常蜕膜化导致的妊娠相关疾病,造福于广大病患。
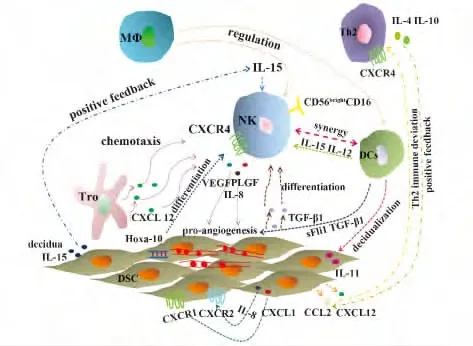
图1 母-胎界面免疫细胞交互对话参与蜕膜化的分子机制示意图Fig.1 Schematic diagram of molecular mechanisms of immune cells interactive dialogue involved in decidualization in maternal-fetal interface
[1]Dosiou C,Giudice LC.Natural killer cells in pregnancy and recurrent pregnancy loss:Endocrine and immunologic perspectives[J].Endocr Rev,2005,26(1):44-62.
[2]Wu X,Jin LP,Yuan MM et al.Human first-trimester trophoblast cells recruit CD56(bright)CD16(-)NK cells into decidua by way of expressing and secreting of CXCL12/stromal cell-derived factor 1[J].J Immunol,2005,175(1):61-68.
[3]Keskin Derin B,Allan David SJ,Rybalov Basya,et al.TGF beta promotes conversion of CD16(+)peripheral blood NK cells into CD16(-)NK cells with similarities to decidual NK cells[J].Proc Natl Acad Sci USA,2007,104(9):3378-3383.
[4]Ordi J,Casals G,Ferrer B,et al.Uterine (CD56 +)natural killer cells recruitment:Association with decidual reaction rather than embryo implantation[J].Am J Reprod Immunol,2006,55(5):369-377.
[5]Lukassen HGM,Joosten I,van Cranenbroek B,et al.Hormonal stimulation for IVF treatment positively affects the CD56(bright)/CD56(dim)NK cell ratio of the endometrium during the window of implantation[J].Mol Hum Reprod,2004,10(7):513-520.
[6]Leonard S,Murrant C,Tayade C,et al.Mechanisms regulating immune cell contributions to spiral artery modification-facts and hypotheses-A review[J].Placenta,2006,27(Suppl.A):S40-S46.
[7]Hanna Jacob,Goldman-Wohl Debra,Hamani Yaron,et al.Decidual NK cells regulate key developmental processes at the human fetalmaternal interface[J].Nat Med,2006,12(9):1065-1074.
[8]Ashkar AA,Black GP,Wei Q,et al.Assessment of requirements for IL-15 and IFN regulatory factors in uterine NK cell differentiation and function during pregnancy[J].J Immunol,2003,171(6):2937-2944.
[9]Herington JL,Bany BM.The conceptus increases secreted phosphoprotein 1 gene expression in the mouse uterus during the progression of decidualization mainly due to its effects on uterine natural killer cells[J].Reproduction,2007,133(6):1213-1221.
[10]Barber EM,Pollard JW.The uterine NK cell population requires IL-15 but these cells are not required for pregnancy nor the resolution of a Listeria monocytogenes infection[J].J Immunol,2003,171(1):37-46.
[11]Germeyer A,Sharkey AM,Prasadajudio M,et al.Paracrine effects of uterine leucocytes on gene expression of human uterine stromal fibroblasts[J].Mol Hum Reprod,2009,15(1):39-48.
[12]Rahman MA,Li M,Li P,et al.Hoxa-10 deficiency alters regionspecific gene expression and perturbs differentiation of natural killer cells during decidualization[J].Dev Biol,2006,290(1):105-117.
[13]Yao MWM,Lim HJ,Schust DJ,et al.Gene expression profiling reveals progesterone-mediated cell cycle and immunoregulatory roles of Hoxa-10 in the preimplantation uterus[J].Mol Endocrinol,2003,17(4):610-627.
[14]Kammerer Ulrike,Kruse Andrea,Barrientos Gabriela,et al.Role of dendritic cells in the regulation of maternal immune responses to the fetus during mammalian gestation[J].Immunol Invest,2008,37(5-6):499-533.
[15]Travis Mark A,Reizis Boris,Melton Andrew C,et al.Loss of integrin alpha(v)beta8 on dendritic cells causes autoimmunity and colitis in mice[J].Nature,2007,449(7160):361-365.
[16]Krey G,Frank P,Shaikly V,et al.In vivo dendritic cell depletion reduces breeding efficciency,affecting implantation and early placental development in mice[J].J Mol Med,2008,86(9):999-1011.
[17]Karsten Christian M,Behrends Jochen,Wagner Arnika K,et al.DC within the pregnant mouse uterus influence growth and functional properties of uterine NK cells[J].Eur J Immunol,2009,39(8):2203-2214.
[18]Plaks Vicki,Birnberg Tal,Berkutzki Tamara,et al.Uterine DCs are crucial for decidua formation during embryo implantation in mice[J].J Clin Invest,2008,118(12):3954-3965.
[19]Levine Richard J,Lam Chun,Qian Cong,et al.Soluble endoglin and other circulating antiangiogenic factors in preeclampsia[J].N Engl J Med,2006,355(10):992-1005.
[20]Gonzalez Irene Tirado,Barrientos Gabriela,Freitag Nancy,et al.Uterine NK Cells are critical in shaping DC immunogenic functions compatible with Pregnancy Progression[J].PLoS One,2012,7(10):e46755.
[21]Ain R,Trinh ML,Soares MJ.Interleukin-11 signaling is required for the differentiation of natural killer cells at the maternal-fetal interface[J].Dev Dyn,2004,231(4):700-708.
[22]Blois M,Barrientos G,Garcia MG,et al.Interaction between dendritic cells and natural killer cells during pregnancy in mice[J].J Mol Med,2008,86(7):837-852.
[23]Condon JC,Jeyasuria P,Faust JM,et al.Surfactant protein secreted by the maturing mouse fetal lung acts as a hormone that signals the initiation of parturition[J].Proc Natl Acad Sci USA,2004,101(14):4978-4983.
[24]Huang Yu,Zhu Xiao-Yong,Du Mei-Rong,et al.Human trophoblasts recruited T lymphocytes and monocytes into decidua by secretion of chemokine CXCL16 and interaction with CXCR6 in the first-trimester pregnancy[J].J Immunol,2008,180 (4):2367-2375.
[25]He Yin-Yan,He Xiao-Ju,Guo Pei-Fen,et al.The decidual stromal cells-secreted CCL2 induces and maintains decidual leukocytes into Th2 bias in human early pregnancy[J].Clin Immunol,2012,145(2):161-173.
[26]Piao Hai-Lan,Tao Yu,Zhu Rui,et al.The CXCL12/CXCR4 axis is involved in the maintenance of Th2 bias at the maternal/fetal interface in early human pregnancy[J].Cell Mol Immunol,2012,9(5):423-430.
[27]Guo PF,Du MR,Wu HX,et al.Thymic stromal lymphopoietin from trophoblasts induces dendritic cell-mediated regulatory T(H)2 bias in the decidua during early gestation in humans[J].Blood,2010,116(12):2061-2069.
[28]Jin LP,Chen QY,Zhang T,et al.The CD4(+)CD25(bright)regulatory T cells and CTLA-4 expression in peripheral and decidual lymphocytes are down-regulated in human miscarriage[J].Clin Immunol,2009,133(3):402-410.
[29]Liu ZK,Wang RC,Han BC,et al.A novel role of IGFBP7 in mouse uterus:regulating uterine receptivity through Th1/Th2 lymphocyte Balance and decidualization[J].PLoS One,2012,7(9):1-8.
