miRNA-126 基因敲减小鼠肠系膜淋巴结T 淋巴细胞比例的变化①
2014-03-18张忆雄郭萌萌朱顺飞陶弋婧赵娟娟
张忆雄 胡 燕 郭萌萌 朱顺飞 陶弋婧 赵娟娟 周 涯 郑 静 徐 林
(遵义医学院免疫学教研室暨贵州省免疫学研究生教育创新基地,遵义 563000)
肠系膜淋巴结(Mesenteric lymph nodes,MLNs)是肠相关淋巴组织的重要组成部分,也是肠道局部免疫应答诱导的初始部位。肠系膜淋巴结中淋巴细胞的比例和数量可反映局部黏膜免疫防御功能的完善程度,而其淋巴细胞组成异常与多种疾病的发生密切相关[1]。如肠系膜淋巴结Th1/Th17 细胞比例异常将导致炎症性肠病(Inflammatory bowel disease,IBD)等自身免疫性疾病的发生[2]。
MicroRNA-126(miR-126)是miRNAs 家族中重要的一员,位于EGFL7 基因7 号内含子中,其在血管和心脏、肺等组织器官的内皮细胞中高表达[3]。新近大量研究报道miR-126 与免疫细胞的功能相关。Okuyama 等[4]发现miR-126 可调控B 细胞前体细胞的功能。Agudo 等[5]报道miR-126 可通过VEGFR2 轴调控浆细胞样树突状细胞(plasmacytoid dendritic cells,pDCs)的功能,参与病毒等微生物引发的固有免疫应答。此外,我们课题组新近也发现miR-126 可通过PI3K/AKT 调控CD4+CD25+调节性T 细胞的外周诱导[6],提示其在机体免疫应答中具有重要调控作用。然而,miR-126 与肠系膜淋巴结免疫细胞组成的相关关系至今仍未有研究报道。本研究中拟利用miR-126 基因敲减小鼠模型,初步探讨miR-126 敲减后对肠系膜淋巴结T 及B 淋巴细胞比例的影响,以期为深入探讨miR-126 在固有免疫应答中的作用提供实验基础。
1 材料与方法
1.1 材料 SPF 级雌性FVB 小鼠和miR-126KD 小鼠(广州赛业生物科技有限公司);苏木精-伊红(HE)染色液(泰康医疗);流式细胞仪(Beckman Coulter);荧光显微镜(Olympus);R-Phycoerythrin(PE)anti-mouse CD19,R-Phycoerythrin (PE)antimouse CD3、R-Phycoerythrin (PE)anti-mouse CD4 及Allophycocyanin (APC) anti-mouse CD8 (Ebioscience)。
1.2 方法
1.2.1 miR-126KD 小鼠肠系膜淋巴结重量和细胞数目的检测 取出miR-126KD 小鼠和WT 小鼠肠系膜淋巴结,称取重量后制成石蜡切片备用;另一部分用玻片的糙面轻轻研磨成单细胞悬液,用细胞计数板计数。
1.2.2 HE 染色检测肠系膜淋巴结的形态学改变 石蜡切片HE 染色,显微镜下观察肠系膜淋巴结的病理形态学改变。
1.2.3 流式细胞术(FACS)检测肠系膜淋巴结淋巴细胞比例的变化 取出miR-126KD 小鼠和WT 小鼠肠系膜淋巴结后,置于冰上,用玻片的糙面轻轻研磨成单细胞悬液,磷酸盐缓冲液(PBS)洗涤,1 200 r/min 10 min 离心,弃掉上清液,分别加入CD19-PE、CD3-PE、CD4-PE 和CD8-APC 荧光标记抗体各1 μl,4℃避光孵育30 min,PBS 洗涤2 遍,FACS检测。
1.2.4 采用GraphPad PrismTM统计软件,数据以±s 表示,组间比较采用两独立样本资料的t 检验,P <0.05 认为有统计学差异。
2 结果
2.1 miR-126KD 小鼠肠系膜淋巴结的重量和细胞总数的变化 WT 小鼠和miR-126KD 小鼠肠系膜淋巴结形态及大小如图1A 所示,与WT 小鼠组相比,miR-126KD 组的淋巴结体积明显增大;miR-126KD组淋巴结重量也显著增加,且细胞总数明显增加,具有统计学差异(图1B、C,P <0.05)。
2.2 miR-126KD 小鼠肠系膜淋巴结病理形态学的改变 HE 染色结果如图2 所示,低倍镜下可见miR-126KD 组浅层皮质区淋巴小结增生(图2A、B),在高倍镜下还可见副皮质区淋巴细胞明显增加(图2E、F)。
2.3 miR-126KD 小鼠中肠系膜淋巴结CD19+B细胞及CD3+T 细胞的百分数变化 FACS 检测结果如图3 所示,WT 小鼠和miR-126KD 小鼠MLNs 中CD19+B 细胞及CD3+T 细胞百分率均无明显变化。
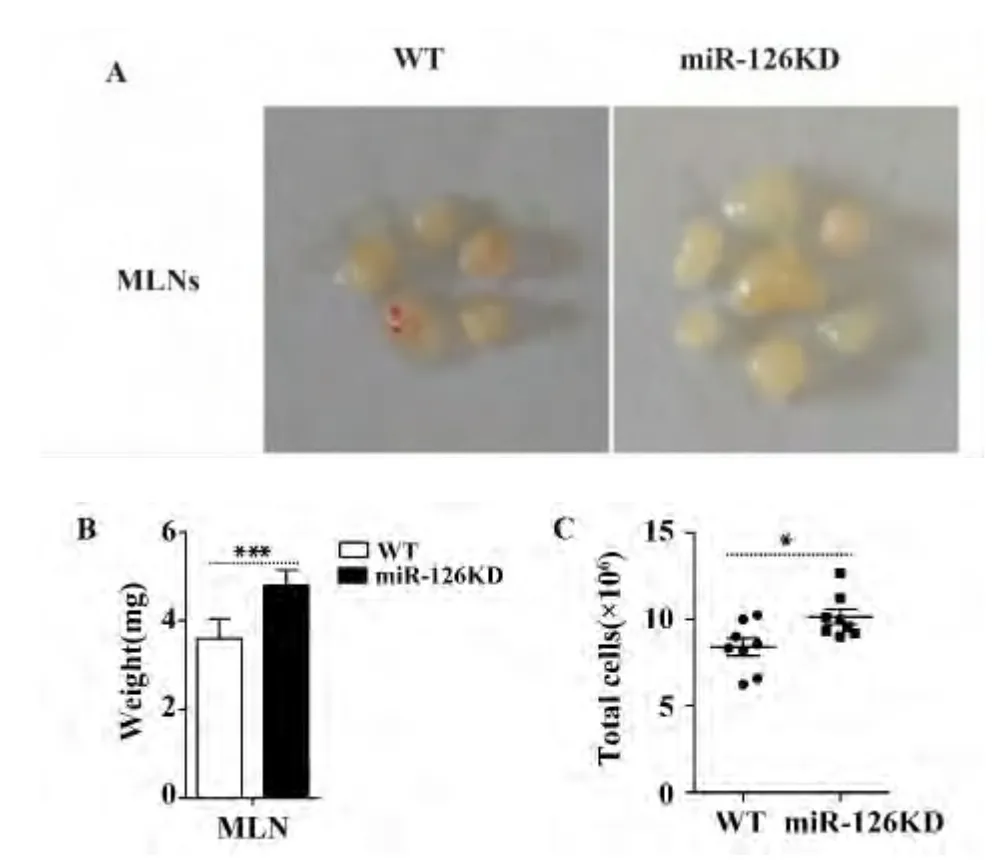
图1 miR-126KD 小鼠肠系膜淋巴结重量和细胞总数的变化Fig.1 Change on weight and total cells number in miR-126KD mice
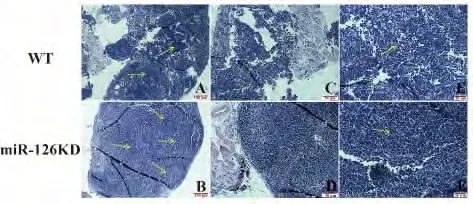
图2 miR-126KD 小鼠肠系膜淋巴结病理形态学观察(HE 染色)Fig.2 Pathologic morphology of mesenteric lymph nodes in miR-126KD mice (HE staining)
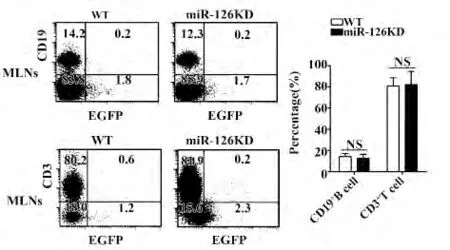
图3 WT 小鼠和miR-126KD 小鼠肠系膜淋巴结CD19 +B 细胞及CD3 + T 细胞百分数的比较Fig.3 Comparison of CD19 + B cells and CD3 + T cells in WT mice and miR-126KD mice
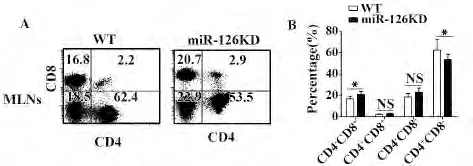
图4 WT 小鼠和miR-126KD 小鼠肠系膜淋巴结CD4 + T细胞及CD8 + T 细胞百分数的变化Fig.4 Change on proportion of CD4 + T cells and CD8 +T cells in WT mice and miR-126KD mice
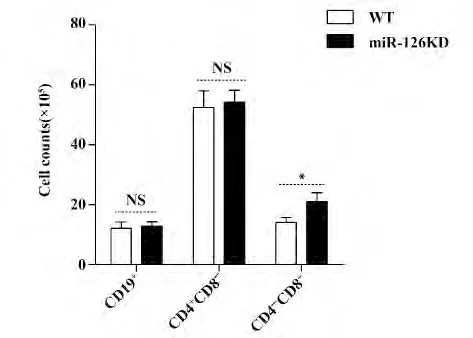
图5 WT 小鼠和miR-126KD 小鼠肠系膜淋巴结CD19 +B 细胞、CD4 + T 细胞和CD8 + T 细胞数量的变化Fig.5 Change on counts of CD19 + B cells,CD4 + T cells and CD8 + T cells in WT mice and miR-126KD mice
2.4 miR-126KD 小鼠肠系膜淋巴结CD4+T 细胞及CD8+T 细胞的百分数变化 我们进一步用FACS 检测CD4+T 细胞及CD8+T 细胞的百分数。如图4A 所示,该小鼠肠系膜淋巴结CD4+T 细胞百分数明显减少,而CD8+T 细胞百分数显著增加(图4B,P <0.05)。
2.5 miR-126KD 小鼠肠系膜淋巴结CD19+B 细胞、CD4+T 细胞和CD8+T 细胞数量的变化 最后,我们统计了miR-126KD 小鼠肠系膜淋巴结CD19+B细胞、CD4+T 细胞和CD8+T 细胞的数量。如图5 所示,CD19+B 细胞和CD4+T 细胞数量无明显差异,而CD8+T 细胞数量显著增加(图5,P <0.05)。
3 讨论
微小RNA(microRNAs,miRNAs)是新近发现的一类由内源基因编码的参与基因转录后水平调控的长约19~22 个核苷酸的非编码蛋白质的单链RNA,其在胚胎发育、细胞增殖和细胞凋亡等一系列生命进程中发挥了重要的调控作用[7]。越来越多的研究表明,miRNAs 在调控免疫应答的过程中起了重要的作用,并与免疫细胞的发育分化密切相关。如,新近Kang 等[8]报道miR-17-92 家族可通过phIpp2 调控Tfh 细胞的分化;Gracias 等[9]则报道miR-155 过表达可增强CD8+T 细胞抗病毒应答;此外,miR-10a 可通过Bcl-6 调控Th 细胞的可塑性分化[10]。然而,有关miRNAs 对黏膜免疫组织,如肠系膜淋巴结的作用的研究较少。
本研究中,我们首次发现miR-126KD 小鼠的肠系膜淋巴结体积、重量和细胞总数均显著增加。进一步的检测显示miR-126KD 小鼠肠系膜淋巴结中,CD19+B 细胞、CD3+T 细胞比例无明显变化,提示miR-126 敲减后不会显著影响B 细胞和T 细胞的组成变化。然而,有意义的是,我们发现肠系膜淋巴结中CD8+T 细胞的比例和数量均显著增加,而CD4+T 细胞的比例则明显减少,数量无差异,提示miR-126 可能对不同T 淋巴细胞亚群的影响具有差异性。类似地,Rao 等[11]报道miR-34a 敲减后,骨髓中B 淋巴细胞明显增加;Henao 等[12]则报道,miR-181 敲除后,胸腺NKT 细胞比例显著减少;此外,Kohlhaas 等[13]还报道,miR-155 敲除后,脾和肠系膜淋巴结调节性T 细胞比例和数量均显著下降。这些研究提示,特定的miRNAs 分子可能在不同的免疫器官和免疫细胞中发挥了不同的调控作用。此外,我们还发现,miR-126KD 小鼠肠系膜淋巴结中淋巴小结增生,副皮质区淋巴细胞增加,提示miR-126 还可能影响肠系膜淋巴结中淋巴细胞的分布,然而具体机制仍待阐明。
总之,本研究发现miR-126 敲减后小鼠中肠系膜淋巴结T 淋巴细胞的变化,这为后续深入探讨miR-126 在特定免疫器官和免疫细胞生物学功能中的作用提供了重要的前期实验依据。
[1]Xu XR,Liu CQ,Feng BS,et al.Dysregulation of mucosal immune response in pathogenesis of inflammatory bowel disease[J].World J Gastroenterol,2014,20(12):3255-3264.
[2]Liu W,Guo W,Guo L,et al.Andrographolide sulfonate ameliorates experimental colitis in mice by inhibiting Th1/Th17 response[J].Int Immunopharmacol,2014,0(2):337-345.
[3]Saito Y,Friedman JM,Chihara Y,et al.Epigenetic therapy upregulates the tumor suppressor microRNA-126 and its host gene EGFL7 in human cancer cells[J].Biochem Biophys Res Commun,2009,379(3):726-731.
[4]Okuyama K,Ikawa T,Gentner B,et al.MicroRNA-126-mediated control of cell fate in B-cell myeloid progenitors as a potential alternative to transcriptional factors [J].Proc Natl Acad Sci USA,2013,110(33):13410-13415.
[5]Agudo J,Ruzo A,Tung N,et al.The miR-126-VEGFR2 axis controls the innate response to pathogen-associated nucleic acids[J].Nat Immunol,2014,15(1):54-62.
[6]Qin A,Wen Z,Zhou Y,et al.MicroRNA-126 regulates the induction and function of CD4(+)Foxp3(+)regulatory T cells through PI3K/AKT pathway[J].J Cell Mol Med,2013,17(2):252-264.
[7]Voorhoeve PM.MicroRNAs:Oncogenes,tumor suppressors or master regulators of cancer heterogeneity?[J].Biochim Biophys Acta,2010,1805(1):72-86.
[8]Kang SG,Liu WH,Lu P,et al.MicroRNAs of the miR-17~92 family are critical regulators of T(FH)differentiation[J].Nat Immunol,2013,14(8):849-857.
[9]Gracias DT,Stelekati E,Hope JL,et al.The microRNA miR-155 controls CD8(+)T cell responses by regulating interferon signaling[J].Nat Immunol,2013,14(6):593-602.
[10]Takahashi H,Kanno T,Nakayamada S,et al.TGF-β and retinoic acid induce the microRNA miR-10a,which targets Bcl-6 and constrains the plasticity of helper T cells[J].Nat Immunol,2012,13(6):587-595.
[11]Rao DS,O'Connell RM,Chaudhuri AA,et al.MicroRNA-34a perturbs B lymphocyte development by repressing the forkhead box transcription factor Foxp1[J].Immunity,2010,33(1):48-59.
[12]Henao-Mejia J,Williams A,Goff LA,et al.The microRNA miR-181 is a critical cellular metabolic rheostat essential for NKT cell ontogenesis and lymphocyte development and homeostasis[J].Immunity,2013,38(5):984-997.
[13]Kohlhaas S,Garden OA,Scudamore C,et al.Cutting edge:the Foxp3 target miR-155 contributes to the development of regulatory T cells[J].J Immunol,2009,182(5):2578-2582.
