小鼠MEF/Hsf1-/-/Hsf1 细胞系的重建及Hsf1,SV40T-ag 蛋白的表达①
2014-03-18蒋杞英胡延忠王明丽马远方郑州大学基础医学院郑州450052
蒋杞英 张 智 胡延忠 王明丽 马远方 (郑州大学基础医学院,郑州 450052)
热休克转录因子1(Heat shock transcription factor 1,Hsf1)是热休克反应的主要调控者。Hsf1 介导的热休克反应不仅保护细胞免受环境或细胞内应激引起的损伤,而且涉及到对许多病理过程的调节,如炎症和肿瘤的形成[1-4]。众多研究表明,在调节肿瘤形成和发展的过程中,Hsf1 起了非常重要的作用,Hsf1 和其相关的下游靶蛋白(如HSPs)在大多数癌组织中是增高的[5-7]。
猴肾病毒40(Simian Virus 40,SV40)是双链的DNA 肿瘤病毒,已经从HIV 阳性的非何杰金氏淋巴瘤病人组织中分离出来[8]。SV40 能够表达两种早期的癌蛋白小t 抗原(t-antigen,t-ag)和大T 抗原(Tantigen,T-ag),T-ag 通常被用作转基因肿瘤鼠模型和用于转化细胞的体外研究[9]。致瘤作用主要是通过病毒性产物SV40 大T 抗原(T-antigen,T-ag)来完成的,能够使很多种细胞发生恶性转化[10,11]。
逆转录病毒介导的基因转移是80 年代才发展起来的一种高效基因转移技术。逆转录病毒载体能将目的基因高效整合于靶细胞染色体,具有高效、稳定表达的特点,并且安全性很高,是最早成功应用于临床基因治疗的载体[12,13]。
为了更好地研究Hsf1 基因的功能,本文将重建带有鼠全长Hsf1 基因的逆转录病毒载体pWZLBlast-Flag-Hsf1 和Hsf1 过表达的MEF/Hsf1-/-/Hsf1细胞系。MEF/Hsf1-/-/Hsf1 细胞系的建立,为进一步研究Hsf1 的功能提供细胞实验模型。
1 材料与方法
1.1 材料
1.1.1 主要试剂 鼠抗兔HSF1 抗体(Sc-9144)(美国Santa Cruz 公司);鼠抗兔SV40T-ag 抗体(Sc-20800)(美国Santa C ruz 公司);鼠抗小鼠β-actin抗体(A0605)(美国Sigma 公司);羊抗兔IgG(ZB-2301)和羊抗小鼠IgG(ZB-2305)(北京中杉金桥公司)。
1.1.2 细胞系和质粒 由湖南大学湘雅基础医学院肖献忠教授馈赠。(1)细胞系:①WT/MEF 细胞:应用SV40T-抗原永生化从C57B16/V129 基因背景小鼠分离的野生型胚胎成纤维细胞。②MEF/Hsf1-/-细胞:应用SV40T-抗原永生化从C57B16/V129 基因背景小鼠分离的Hsf1 敲除的胚胎成纤维细胞。③包装病毒细胞293Phoenix:为小鼠的包装细胞,在逆转录病毒载体转染时用。(2)质粒:pWZL-blast 质粒和pWZL-blast-hsf1-flag1.9 质粒。pWZL-blast-hsf1-flag1.9 质粒将全长Hsf1 的cDNA 与N末端的Flag-tag 连接,亚克隆到逆转录病毒载体pWZL-blast,构建pWZL-blast-flag-hsf1 重组体。
1.1.3 半定量RT-PCR 引物设计 根据GenBank报道的基因序列,利用Primer Premier 5.0 软件设计并合成引物以扩增SV40T-ag、p53 和Hsf1(β-actin作为内参),引物序列递交上海生物工程有限公司合成。
1.2 方法
1.2.1 细胞培养 将细胞放入含有100 U/ml 青霉素、100 μg/ml 链霉素和10%胎牛血清的DMEM 培养基中,置于37℃、5%CO2培养箱中进行细胞培养。取生长状态好、处于对数生长期的细胞进行以下实验。
1.2.2 半定量RT-PCR 实验 主要是检测Hsf1和SV40T-ag 基因在WT/MEF 细胞、MEF/Hsf1-/-细胞和MEF/Hsf1-/-/Hsf1 细胞中mRNA 的表达水平。
1.2.2.1 细胞总RNA 的提取 (1)收集5 ×106个细胞,加入1 ml Trizol,颠倒混匀,使细胞充分裂解。(2)加入0.2 ml 提RNA 的专用氯仿,颠倒混匀,室温放置10 min,13 000 r/min、4℃离心15 min。此时,溶液分三层,上层为水相含RNA,下层为有机相含DNA,中间层主要含蛋白质。小心吸取上层水相,加入等体积的异丙醇,颠倒混匀,-20℃放置20 min,沉淀RNA。(3)13 000 r/min,4℃离心15 min,弃上清。(4)加入75%RNA 专用酒精溶液(用DEPC 水配置)1 ml,颠倒混匀,13 000 r/min、4℃离心10 min,弃上清。重复洗涤沉淀一次。(5)底部白色沉淀即RNA,用吸水纸吸干。待沉淀中酒精溶液挥发完全,干燥后用无RNase DEPC 水20 μl 溶解RNA,即获得细胞总RNA 溶液。(6)在提取的RNA 溶液中,分别加入DNA 裂解酶1 μl/100 μl,37℃,5 min 灭活。然后再加入1 μl RNA 酶抑制剂,立即进行RNA 浓度的测定和反转录合成cDNA,其余-80℃保存备用。(7)RNA 浓度和纯度的测定:取2 μl RNA 溶液溶于98 μl DEPC 水中,50 倍稀释至100 μl,吹打混匀后用紫外分光光度计进行测量OD260 和OD280的值。根据OD260 的值,计算RNA 的含量,而当OD260=1 时,即相当于40 μg/ml 的RNA。根据OD260/OD280 的值,估计RNA 的质量。(8)RNA完整性的鉴定:用1%的琼脂糖凝胶电泳进行鉴定,电泳结束后将胶移至紫外灯下可以观察到28S、18S 和5S 三条rRNA 带型,28S 和18S 条带比较亮,5S 条带最不亮。通常以28S 和18S 显色强度为2∶1,RNA 无降解,如果比值逆转、升高或条带模糊则表示有RNA 的降解。
1.2.2.2 cDNA 的合成 采用Promega 公司购买的反转录试剂盒,取大约1 μg RNA 溶液进行反转录,反应体系为20 μl。取Nuclease-free water 4.5 μl,MgCl24 μl,dNTP mi ×1 μl,RNase Inhibitor 0.5 μl,RT 酶1 μl 的混合物共计11 μl 加入EP 管中,置于冰上,然后再加入RNA 样品4 μl(200 ng/ml),Oligo primer 1 μl 和5 ×RT Buffer 4 μl。再25℃5 min,42℃1 h,70℃15 min,95℃10 min,4℃终止反应。即可获得WT/MEF 细胞和MEF/Hsf1-/-细胞的cDNA 溶液,-80℃保存备用。
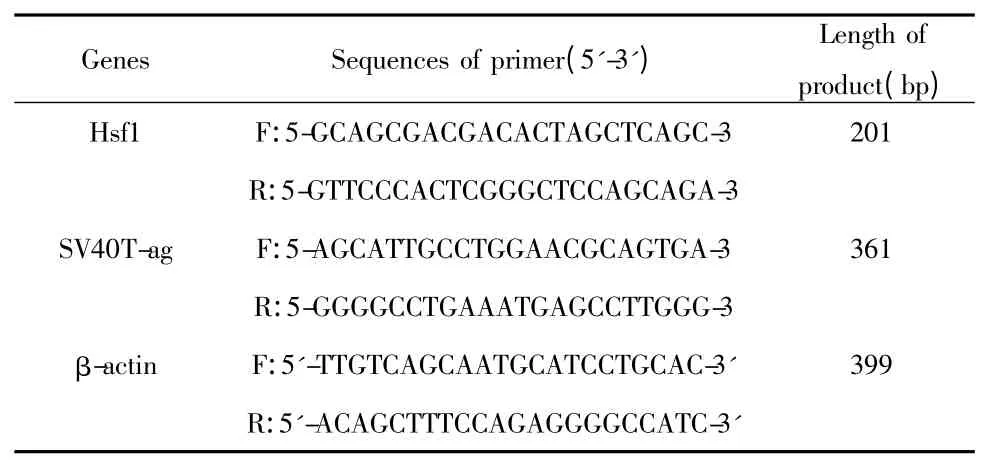
表1 用于半定量RT-PCR 引物设计Tab.1 Primers used for gene expression analysis by semiquantitative RT-PCR
1.2.2.3 PCR 实验 将上述获得的cDNA 为模板,对内参β-actin 基因片段进行克隆,按以下体系进行PCR 反应。(1)将引物稀释到1 μmol/L,上游和下游引物各吸取1 μl。(2)cDNA 稀释到200 ng/ml。(3)PCR 反应体系:cDNA 1 μl,10 × Buffer 2 μl,dNTP 2 μl,Tag 酶0.25 μl,dH2O213.25 μl,上游引物1 μl,下游引物1 μl,总体积20 μl。(4)PCR 反应条件:95℃5 min,95℃30 min,退火温度(56.4℃,55℃)45 s,72℃40 s,30 个循环,72℃10 min,18℃终止反应。(5)为了鉴定PCR 产物,采用2%琼脂糖凝胶电泳,如果在399 bp 处出现β-actin 内参条带,证明cDNA 反转录成功,可以进行下面的实验。(6)用上述反转录成功的cDNA 为模板克隆Hsf1 和SV40T-ag 基因片段。Hsf1 的退火温度设计为56.4℃,SV40T-ag 的退火温度为55℃。按上述总体积20 μl 的反应体系进行PCR 反应。2%琼脂糖凝胶电泳鉴定PCR 产物,观察在201 bp 和361 bp 处是否能扩增出Hsf1 和SV40T-ag 特异性目的条带,两种细胞是否有差异?
1.2.3 pWZL-Blast-Flag-Hsf1 质粒功能的鉴定 通过瞬时转染的方法,将构建好的带有Hsf1 全长基因的逆转录病毒载体pWZL-blast-flag-Hsf1 质粒作为实验组,逆转录病毒空载体pWZL-blast 质粒作为对照组,分别用脂质体2000 转染试剂(美国Invitrogen)转染293T 细胞,继续培养48 h~72 h。常规收细胞进行Hsf1 的Western blot 检测,以观察Hsf1 蛋白的表达,从而进一步判断新转入Hsf1 基因的功能。
1.2.4 MEF/Hsf1-/-/Hsf1 细胞系的建立 将构建好的带有Hsf1 全长基因的逆转录病毒载体pWZLblast-flag-Hsf1,导入产生病毒的小鼠包装细胞293Phoenix 内,收集病毒上清,感染MEF/Hsf1-/-细胞,建立MEF/Hsf1-/-/Hsf1 细胞系。具体实验步骤如下:(1)在20 cm2培养瓶正常培养包装细胞293Phoenix,细胞密度达60%左右,细胞状态好,转染前一天换新鲜培养基DMEM。(2)转染复合物的形成:分为两组:①脂质体2000 转染试剂9 μl,pWZL-blast-flag-Hsf1 质粒3 μg 和Pleco 质粒1.5 μg 共转染;②脂质体2 000 转染试剂9 μl;pWZL-blast 质粒3 μg 和Pleco 质粒1.5 μg 共转染。上述脂质体2 000 转染试剂和质粒分别用500 μl MEM 稀释,充分混匀,但是不要剧烈震荡。稀释后的脂质体2 000室温静置5 min,然后与稀释后的质粒混合物充分混匀,室温静置30 min,切记不要剧烈震荡。(3)将上述制备的转染复合物分别加入包装细胞293Phoenix 的无血清、无双抗培养基中,培养6 h 后换为全血清的DMEM 培养基,继续培养24 h;换新的全血清DMEM 培养基,再继续培养24 h,收集含有病毒的培养上清。(4)将含有病毒液的培养基1 000 r/min,离心5 min,然后上清用0.45 mm 滤器过滤。在滤液中,加入2 μg/ml的Polybrene 试剂(美国Sigma 公司)后,直接加至生长状态好、密度50% 左右的MEF/Hsf1-/-细胞培养瓶中,让病毒液直接感染MEF/Hsf1-/-细胞。(5)感染24 h 后,加入3 μg/ml 的Blasticidine(美国Sigma 公司)杀伤3~4 d,没有被病毒感染的MEF/Hsf1-/-细胞会被杀死。然后用2 μg/ml 的Blasticidine 作为维持量,继续培养细胞。这时,Hsf1 基因应该转入MEF/Hsf1-/-细胞中,MEF/Hsf1-/-/Hsf1 细胞系的重建是否成功须进一步鉴定。(6)MEF/Hsf1-/-/Hsf1 细胞系的鉴定:通过Western blot 实验检测Hsf1 蛋白的表达,以观察Hsf1 是否成功转入MEF/Hsf1-/-细胞及功能如何?
1.2.5 Western blot 实验 在WT/MEF 细胞、MEF/Hsf1-/-细胞和MEF/Hsf1-/-/Hsf1 细胞以及转染Hsf1的293T 细胞中,分别加入蛋白裂解液,其中含有蛋白酶抑制剂(Protease inhibitor Cocktail)(美国Sigma公司)提取细胞总蛋白,BCA 法测蛋白浓度(碧云天生物技术研究所),制作蛋白样品。通过10% SDSPAGE 电泳电转至PVDF 膜上,PVDF 膜先用含5%脱脂奶粉的TBST 溶液室温下封闭1 h,加一抗(Hsf1、SV40T-ag 和β-actin)于含5% 脱脂奶粉的TBST 中孵育,4℃冰箱过夜。然后加入合适的二抗孵育1 h,用ECL 显色液显色、曝光X 光片、拍照和分析实验结果。
2 结果
2.1 WT/MEF 细胞、MEF/Hsf1-/-细 胞和MEF/Hsf1-/-/Hsf1 细胞的鉴定 通过半定量RT-PCR 实验,从转录水平观察Hsf1 和SV40T-ag 基因在WT/MEF 细胞、MEF/Hsf1-/-细胞和MEF/Hsf1-/-/Hsf1 细胞中mRNA 的表达;通过Western blot 实验,从翻译水平即蛋白质水平观察Hsf1 和SV40T-ag 蛋白在WT/MEF 细胞、MEF/Hsf1-/-细胞和MEF/Hsf1-/-/Hsf1 细胞中的表达。
2.1.1 Hsf1 和SV40T-ag 基 因 在WT/MEF 和MEF/Hsf1-/-细胞中mRNA 的表达 从图1A 可以看出,用Trizol 试剂提取细胞总RNA,通过1%琼脂糖凝胶电泳图发现,从上到下出现28S、18S 和5S 三条清晰的rRNA 带型,没有拖带现象。28S条带最亮,大约是18S 条带亮度的两倍,5S 不太亮。图中没有出现基因组DNA 和蛋白质污染情况,说明提取RNA 的纯度和完整性比较好,可以进行后续实验。
利用Promega 公司反转录试剂盒将总RNA 立即反转为cDNA,经过PCR 扩增后采用2%琼脂糖凝胶电泳进行检测。图1B 显示,WT/MEF 细胞、MEF/Hsf1-/-细胞和MEF/Hsf1-/-/Hsf1 细胞在399 bp扩增出基本一致的β-actin 特异性条带,说明通过反转录试剂盒反转的cDNA 模板是成功的。
图1C 结果显示,Hsf1 基因在WT/MEF 细胞和MEF/Hsf1-/-/Hsf1 细胞中扩增出特异性目的条带,而在MEF/Hsf1-/-细胞中没有出现Hsf1 基因条带。由于在WT/MEF 和MEF/Hsf1-/-/Hsf1 细胞中Hsf1基因的mRNA 表达明显,而在MEF/Hsf1-/-细胞中表达不明显,这说明MEF/Hsf1-/-细胞中Hsf1 基因的敲除是比较干净的,同时也说明通过逆转录病毒载体转染全长Hsf1 基因是成功的,新建MEF/Hsf1-/-/Hsf1 细胞系是成功的。
图1D 结果表明,SV40T-ag 基因在WT/MEF 细胞、MEF/Hsf1-/-细胞和MEF/Hsf1-/-/Hsf1 细胞中均扩增出特异性目的条带,并且SV40T-ag 基因的mRNA 表达基本一致,这也说明在转录水平上Hsf1 对SV40T-ag 的调控没有影响。
2.1.2 Hsf1,SV40T-ag 蛋白在WT/MEF 和MEF/Hsf1-/-细胞中的表达 通过Western blot 实验检测WT/MEF 细胞和MEF/Hsf1-/-细胞中Hsf1 和SV40Tag 蛋白的表达。图2 所示,Hsf1 蛋白在WT/MEF 细胞中的表达条带非常明显,而在MEF/Hsf1-/-细胞中的表达条带几乎看不到。说明在MEF/Hsf1-/-细胞中Hsf1 的敲除是比较干净的。另外,SV40T-ag 蛋白在MEF/Hsf1-/-细胞中的表达明显比在WT/MEF 细胞中表达强。这也说明Hsf1 下调SV40T-ag 蛋白的表达。
综上所述,在基因水平和蛋白水平皆证明了MEF/Hsf1-/-细胞中Hsf1 基因的敲除是比较干净的,可以进行下面的实验。同时也证明了Hsf1 参与了SV40T-ag 蛋白表达的调控,主要在翻译水平即蛋白质水平的表达。
2.2 pWZL-blast-Flag-Hsf1 质粒的鉴定 将实验组pWZL-blast-flag-hsf1 质粒和对照组pWZL-blast 质粒分别转染293T 细胞,进行Hsf1 的Western blot 检测。
图3 结果显示,Hsf1 蛋白在转染pWZL-blastflag-hsf1 质粒的293T 细胞中的表达明显比转染pWZL-blast 质粒强得多。说明pWZL-blast-flag-hsf1质粒转染成功,同时也说明pWZL-blast-flag-hsf1 质粒是有功能和活性的,可以继续下面的实验。
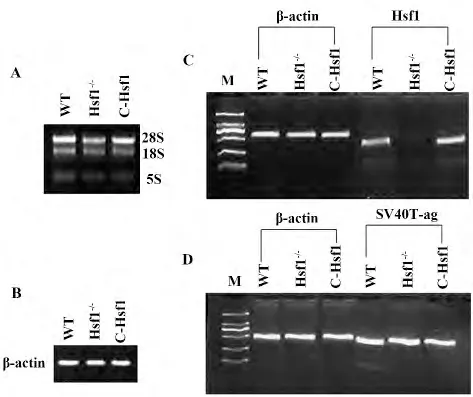
图1 三种MEF 细胞中Hsf1 和SV40T-ag 基因的mRNA表达Fig.1 mRNA expression of Hsf1 and SV40T-ag gene in three MEF cell
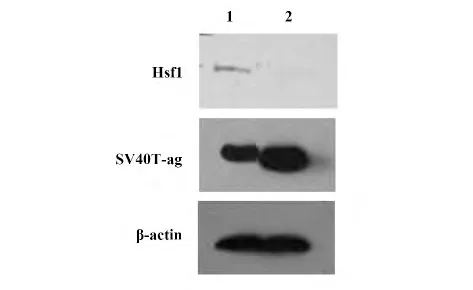
图2 Hsf1,SV40T-ag 蛋白在WT/MEF 和MEF/Hsf1-/-细胞中的表达Fig.2 Expression of Hsf1 and SV40T-ag proteins in WT/MEF and MEF/Hsf1-/-cell lines
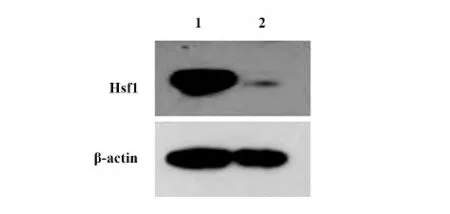
图3 Hsf1 蛋白在转染pWZL-blast-flag-Hsf1 的293T 细胞中的表达Fig.3 Expression of Hsf1 protein were investigated in 293T cell of transfection with plasmid pWZLblast-flag-Hsf1
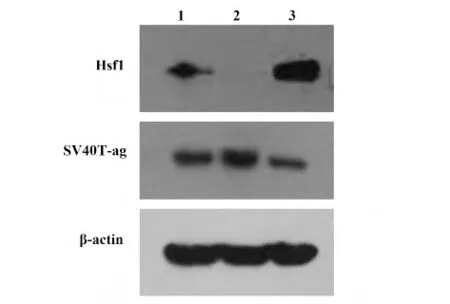
图4 Hsf1,SV40T-ag 蛋白在三种MEF 细胞中的表达Fig.4 Expression of Hsf1 protein in three MEF cell lines
2.3 Hsf1,SV40T-ag 蛋白在三种MEF 细胞中的表达 通过逆转录病毒载体将鼠Hsf1 全长基因导入MEF/Hsf1-/-细胞中,建立MEF/Hsf1-/-/Hsf1 细胞系。为了鉴定Hsf1 基因是否转入成功及功能如何?通过Western blot 检测Hsf1 蛋白的表达,同时用MEF/Hsf1-/-细胞和WT/MEF 细胞作为对照。图4 可以看出,Hsf1 在MEF/Hsf1-/-/Hsf1 细胞表达条带最强,WT/MEF 细胞表达也能看到清晰的条带,而MEF/Hsf1-/-细胞不表达。这说明Hsf1 基因已经成功导入MEF/Hsf1-/-细胞,MEF/Hsf1-/-/Hsf1 细胞系成功建立。MEF/Hsf1-/-/Hsf1 细胞系的重建,有助于我们进一步研究Hsf1 在SV40T-ag 诱导肿瘤形成中的作用。
另外,SV40T-ag 蛋白在MEF/Hsf1-/-细胞中的表达比WT/MEF 细胞和MEF/Hsf1-/-/Hsf1 细胞强,在MEF/Hsf1-/-/Hsf1 细胞中的表达最弱。这也提示我们Hsf1 参与了SV40T-ag 蛋白的表达调控。
3 讨论
基因转移是指用生物学或物理的手段,可将外源性基因导入受体细胞,并使其表达的一种技术。逆转录病毒作为载体是一种高效的、新兴起的表达系统,可将外源性基因安全、高效、稳定地转入哺乳类细胞中[13,14]。而外源基因与宿主细胞基因组整合后,就可随着细胞的分裂传给后代。当包装细胞被收获后,就可以稳定地得到含有目的载体的病毒颗粒。没有经过包装的病毒属于缺陷性病毒,并不具有完整的功能。只有经过包装细胞为其提供结构蛋白组分时,才能包装成功能完整的病毒颗粒。当病毒颗粒感染靶细胞后,病毒颗粒是不能扩增的,安全性也是很高的[12]。而与质粒转染外源基因等传统的介导方法相比,逆转录病毒表达系统可以大大提高获得高效表达外源基因细胞系的几率。
转染细胞能否表达目的基因的表型,是基因转移成功的关键。本文首先将本实验室保存的WT/MEF 细胞和MEF/Hsf1-/-细胞,进行RT-PCR 和Western blot 实验,验证了MEF/Hsf1-/-细胞系的Hsf1 敲除比较干净。为了更好地研究Hsf1 在SV40T-ag 诱导肿瘤形成中的作用,应用脂质体2 000转染试剂,将含有Hsf1 基因全长的逆转录病毒载体pWZL-blast-flag-hsf1 转染至能产生病毒的包装细胞293Phoenix,将病毒上清直接进行感染MEF/Hsf1-/-细胞,用3 μg/ml 抗生素Blasticidine 杀伤细胞3~4 d,这样没有转染成功的细胞被杀死,转染成功的细胞存活下来。以后细胞培养用2 μg/ml 抗生素Blasticidine 进行维持,稳定的MEF/Hsf1-/-/Hsf1 细胞系就建好了。通过Western blot 实验检测Hsf1 蛋白的表达,结果发现,在新建细胞系Hsf1 的表达最强,而MEF/Hsf1-/-细胞的表达非常弱,说明Hsf1 成功转染,稳定表达Hsf1 的MEF/Hsf1-/-/Hsf1 细胞系成功建立,以进行后续的Hsf1 基因功能的实验。
另外,我们也在基因水平和蛋白质水平,分别通过RT-PCR 和Western blot 实验观察了SV40T-ag 的表达,结果发现SV40T-ag 基因在WT/MEF 细胞和MEF/Hsf1-/-细胞中的表达没有差异;SV40T-ag 蛋白在MEF/Hsf1-/-细胞表达强于WT/MEF 细胞和MEF/Hsf1-/-/Hsf1 细胞。初步推测Hsf1 对SV40Tag 的调控作用不在基因水平,主要在翻译水平即蛋白质水平的表达。
总之,MEF/Hsf1-/-/Hsf1 细胞系的重建,有助于进一步研究Hsf1 在SV40T-ag 诱导肿瘤形成中的作用提供实验模型。另外,本研究中还发现Hsf1 参与了SV40T-ag 蛋白的表达调控,尚需进行更深入的探讨。
[1]He H,Soncin F,Grammatikakis N,et al.Elevated expression of heat shock factor (HSF)2A stimulates HSF1-induced transcription during stress [J].J Biol Chem,2003,278 (37):35465-35475.
[2]Voellmy R.On mechanisms that control heat shock transcription factor activity in metazoan cells[J].Cell Stress & Chaperones,2004,9(2):122-133.
[3]Whitesell L,Lindquist SL.HSP90 and the chaperoning of cancer[J].Nat Rev Cancer,2005,5(10):761-772.
[4]Mendillo ML,Santagata S,Koeva M,et al.HSF1 drives a transcriptional program distinct from heat shock to support highly malignant human cancers[J].Cell,2012,150(3):549-562.
[5]Sherman M and Multhoff G .Heat shock proteins in cancer[J].Ann N Y Acad Sci,2007,1113:192-201.
[6]Chen H,Zhang S,Fang YM,et al.Induction of HSF1 expression is associated with sporadic colorectal cancer[J].World J Gastroenterol,2004,10(21):3122-3126.
[7]Wang J,He H,Yu L,et al .HSF1 down-regulates XAF1 through transcriptional regulation[J].J Biol Chem,2006,281(5):2451-2459.
[8]Sweet BH,Hilleman MR .The vacuolating virus SV40[J].Proc Soc Exp Biol Med,1960,105:420-427.
[9]Goodsell DS.The molecular Perspective:Simian virus 40.Stem Cells,2002,4:301-303.
[10]Sullivan CS,Pipas JM.T antigens of simian virus 40:molecular chaperones for viral replication and tumorigenesis[J].Microbiol Mol Biol Rev,2002,66(2):179-202.
[11]Tevethia MJ,Ozer HL.SV40-mediated immortalization [J].Methods Mol Biol,2001,165(2):185.
[12]Franceschini IA,Feigenbaum-Lacombe V,Casanova P,et al.Efficient gene transfer in mouse neural precursors with a bicistronic retroviral vector[J].J Neurosci Res,2001,65(3):208-219.
[13]Lundsom K.Latest development in viral vectors for gene therapy[J].Trends Biotechnol,2003,21(3):117-22.
[14]李 炯,刘艳红,安芳兰,等.逆转录病毒载体介导的口蹄疫病毒衣壳前体基因和绿色荧光蛋白基因在BHK-21 细胞中的表达[J].畜牧兽医学报,2009,40(3):376-382.
