甲状腺乳头状癌患者血清、癌组织中p53、Fas、TNF-α 和Cyclin E 的表达及临床意义①
2014-03-18孙勤暖李冬梅徐晓艳于慧玲
孙勤暖 李冬梅 吴 罡 屠 军 云 芬 徐晓艳 于慧玲
(内蒙古医科大学病理教研室,呼和浩特 010059)
甲状腺肿瘤是人类头颈部疾病中的常见病和多发病,而甲状腺乳头状腺癌是甲状腺肿瘤中最常见的恶性肿瘤,约占甲状腺癌的60%~70%,但我们对其发生发展的机制知之甚少[1]。肿瘤的发生发展是一个多因素的生物学行为,其发生发展可能与众多癌基因、抑癌基因有关,因此探索不同基因在甲状腺乳头状癌中的表达情况,有助于我们更好地了解其发生机制及指导临床治疗[2]。目前国内外对甲状腺乳头状癌的研究在逐渐地深入,但对其发生机制尚不清楚,因此找到甲状腺乳头状癌发生发展的分子标记物,是早期诊断甲状腺乳头状癌的关键。本研究采用酶联免疫学分析、免疫组织化学技术及分子生物学技术联合检测凋亡因子:p53、Fas、TNFα 和Cyclin E 在甲状腺乳头状癌中的表达,探讨p53、Fas、TNF-α 和Cyclin E 能否成为甲状腺乳头状癌发生发展的分子标记物,以利于提高甲状腺乳头状癌早期诊断率,同时探讨其与甲状腺乳头状癌的发生发展、转移关系,为指导甲状腺癌临床诊断及判断预后提供参考。
1 材料与方法
1.1 临床资料 随机选择内蒙古医科大学附属医院2012 年4 月至2013 年8 月,经穿刺确诊为甲状腺乳头状癌的住院患者74 例作为实验组[癌组织74 例及对应的癌旁组织74 例,男29 例、女45 例,平均年龄(40.3±3.6)岁]、同期体检健康人26 例作为正常对照组[男12 例、女14 例,平均年龄(37.9±2.4)岁]。癌症患者全部排除其他器官瘤变,具有可比性。
1.2 实验试剂和主要仪器 兔抗人p53、Fas、TNFα 和Cyclin E 多克隆抗体均购于Santa Cruz 公司;SP 免疫组织化学试剂盒和DAB 显色试剂盒购于福州迈新生物技术有限公司;p53、Fas、TNF-α 和Cyclin E ELISA 试剂盒购于南京建成生物有限公司;Trizol、引物、反转录试剂盒及实时荧光定量PCR 试剂盒均购于北京鼎国生物有限公司。Leica RM 2245石蜡切片机(德国)、Leica HI1210 捞片机(德国)、LEICA HI1220 摊片机(德国);LEICA EG1150 包埋机(德国);Biotek Epoch 酶标仪(美国);实时荧光定量PCR 仪(型号ABI7300,美国);Biometra PCR 扩增仪(美国);OLYMPUS BX51(日本)。
1.3 检测指标
1.3.1 血清、癌旁正常组织和癌组织中p53、Fas、TNF-α 和Cyclin E 蛋白含量的测定 采用ELISA 方法检测,严格按照试剂盒操作。
1.3.2 癌旁正常组织和癌组织中p53、Fas、TNF-α和Cyclin E 蛋白阳性强度的测定 采用免疫组织化学方法,常规石蜡切片,4 μm,操作步骤严格按照说明书进行,DAB 显色后,用苏木精复染,封片。光镜下观察见棕黄色为阳性表达,结果分析采用Motic Images Advanced 3.2 图像分析系统测灰度值,灰度值越低,蛋白含量越高。
1.3.3 癌组织中p53、Fas、TNF-α 和Cyclin E 蛋白阳性率的测定 分析p53、Fas、TNF-α 和Cyclin E 的表达与甲状腺乳头状癌的临床分期、病理类型及有无淋巴结转移的关系。在200 倍镜下观察全片,按阳性细胞所占百分比及着色程度进行结果判定[3]。按阳性细胞比例判定:阳性细胞<10% 计1 分,10%~50%计2 分,>50%计3 分。按染色程度判定:阴性为0 分,淡黄色为1 分,中度黄色2 分,棕黄色3 分。按(阳性细胞得分×染色程度)得分计总分,总分<3 分为阴性,≥3 分为阳性。
1.3.4 癌旁正常组织和癌组织中p53、Fas、TNF-α和Cyclin E 的基因表达的检测 引物序列由北京鼎国生物有限公司合成。P53:Sense:5'-GAAGCAGTAAGTCAGGAGGGTT-3',Antisense:5'-GGAAGGTTCTAGGCTGGAGG-3',产物254 bp;FAS:Sense:5'-TGTGATGAAGGGCATGGTTT-3',Antisense:5'-TTGGTGTTGCTGGTTCGTG-3',产 物 176 bp;TNF-α:Sense:5'-GGTGATCGGTGCCAACAAGGA-3',Antisense:5'-CACGCTGGCTCAGCCACTG-3',产物173 bp;Cyclin E:Sense:5'-CCACCTCCATCACCACTACCA-3',Antisense:5' -CCATTCCAACCAGAGCCACC-3',产物136 bp。
1.4 统计学分析 采用SPSS13.0 软件进行统计学分析,血清、癌旁正常组织和癌组织中p53、Fas、TNF-α 和Cyclin E 的检测结果均以±s 表示,组间比较采用χ2检验。
2 结果
2.1 血清、癌旁正常组织和癌组织中p53、Fas、TNF-α 和Cyclin E 蛋白含量的比较 术前,实验组患者血清中p53、Fas 和TNF-α 的蛋白含量明显低于正常对照组,Cyclin E 的蛋白含量明显高于正常对照组,差异均有统计学意义(P <0.01);术后,实验组患者血清中p53、Fas 和TNF-α 的蛋白含量低于正常对照组,Cyclin E 的蛋白含量高于正常对照组,差异亦均有统计学意义(P <0.05),见表1。实验组患者癌组织中p53、Fas 和TNF-α 的蛋白含量明显低于癌旁正常组织,Cyclin E 的蛋白含量明显高于癌旁正常组织,差异亦均有统计学意义(P <0.05),见表2。
2.2 癌旁正常组织和癌组织中p53、Fas、TNF-α 和Cyclin E 蛋白阳性强度的比较 光学显微镜观察:免疫组织化学染色阳性部位为细胞质染为棕黄色,细胞核用苏木精复染为蓝色。实验组患者癌组织中p53、Fas 和TNF-α 的蛋白阳性表达强度明显低于癌旁正常组织,Cyclin E 的蛋白阳性表达强度明显高于癌旁正常组织,差异均有统计学意义(P <0.05),见表3 及图1、2。
2.3 癌旁正常组织和癌组织中p53、Fas、TNF-α 和Cyclin E 基因水平的比较 实验组患者癌组织中p53、Fas 和TNF-α 的基因水平明显低于癌旁正常组织,Cyclin E 的基因水平明显高于癌旁正常组织,差异均有统计学意义(P <0.05),见表4。
表1 手术前后两组血清中p53、Fas、TNF-α 和Cyclin E 蛋白含量的比较(±s)Tab.1 Comparison of two groups p53,Fas,TNF-α and Cyclin E protein content in serum before and after operation(±s)
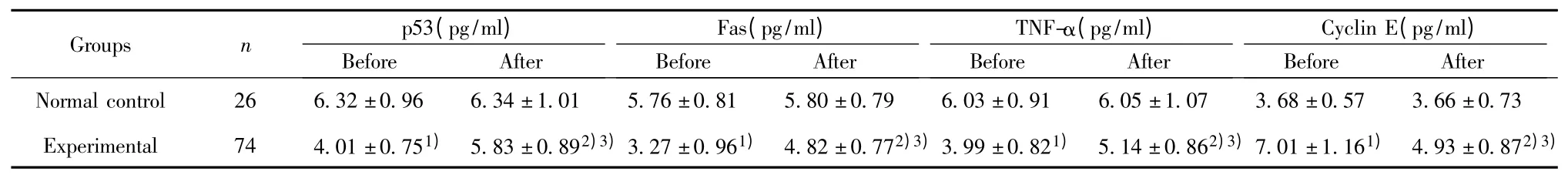
表1 手术前后两组血清中p53、Fas、TNF-α 和Cyclin E 蛋白含量的比较(±s)Tab.1 Comparison of two groups p53,Fas,TNF-α and Cyclin E protein content in serum before and after operation(±s)
Note:1)P <0.01,2)P <0.05 compared with normal control group;3)P <0.01 compared with before.
表2 癌旁正常组织、癌组织中p53、Fas、TNF-α 和Cyclin E蛋白含量的比较(±s)Tab.2 Comparison of p53,Fas,TNF-α and Cyclin E protein content in normal para cancer tissue and cancer tissue(±s)

表2 癌旁正常组织、癌组织中p53、Fas、TNF-α 和Cyclin E蛋白含量的比较(±s)Tab.2 Comparison of p53,Fas,TNF-α and Cyclin E protein content in normal para cancer tissue and cancer tissue(±s)
Note:1)P <0.01 compared with normal para cancer tissue.
表3 癌旁正常组织、癌组织中p53、Fas、TNF-α 和Cyclin E蛋白阳性强度的比较(±s)Tab.3 Comparison of p53,Fas,TNF-α and Cyclin E protein positive strength in normal para cancer tissue and cancer tissue(±s)

表3 癌旁正常组织、癌组织中p53、Fas、TNF-α 和Cyclin E蛋白阳性强度的比较(±s)Tab.3 Comparison of p53,Fas,TNF-α and Cyclin E protein positive strength in normal para cancer tissue and cancer tissue(±s)
Note:1)P <0.01 compared with normal para cancer tissue.

图1 p53、Fas、TNF-α 和Cyclin E 在甲状腺乳头状癌组织中的表达(免疫组织化学染色,×200)Fig.1 Expression of p53,Fas,TNF-α and Cyclin E in thyroid papillary carcinoma (immunohistochemical staining,×200)

图2 p53、Fas、TNF-α 和Cyclin E 在癌旁正常组织中的表达(免疫组织化学染色,×200)Fig.2 Expression of p53,Fas,TNF-α and CyclinE in normal tissues adjacent to cancer (immunohistochemical staining,×200)
表4 癌旁正常组织、癌组织中p53、Fas、TNF-α 和Cyclin E基因水平的比较Tab.4 Comparison of v53,Fas,TNF-α and Cyclin E gene level in normal para cancer tissue and cancer tissue(±s)

表4 癌旁正常组织、癌组织中p53、Fas、TNF-α 和Cyclin E基因水平的比较Tab.4 Comparison of v53,Fas,TNF-α and Cyclin E gene level in normal para cancer tissue and cancer tissue(±s)
Note:1)P <0.01 compared with normal para cancer tissue.
2.4 癌组织中p53、Fas、TNF-α 和Cyclin E 蛋白阳性率与临床病理特征关系的测定 p53、Fas、TNF-α和Cyclin E 蛋白阳性表达率与甲状腺乳头状癌临床分期、病理类型和有无淋巴结转移均有明显相关性(P <0.01);p53、Fas、TNF-α 均随着病变的加重表达减少,而Cyclin E 随着病变的加重表达增多,见表5。

表5 p53、Fas、TNF-α 和Cyclin E 的表达与甲状腺乳头状癌临床特征的关系Tab.5 Relationship between clinical features and expression of thyroid papillary carcinoma p53,Fas,TNF-α and Cyclin E
3 讨论
甲状腺癌是近20 年发病率增长最快的实体恶性肿瘤,年均增长6.2%[4]。大多数甲状腺肿瘤应用组织病理学和细胞学检查能做出诊断,但有些甲状腺肿瘤的良恶性不易区分,用常规检查难以做出明确分类,此时需应用一些新技术(如免疫组织化学、细胞和分子遗传学技术)辅助诊断,区分肿瘤不同的生物学行为,以避免过度治疗和保证及时有效治疗[5]。细胞凋亡又称程序性死亡,是在某些生理和病理条件下,细胞主动参与自身有一定程序的死亡过程,近年来细胞凋亡与肿瘤的关系日益密切,从基因学角度探讨肿瘤发生发展、浸润、转移的机制已经成为研究热点[6,7]。
已有研究证实,细胞凋亡及其调控基因异常是肿瘤发生的重要机制之一[8,9],多种基因参与细胞凋亡的调控,其中包括p53、Fas、TNF-α 和Cyclin E等基因,凋亡不仅存在于正常组织,也存在于肿瘤组织,因此在肿瘤的发生发展及治疗中起着重要作用。Fas 抗原是人体多种细胞表面的一种膜蛋白,是一种触发凋亡的蛋白质,它属于肿瘤坏死因子/神经生长因子受体家族;当它与Fas 配体或抗Fas 抗体结合时诱导凋亡[10]。TNF-α 是一个多效性的细胞因子,由巨噬细胞产生,广泛参与细胞反应,包括发热、休克、组织损伤以及肿瘤坏死等效应,并诱导其他细胞因子、免疫调节因子参与细胞增生、分化与凋亡。TNF-α 与癌细胞表面受体结合成复合物进入细胞并与溶酶体融合,在TNF-α 的作用下溶酶体裂解释放蛋白酶类导致细胞自溶[11,12]。Cyclin E 是一种核蛋白,Cyclin E 的表达受细胞周期调节,并在G1 期末达到高峰。Cyclin E 在许多人类肿瘤中存在高表达,它能特异性地与细胞周期依赖激酶(CDK2)结合形成Cyclin E/CDK2 复合物,可以使底物磷酸化,释放转录因子,使细胞通过起始点进入S 期。在异常情况下,Cyclin E 过度表达存在于整个细胞周期中并持续地激活CDK2,底物磷酸化持续进行[13,14]。p53 基因作为肿瘤抑制基因已被人们熟知,它分为两型:一型是使细胞周期停止在G1 期,抑制细胞繁殖的野生型;一型是具有突变能力的变异型[15]。野生型p53 可诱导易感细胞发生凋亡、捕获G1 周期,引起p53 激活与DNA 修复有关或凋亡的相关基因如TNF-α 和Fas,大量资料表明p53 因阻滞细胞周期和诱导细胞凋亡而达到抗癌作用;而变异型p53基因则无此功能,因此缺失p53 诱导的凋亡可能是转化为肿瘤的重要因素之一[16]。
综上所述,本实验研究结果表明:甲状腺乳头状癌的发生发展与p53、Fas、TNF-α 基因的下调和Cyclin E 基因的上调密切相关,p53 的缺失进一步诱导了Fas、TNF-α 的低表达和Cyclin E 的高表达,继而促进细胞异常增殖、肿瘤形成。四种蛋白的阳性表达率与甲状腺乳头状癌临床分期、病理类型和有无淋巴结转移均有明显相关性,提示p53、Fas、TNF-α和Cyclin E 可能在甲状腺乳头状癌浸润和转移中起重要作用,四者的联合检测可成为判断预后和指导临床用药的指标。
[1]朱雄增.甲状腺癌诊治相关的病理学研究进展[J].中国实用外科杂志,2010,30(10):889-891.
[2]徐 璇,于世鹏.生长分化因子-15 在甲状腺乳头状癌中的表达及意义[J].中国免疫学杂志,2014,30 (4):468-471.
[3]杜华贞,张延新,李维山,等.Kiss-1 与TIMP-1 在胃癌中的表达及临床病理意义[J].临床与实验病理学杂志,2008,24(3):374-377.
[4]阿勒哈,孟庆彬,于健春,等.甲状腺癌分子发病机制研究进展[J].中国医学科学院学报,2013,35(4):382-385.
[5]彭 茜,安振梅.甲状腺癌分子生物学研究进展[J].华西医学,2014,29(2):368-373.
[6]Fukahori M,Yoshida A,Hayashi H,et al.The associations between RAS mutations and clinical characteristics in follicular thyroid tumors:new insights from a single center and a large patient cohort[J].Thyroid,2012,22(7):683-689.
[7]Ding WX,Manley S,Ni HM.The emerging role of autophagy in alcoholic liver disease[J].Exp Biol Med(Ma-ywood),2011,236(5):546-556.
[8]冯真真,夏海滨.细胞凋亡相关分子与肿瘤基因治疗[J].生命的化学,2009,29(5):705-710.
[9]曹 妍,王大南,孙 玥,等.抗癌药SN38 通过脂筏促进Fas介导的细胞凋亡[J].中国免疫学杂志,2012,28(7):603-607.
[10]王 强,杨志雄,廖思海.Fas、FasL 和Caspase-3 在肺癌中的表达及其临床意义[J].现代肿瘤医学,2009,17(2):248-251.
[11]张磊磊.肿瘤坏死因子相关凋亡诱导配体抗肿瘤作用研究进展[J].中华实用诊断与治疗杂志,2013,27(7):629-631.
[12]李 涛,陈正望.TNF-α 在肿瘤中的作用[J].现代生物医学进展,2011,11(18):3586-3588.
[13]杨正平.Cyclin E/Cdks 复合物相关调控分子与肿瘤关系的研究进展[J].实用肿瘤学杂志,2008,22(2):185-188.
[14]鲍正齐,肖玉周,张长春,等.Cyclin E 和p27 蛋白在骨肉瘤中的表达及临床意义[J].中国组织化学与细胞化学杂志,2013,22(2):161-166.
[15]Lu C,El-Deiry WS.Targeting p53 for enhanced radio and chemosensi-tivity[J].Apoptosis,2009,14(4):597-606.
[16]Guan YS,Liu Y,Zou Q,et al.Adenovirus-mediated wild-type p53 gene transfer in combination with bronchial arterial infusion for treatment of advanced non-small-cell lung cancer,one year followup[J].J Zhejiang Univ Sci B,2009,10(5):331-340.