木薯FEC诱导及农杆菌介导转化的研究进展
2014-03-17程琴金刚李慧敏彭欣怡黎萍王丽萍
程琴 金刚 李慧敏 彭欣怡 黎萍 王丽萍
(广西亚热带作物研究所,南宁 530001)
木薯FEC诱导及农杆菌介导转化的研究进展
程琴 金刚 李慧敏 彭欣怡 黎萍 王丽萍
(广西亚热带作物研究所,南宁 530001)
在木薯生物技术中,转基因植株的生产很普遍,它主要通过器官发生和体细胞胚胎发生途径,木薯遗传转化的关键技术是FEC的诱导和形成,农杆菌介导的FEC转化在转基因木薯领域被广泛应用。概述木薯再生途径中体胚和FEC制备、诱导及增值,并对农杆菌介导的转化及其在木薯中的应用等进行综述。
木薯 FEC 农杆菌 遗传转化
木薯在热带和亚热带的非洲和拉丁美洲是一种重要的经济作物,在亚热带地区作为生产淀粉和生物乙醇的原料[1]。它是营养体繁殖的作物,通过传统杂交培育新品种非常困难,一方面主要体现在遗传上高度杂合(heterozygositv)、基因冗余(genetic overloading)、有性子代严重分离等复杂的遗传背景;另一方面木薯存在开花数目少、花粉育性低、自交不亲和、坐果率低等问题[2],因此开展基因工程改良现有品种的品质和提高产量已成为当前木薯生物技术研究的重要方向。木薯离体植株再生系统的建立是实现遗传转化的首要条件,特别是针对非洲和南美洲的一些品种,目前主要通过以脆性胚性愈伤组织进行体细胞胚胎发生及子叶胚进行芽器官发生为植株主要再生途径[3-8]。与其他作物相比,木薯是报道较晚的可进行遗传转化的重要作物。经过多年发展,基于体细胞胚胎发生、胚状体子叶芽器官发生及脆性胚性愈伤循环体系的趋于成熟[1],为木薯遗传转化提供了必要的条件(图1)[9]。转基因植株的获得很普遍,常用且有成功先例的木薯基因转化方法主要是农杆菌介导法和基因枪法[10],成熟体细胞胚的绿色子叶和脆性胚性愈伤组织(FES)是农杆菌和基因枪转化的靶组织[11]。农杆菌介导的FEC转化在转基因木薯领域被广泛应用,包括把木薯作为主要经济作物的发展中国家,很多实验室都在使用这种技术[12]。本文主要综述木薯再生途径中FEC的诱导过程和各个阶段所需要的培养基,以及FEC形成后用农杆菌进行转化的相应方法。这在国内鲜有报道,本文是在前人的研究基础上,对木薯再生系统中FEC途径进行更详尽的概述,为后人研究转基因木薯提供捷径。
1 体胚和FEC的制备
FEC可以从热带木薯系列(TMS)60444叶外植体,茎或侧芽的分生组织里通过初级体细胞胚胎发生而形成[13]。以组培苗茎段侧芽或顶芽为外植体,在添加Picloram和2,4-D的体细胞胚胎发生诱导培养基上暗培养2周后,可诱导胚状体的形成[6],使用侧芽分生组织在CAM培养基上诱导是最好的,因为它产生胚胎簇,减少非胚性脆性愈伤组织的累积,(图2和表1)。初级胚在CIM培养基累积和纯化[14],连续继代培养在GD培养基[15]上的胚性愈伤能产生一种主要由细小的球形胚组成的结构,即所谓脆性胚性愈伤(FEC)。以GD培养基代替MS培养基可提高胚性愈伤的产量,获得纯的脆性愈伤,再进行悬浮培养,在SH培养基中进行迅速扩增[6]。生长素浓度中,2,4-D在6 mg/L及Picloram在12 mg/L为最佳使用浓度,并且Picloram的效果明显优于2,4-D[16]。
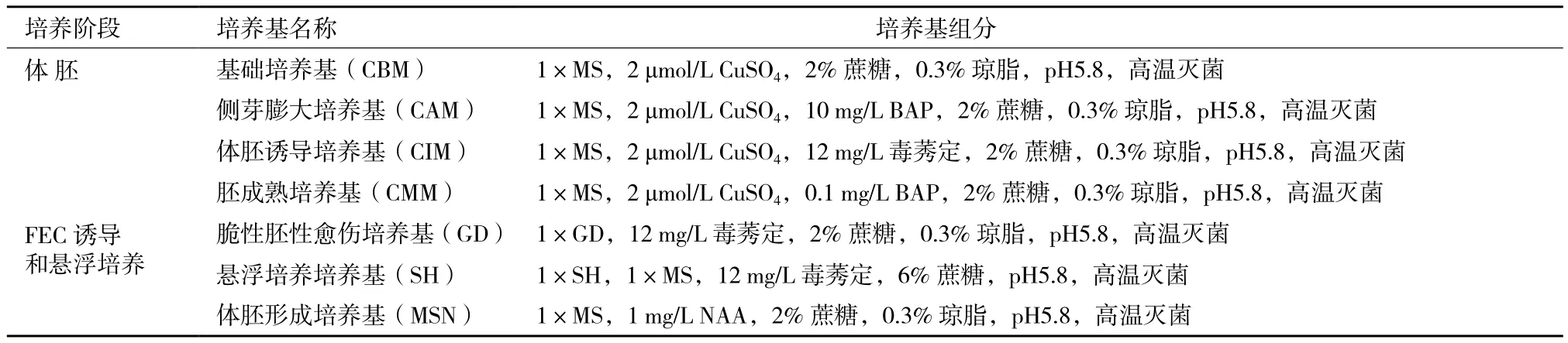
表1 木薯组织培养中常用的培养基[13]
2 FEC的诱导、增值及转化
在木薯胚胎发生基质中从未成熟幼叶和顶端或腋分生组织诱导初级体胚(图1),通过接种在相同介质中可循环诱导次级体胚发生,继续将次级胚接种在含有12 mg/L 毒莠定的GD培养基中可以产生FEC、次级胚和非胚性愈伤组织(图1),一般来说,FEC需要被选择,长期在GD固体培养基上作再次培养,为了快速增值,用含有10-12 mg/L毒莠定的
SH悬浮液建立胚胎发生。胚胎悬浮液在含有1 mg/L萘乙酸的MSN固体培养基上培养,体胚再次形成,然后发展成子叶胚,最后萌发成小苗[6,12,13]。因FEC和胚胎悬浮液易被农杆菌感染,也有利于基因枪法,外源基因的导入容易。木薯转化常用的是基因枪转化法和农杆菌介导转化法,到目前为止,农杆菌介导转化木薯已经被证实比基因枪介导转化更成功[17]。
3 农杆菌介导的转化
将农杆菌LBA4404(带有1305.1载体)放在YEBA+K50/R50/S100上28℃黑暗培养2 d;再放到YEB+K50/R50/S100上,以200 r/min 28℃黑暗震荡培养2 d;将FEC和含有载体的农杆菌24℃,16 h光照培养4 d,见图2。而在转化筛选标记选择方面,目前常用到的有卡那霉素、遗传霉素、巴龙霉素(nptII gene)、潮霉素(hpt gene)、草铵膦(bar gene)、甘露糖(磷酸甘露糖异构酶基因)等[18]。载体含有GUSPlus 报告基因,便于显示转化的成功率。首先FEC在液体培养基SH中培养,之后与农杆菌悬浮共培养,利用载体中的抗生素筛选非胚性愈伤(NEFC)[19,20],得到FEC需要较长的时间,一般需要在高含量生长素的培养基上培养6个月,而长时间暴露在这样的培养基上会导致体细胞无性系发生变异,从而导致木薯株型发生变异[18]。然而常规方法获得FEC再生率很低,促使我们修改接种程序并找到一种新方法:用农杆菌悬浮液直接侵染GD培养基上的FEC群簇,见图2。将FEC和农杆菌在培养基上共培养4 d,使用塑料网转移FEC与农杆菌的共培养物到新的培养基。这样减少对FEC的胁迫,控制营养、激素和抗生素平衡。为了使被转化的FEC成熟,共培养后逐渐增加抗生素浓度进行筛选,每个详细的步骤使这种技术在其他实验室的实现成为可能,包括把木薯作为主要经济作物的发展中国家[12]。
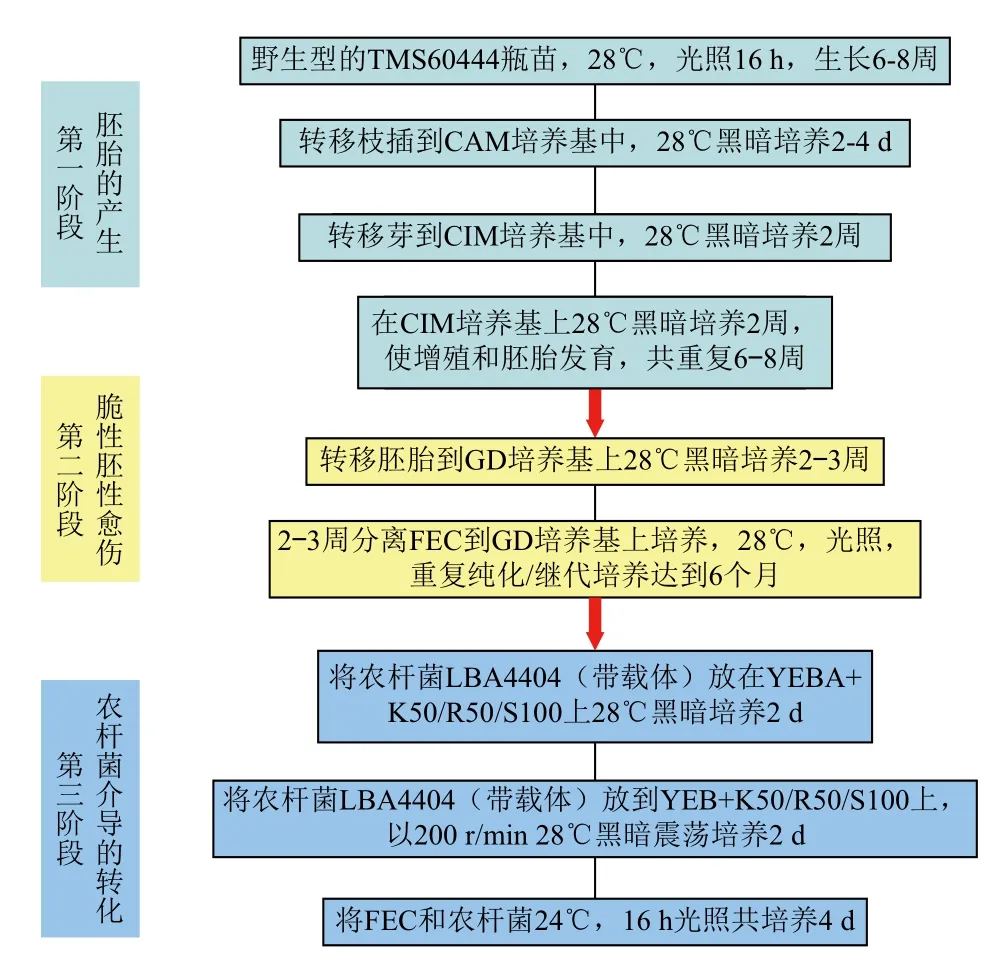
图2 FEC和体胚的形成及转化农杆菌[12]
4 农杆菌介导的遗传转化在木薯中的应用
与其他的转化方法比较,高效、重复性好、设备简单和稳定表达是根癌农杆菌介导的基因转化方法的突出优点,是目前应用最广泛的基因转化方法[10]。González等[21]用农杆菌菌株AB1成功转化西非品种TMS60444的FEC,两个株系对巴龙霉素抗性的转基因特性通过GUS分析和Southern分析。Zhang等[8]在正负选择因子存在下,用农杆菌LBA4404转化TMS60444的胚胎悬浮液,获得了12种正常转基因株系形态,5种是用甘露醇筛选的,另外7种具有潮霉素抗性,PCR和Southern分析证实转基因稳定整合到基因组上,RT-PCR和Northern分析证明转基因在再生植株中表达。Schreuder等[22]为木薯胚胎悬浮液和农杆菌侵染建立了一个高效、可再生的转化程序,在31株GUS活性株系中,14株显示100% GUS活性,剩下17株显示72% GUS活性。Southern分析显示这些植株的转基因特性。Zhang等[23]经过5年研究TMS60444FEC的转化后,农杆菌介导的FEC的转化成功运用在多个实验室,运用这套系统;Zhang和Beltran等通过木薯胚胎悬浮液,成功引进编码必需氨基酸的合成人工存储蛋白1(ASP1)基因,通过Western分析在转基因植株的叶和根中能检测到ASP1四聚物,随后,木薯转化得到了验证,如特定组织启动子[24,25],抵抗非洲木薯花叶病毒(ACMV)[26-29],增加蛋白质含量[30],改善木薯褐条病毒抗性[31]。从FEC的诱导到转基因植株再生的整个过程[12,13]已经被优化,农杆菌转化系统最突出优势是可以得到大量的转基因植物,因此,它在木薯基因工程中是最广泛使用的方法。
5 结语
木薯TMS60444最佳的转化程序[12]在ETH Zurich(瑞士苏黎世联邦理工学院)建立了一套高通量转化平台,并将这种技术传给非洲实验室[32,33]。为了适应和部署转基因木薯线路改进特征,基因依赖转化程序的发展已经被木薯研究社群认为是一个重要步骤[1,32,34],因为它的健壮性和高效性,改进的转化方案能满足木薯在其他农民首选品种和地方品种的转基因改良,能维持农杆菌-FEC介导转化的每个关键步骤的高效性。此方案不仅适用于木薯60444,也能用于农民首选地方品种的转基因,这对以木薯作为粮食和能源作物的地区非常有利。
总之,经过15年的努力,从1996年第一个转基因木薯被报道以来,木薯遗传转化已取得显著进展。这项技术不仅在几个先进的实验室进一步发展,在发展中国家的实验室也运用起来,包括中国和非洲[32]。除了木薯模式品种用于转基因的改良,农民首选品种和地方品种也尝试用于转基因改良,最近在南非和肯尼亚的实践已经证明,此方法适合当地工业首选木薯的转基因改良[33]。基因改良已增加木薯对病毒和非生物胁迫的抗性,减少氰化物毒性,提高了营养价值,以及改善淀粉产量和质量。因此,木薯转基因技术在是木薯产业化和食品安全从发展到实际应用的过渡。相信在不久的将来,随着木薯转基因技术的成熟,其产业化生产也将呈现一个崭新的舞台。
[1] Liu J, Zheng QJ, Ma QX, et al. Cassava Genetic transformation and its application in breeding[J]. Journal of Integrative Plant Biology, 2011, 53(7):552-569.
[2] Ceballos H, Okogbenin E, Pbrez JC, et a1. Cassava in root and tuber crops, handbook of plant breeding[C]. Springer New York, 2010.
[3] Li HQ, Sautter C, Potrykus I, et al. Genic transformation of cassava(Crantz)[J]. Ture Biotechnology, 1996, 14:736-740.
[4] Li HQ, Huang YW, Liang CY, et al. Regeneration of cassava plavia shoot organogenesis[J]. Plant Cell Report, 1998, 17:410-414.
[5] Schpke C, Taylor N, Carcamo R, et al. Regeneration of transgenic cassava plants(Crantz)from microbombarded embryogenic suspension cultures[J]. Nature Biotechnology, 1996, 14:731-735.
[6] Taylor N, Edwards M, Kiernan RJ, et al. Development of friable embryogenic callus and embryogenic suspension culture systems in cassava(Crantz)[J]. Nature Biotechnology, 1996, 14:726-730.
[7] Taylor N, Chavarriaga P, Raemakers K, et al. Development and application of transgenic technologies in cassava[J]. Plant Molecular Biology, 2004, 56:671-688.
[8] Zhang P, Legris G, Coulin P, et al. Production of stably transformed cassava plants via particle bombardment[J]. Plant Cell Reports, 2000, 19:939-945.
[9] Zhang P . Studies on cassava(Manihot esculenta Crantz)transformation:Towards genetic improvement[D]. Switzerland:2000 .
[10] 康冬鸽, 李瑞梅, 胡新文, 等. 木薯的再生体系和基因转化方法[J]. 基因组学与应用生物学, 2009, 28(3):619-624.
[11] Zhang P, Puonti-Kaerlas J. Regeneration of transgenic cassava from transformed embryogenic tissues[J]. Methods Molecular Biology, 2005, 286:165-176.
[12] Bull SE, Owiti JA, Niklaus M, et al. Agrobacterium-mediated transformation of friable embryogenic calli and regeneration of transgenic cassava[J]. Nature Protocols, 2009, 4:1845-1854.
[13] Zhang P, Gruissem W. Production of transgenic cassava(Manihot esculenta Crantz)in transgenic crops of the world—Essential Protocols[C]. the Netherlands:Kluwer Academic Publishers, 2004:301-319.
[14] Murashige T, Skoog F. A revised medium for rapid growth and bio assays with tobacco tissue cultures[J]. Physiology Plant, 1962, 15:473.
[15] Gresshof PM, Doy CH. Derivation of a haploid cell line from Vitis vinifera and the importance of the stage of meiotic development of anthers for haploid culture of this and other genera[J]. Z Pflanzenphysio, 1974, 73:132-141.
[16] 赵姗姗, 李海霞, 刘佳, 等. 我国主要栽培木薯品种体细胞胚胎发生与芽器官发生的研究[J]. 农业生物技术学报, 2010, 18(1):37-44.
[17] Siritunga D, Sayre R. Generation of cyanogen-free transgenic cassava[J]. Planta, 2003, 217:367-373.
[18] 尹彩霞, 乔爱民, 张鹏, 等. 木薯组织培养和转基因育种研究进展[J] , 仲恺农业工程学院学报, 2009, 22(2):65-71 .
[19] Raemakers K, Schreuder M, Pereira I, et al. Progress made in FEC transformation of cassava[J]. Euphytica, 2001, 120:15-24.
[20] Zhang P, Potrykus I, Puonti-Kaerlas J. Efficient production of transgenic cassava using negative and positive selection[J]. Transgenic Research, 2000, 9:405-415.
[21] González AE, Schopke C, Taylor NJ, et al. Regeneration of transgenic cassava plants(Manihot esculenta Crantz)through Agrobacterium-mediated transformation of embryogenic suspension cultures[J]. Plant Cell Reports, 1998, 17:827-831.
[22] Schreuder MM, Raemakers C, Jacobsen E, et al. Efficient production of transgenic plants by Agrobacterium-mediated transformation of cassava(Manihot esculenta Crantz)[J]. Euphytica, 2001, 120:35-42.
[23] Zhang P, Jaynes J, Potrykus I, et al. Transfer and expression of an artificial storage protein(ASP1)gene in cassava(Manihot esculenta Crantz)[J]. Transgenic Research, 2003, 12:243-250.
[24] Zhang P, Bohl-Zenger S, Pounti-Kaerlas J, et al. Two cassava promoters related to vascular expression and storage root formation[J]. Planta, 2003, 218:192-203.
[25] Beltran J, Prıas M, Al-Babili S, et al. Expression pattern conferred by a glutamic acid-rich protein gene promoter in field-grown transgenic cassava(Manihot esculenta Crantz)[J]. Planta, 2010, 231:1413-1424.
[26] Chellappan P, Masona MV, Vanitharani R, et al. Broad spectrum resistance to ssDNA viruses associated with transgene-induced gene silencing in cassava[J]. Plant Molecular Biology, 2004, 56:601-611.
[27] Zhang P, Vanderschuren H, Futterer J, et al. Resistance to cassava mosaic disease in transgenic cassava expressing antisense RNAs targeting virus replication genes[J]. Plant Biotechnology, 2005, 3: 385-397.
[28] Vanderschuren H, Akbergenov R, Pooggin MM, et al. Transgenic cassava resistance to African cassava mosaic virus is enhanced by viral DNA-A bidirectional promoter-derived siRNAs[J]. Plant Molecular Biology, 2007, 64:549-557.
[29] Vanderschuren H, Alder A, Zhang P, et al. Dosedependent RNAi-mediated geminivirus resistance in the tropical root crop cassava[J]. Plant Molecular Biology, 2009, 70:265-272.
[30] Abhary M, Siritunga D, Stevens G, et al. Transgenic biofortification of the starchy staple cassava(Manihot esculenta)generates a novel sink for protein[J]. PLoS ONE, 2011, 6(1):e16256.
[31] Yadav JS, Ogwok E, Wagaba H, et al. RNAi-mediated resistance to cassava brown streak Uganda virus in transgenic cassava[J]. Plant Pathology, 2011, (10):1364-3703.
[32] Bull SE, Ndunguru J, Gruissem W, et al. Cassava:constraints to production and the transfer of biotechnology to African laboratories[J]. Plant Cell Reports, 2011, 30:779-787.
[33] Chetty CC, Rossin CB, Gruissem W, et al. Empowering biotechnology in southern Africa:Establishment of a robust transformation platform for the production of transgenic industrypreferred cassava[J]. New Biotechnology, 2012(10):1016.
[34] Sayre R, Beeching JR, Cahoon EB, et al. The BioCassava plus program:biofortification of cassava for Sub-Saharan Africa[J]. Annual Review of Plant Biology, 2011, 62:251-272.
(责任编辑 狄艳红)
Advances in Induction of Cassava FEC and Agrobacterium-mediated Transformation
Cheng Qin Jin Gang Li Huimin Peng Xinyi Li Ping Wang Liping
(Guangxi Subtropical Crops Research Institute,Nanning 530001)
Production of transgenic plants is gradually becoming routine in cassava biotechnology. It is primarily through organogenesis and somatic embryogenesis, the key technology of cassava genetic transformation is friable embryogenic calli(FEC)induction and formation, Agrobacterium-mediated transformation of FEC is the most widely used method to generate transgenic cassava plants.This article provides an overview of cassava regeneration way including embryo and FEC preparation, induction and appreciation, the Agrobacterium-mediated transformation and its application in cassava were summarized.
Cassava FEC Agrobacterium Transformation
2013-10-09
程琴,女,硕士,研究实习员,研究方向:植物组培及转基因分子育种;E-mail:chengqin413@163.com
