直接竞争ELISA法快速测定水产品中6种氟喹诺酮类药物
2014-03-17王旭峰杨金兰陈培基杨宏亮黎智广李刘冬
王 强,王旭峰,杨金兰,陈培基,杨宏亮,黎智广,李刘冬
(中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,农业部水产品贮藏保鲜质量安全风险评估实验室(广州),广东广州510300)
直接竞争ELISA法快速测定水产品中6种氟喹诺酮类药物
王 强,王旭峰,杨金兰,陈培基,杨宏亮,黎智广,李刘冬*
(中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,农业部水产品贮藏保鲜质量安全风险评估实验室(广州),广东广州510300)
采用过碘酸钠法将抗环丙沙星单克隆抗体(MAb-CIP)与辣根过氧化物酶(HRP)偶联制备酶标抗体MAb-CIP-HRP,建立了检测水产品中6种氟喹诺酮类药物残留的直接竞争酶联免疫吸附分析方法(dcELISA),考察了包被原浓度、竞争反应时间和有机溶剂等因素对方法灵敏度的影响。结果表明:在优化的反应条件下,所建立的dcELISA针对环丙沙星、恩诺沙星、诺氟沙星、培氟沙星、沙拉沙星和双氟沙星6种氟喹诺酮类药物的检测限(LOD)均不超过0.5ng/mL,线性范围(IC20~IC80)在1.0~12.1ng/mL之间;对虾、鳗鲡和鲫鱼三种水产样品中添加5.0、10.0和20μg/kg时,加标回收率为70.4%~104.1%,相对标准偏差为5.0%~14.7%;本方法可用于水产品中氟喹诺酮类(FQs)药物多残留的快速测定。
氟喹诺酮,抗体,直接竞争ELISA,水产品
氟喹诺酮类抗生素(Fluoroquinolones,FQs)是在萘啶酸结构上7位引入哌嗪环,6位引入氟原子后得到的衍生物,属于第三代喹诺酮类抗菌药物[1]。该类药物可治疗和预防细菌感染,具有高效、低毒、组织穿透力强、抗菌谱广和价格低廉等优点[2-3]。近年来,FQs类药物被广泛应用于畜牧和水产养殖行业,由此造成的药物残留问题日益突出。研究表明,动物性食品中残留低浓度的FQs类药物容易诱导致病菌对其耐药性增强,并具有潜在致畸、致癌、致突变作用[4]。为了加强对FQs类药物残留的监控管理,我国及其他多个国家地区和组织对其最高残留限量进行了限定[1,5]。
目前检测动物源性食品中FQs类药物的残留方法主要有高效液相色谱—荧光检测法(HPLC-FLD)[6],液质联用法(LC-MS/MS)[7],高效毛细管电泳法(HPCE)[8]等以色谱分离为基础的仪器方法,其分析结果准确可靠,适用于药残检测结果的定量分析,但存在操作复杂、前处理繁琐和设备昂贵等问题,限制了其广泛应用于大批量样本的快速分析。近年来,基于抗原抗体反应的多残留酶免疫吸附分析方法(ELISA)以其广谱特异性、快速、灵敏等优点,成为兽药抗生素残留快速筛查的研究热点[9-10]。Wang等[1]建立了间接竞争ELISA检测动物源性食品中6种FQs类药物残留,平均回收率为60.0%~93.0%。Emmanuella Uwamahoro[11]和杨正涛等[12]分别建立了检测11种和4种FQs类药物的多残留间接竞争ELISA,但其仅用于标准品的测试,均未应用于实际样品检测。目前关于FQs类药物多残留直接竞争ELISA的研究甚少,因此本研究旨在通过制备酶标抗体,优化反应条件,建立了检测水产品中6种FQs类药物多残留的直接竞争ELISA,进一步丰富多残留免疫分析法的实际应用,为保障我国水产品质量安全提供一种有效的技术手段。
1 材料与方法
1.1 材料与仪器
环丙沙星、恩诺沙星、诺氟沙星、双氟沙星、氧氟沙星、孔雀石绿标准品(纯度≥98.0%)和辣根过氧化物酶(HRP) 美国Sigma公司;培氟沙星、沙拉沙星、氟甲喹、氯霉素标准品(纯度≥95.5%) 德国Dr. Ehrenstorfer公司;抗环丙沙星单克隆抗体MAb-CIP、包被原CIP-OVA 本实验室制备;包被液、PBS缓冲液、封闭液、TMB底物液、底物缓冲液等ELISA所需试剂 均按文献[13]方法配制;辛酸、硫酸铵、过碘酸钠(分析纯) 广州化学试剂厂;鱼虾类样品 购于广州市内农贸市场;实验用水 18.2mΩ·cm超纯水;其他试剂 均为分析纯。
VersaMax酶标仪、MultiWashⅢ洗板机 美国Molecular Devices公司;API3000三重四级杆液质联用仪 美国应用生物系统公司;R210型旋转蒸发仪 瑞士BUCHI公司;Biofuge Stratos台式高速冷冻离心机 美国Thermo公司。
1.2 实验方法
1.2.1 酶标抗体的制备 采用过碘酸钠法[14],将辣根过氧化物酶(HRP)与经过辛酸—硫酸铵法纯化的抗环丙沙星单克隆抗体(MAb-CIP)偶联,制备酶标抗体MAb-CIP-HRP。
1.2.2 dcELISA检测步骤
1.2.2.1 包被 用包被液将包被原CIP-OVA,稀释至合适浓度,每孔100μL添加到酶标板孔中,4℃放置过夜。
1.2.2.2 封闭 用洗涤液洗涤2次,甩干后每孔加入封闭液120μL,37℃温箱中封闭3h,甩干孔中液体后置于37℃烘箱中烘干备用。
1.2.2.3 加样 用PBS缓冲液将药物标准品稀释成系列浓度,将酶标抗体MAb-CIP-HRP稀释3000倍,每孔加入药物标准液(或待测样品)和酶标抗体各50μL,轻摇混合,37℃温箱中孵育反应40min后洗涤液洗涤5次,甩干。
1.2.2.4 显色与测定 将TMB底物液与底物缓冲液体积比1∶1混合后,每孔100μL添加到板孔中,37℃温箱中显色10min后每孔加入50μL终止液终止显色反应,酶标仪测定其在450nm处的吸光度(A450nm)。
1.2.2.5 数据分析 以药物标准液浓度的对数值为横坐标,以B/B0(B为添加药物时的吸光值,B0为不添加药物时的吸光值)为纵坐标,使用Origin Pro 7.5软件四参数对数函数进行曲线拟合,绘制对应的竞争标准曲线,计算获得dcELISA的最低检测限(LOD,IC10),半抑制浓度(IC50)、线性检测范围(IC20~IC80)等参数[13]。
1.2.3 方法特异性的评价 在最优的反应条件下,绘制不同药物的竞争标准曲线,以交叉反应率(CR)评价方法的特异性,结果按式(1)计算:

1.2.4 样品提取与净化 鱼类样品去鳞、去皮,沿背脊取肌肉;虾去头、去壳,取肌肉部分。样品均质处理成肉糜状的待测试样。准确称取试样5.0g,置于50mL聚苯乙烯离心管中,加入20mL酸化乙腈(含1%的乙酸),均质处理1min,漩涡混合2min,超声波提取5min,以4000r/min离心5min,上清液转移至蒸发瓶中。残渣中加入15mL酸化乙腈,重复提取一次后合并两次提取液,于45℃下减压蒸干溶剂。用2mL PBS缓冲液和5mL正己烷充分复溶,漩涡混合2min后,弃去上层正己烷,用5mL正己烷重复上述操作一次。移取下层液体并用PBS缓冲液定容至10mL比色管中,取50μL直接用于dcELISA检测。
2 结果与分析
2.1 酶标抗体工作浓度的选择
本研究采用过碘酸钠法将HRP表面的糖基氧化成醛基后与单抗MAb-CIP上的氨基进行偶联,制备酶标抗体Mab-CIP-HRP。采用直接ELISA法来确定Mab-CIP-HRP的工作浓度,将包被原CIP-OVA包被到酶标板上,加入酶标抗体孵育反应,洗涤后加入显色液,酶催化的显色液吸光度值与酶标抗体含量呈正比[14]。结果显示,在包被浓度为0.2μg/mL,Mab-CIP-HRP稀释度在1/3000时,A450nm在1.4左右,可以满足免疫分析法的检测要求。因此,本研究选择酶标抗体工作浓度为1/3000。
2.2 包被原浓度和竞争反应时间的确定
包被原浓度和竞争反应时间对ELISA的灵敏度有显著影响,本研究通过单因素实验对其进行优化,绘制不同反应条件下环丙沙星的竞争标准曲线,以Amax/IC50为参考标准评价曲线性能,其中Amax为对应曲线的最大吸光值,比值越大则代表灵敏度越高,重复性越好[15]。由图1(a)所示,随着包被原浓度的增加Amax逐渐增加,在最大包被浓度时IC50显著升高,说明包被浓度过高时与酶标抗体亲和力强,不利于游离的小分子药物竞争反应,降低检测灵敏度。在包被原浓度为0.2μg/mL时曲线的Amax/IC50最大,因此选择包被原浓度为0.2μg/mL。同理,由图1(b)所示,随着反应时间的增加,Amax趋于平衡,IC50变化不大,反应时间为40min时曲线的Amax/IC50最大,因此选择40min为dcELISA竞争反应时间。

图1 包被原浓度和竞争反应时间对dcELISA的影响Fig.1 Influence of coating concentration and competitive time on dcELISA
2.3 有机溶剂甲醇和乙腈对反应的影响
有机溶剂会干扰免疫分析中抗原抗体的结合[16],因此本研究选用两种实验中常用的水溶性有机溶剂甲醇和乙腈,考察其在缓冲体系中的含量对所建立的dcELISA灵敏度的影响。结果如图2所示,当缓冲液中甲醇含量低于5%时,对dcELISA的灵敏度没有显著的影响,进一步甲醇含量增加至10%时,曲线Amax和IC50均有小幅度的升高。而随着缓冲液乙腈含量的增加,曲线Amax不断下降,IC50不断升高,灵敏度显著降低。因此,所建立的dcELISA的缓冲体系中可以耐受5%的甲醇含量,但乙腈含量则需严格控制。
2.4 方法特异性分析
基于前述最优的实验条件参数,进行标准曲线的绘制。图3是经Origin Pro 7.5软件四参数对数函数拟合后环丙沙星的dcELISA标准曲线,拟合度良好并呈典型的S型曲线,IC50为2.1ng/mL。同时,为考察dcELISA的方法特异性,交叉反应研究使用了8种结构相似的FQs类药物和2种水产品养殖过程中常见的抗菌类药物(氯霉素和孔雀石绿)。结果如表1所示,dcELISA针对环丙沙星、恩诺沙星、诺氟沙星、培氟沙星、沙拉沙星和双氟沙星的交叉反应率均超过了65%,表明本方法具有宽谱特异性。结果同时显示dcELISA针对上述6种高交叉反应的FQs类药物的LOD均不超过0.5ng/mL,线性范围(IC20~IC80)在1.0~ 12.1ng/mL之间,满足国标GB/T 20366-2006和农业部235号公告《动物性食品中兽药最高残留限量》的相关检测要求,可用于这6种FQs类药物残留检测。

图2 甲醇和乙腈含量对dcELISA的影响Fig.2 Influence of concentration of methanol and acetonitrile on dcELISA
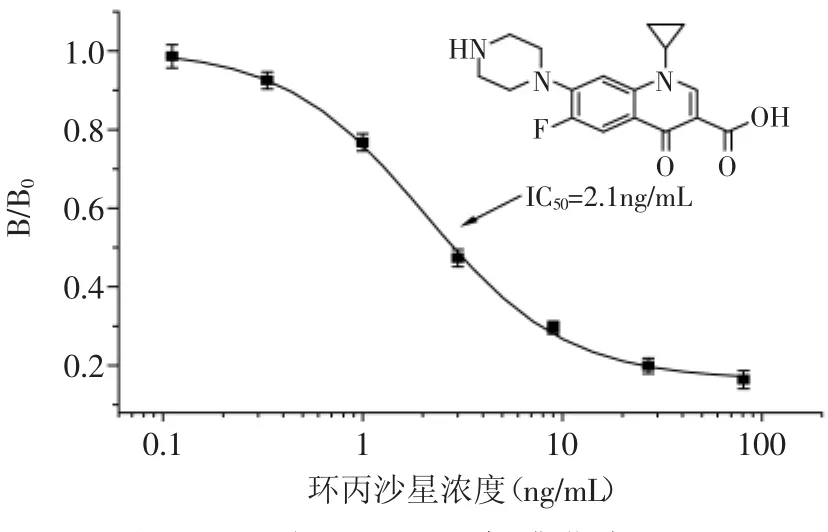
图3 环丙沙星dcELISA标准曲线(n=3)Fig.3 Standard curve of dcELISA for ciprofloxacin(n=3)
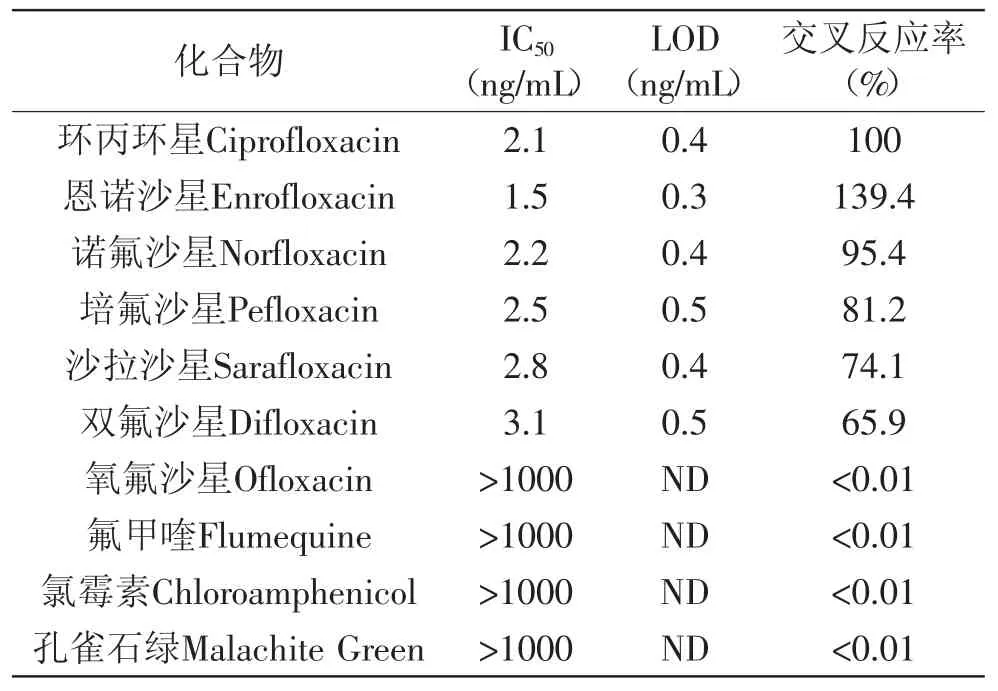
表1 dcELISA的灵敏度和交叉反应率Table 1 Sensitivity and cross-reactivity for dcELISA
2.5 样品添加回收测定
选择对虾、鳗鲡和鲫鱼三种水产品进行样品添加回收实验。向样品中分别添加5.0、10.0和20μg/kg三个水平的FQs类药物标准液,室温下放置过夜后用1.2.4方法处理,计算各水平的回收率和相对标准偏差(RSD)。结果如表2所示,dcELISA检测6种FQs类药物在三种水产样品的加标回收率为70.4%~104.1%,RSD为5.0%~14.7%,表明本方法准确度和灵敏度良好,满足水产样品中6种FQs类药物残留痕量检测的要求。
2.6HPLC-MS/MS比对检测
随机从农贸市场抽取鱼虾类水产样品,将样品平均分成两组,一组按照1.2.3方法处理后用于dcELISA检测(结果以环丙沙星含量来表示),另一组用HPLCMS/MS进行检测,样品处理方法和仪器参数设置参照GB/T 20366-2006,其中HPLC-MS/MS采用多反应监测(MRM)模式。图4是6种FQs类药物混合标准溶液的MRM离子流色谱图(10ng/mL)。比对检测结果显示,随机抽取了15份水产样品,其中dcELISA和HPLC-MS/MS针对一份鲫鱼样品检测出环丙沙星含量分别为8.3μg/kg和7.6μg/kg,其余14份样品检测结果均为阴性,表明两种方法结果相关度高,结果准确可靠。
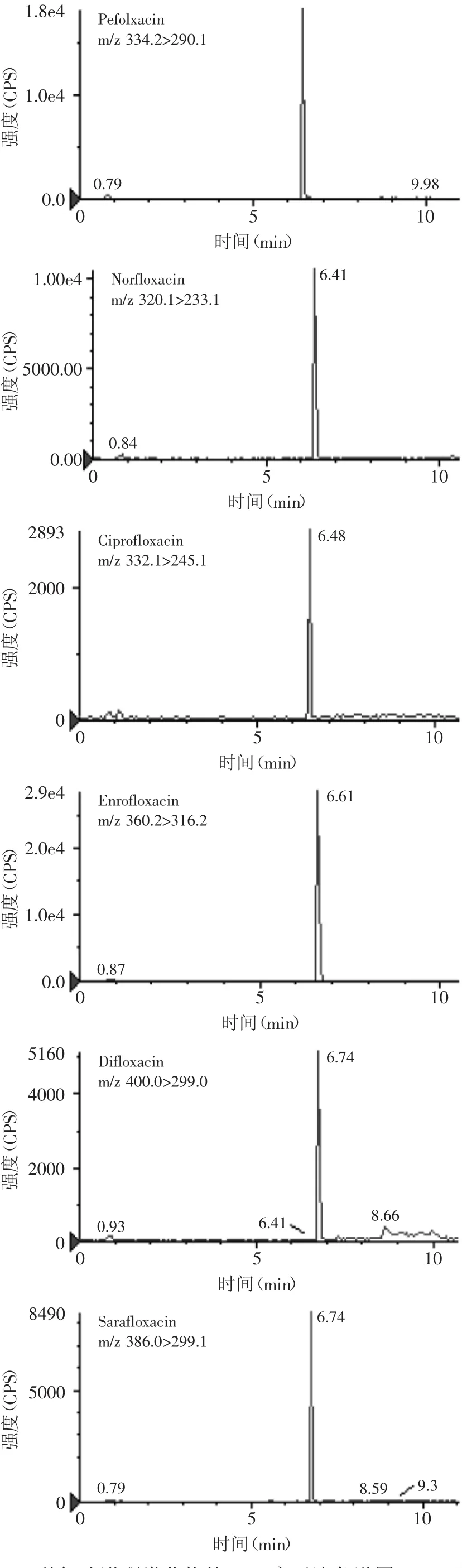
图4 6种氟喹诺酮类药物的MRM离子流色谱图(10ng/mL)Fig.4 Multiple reaction monitoring chromatogram of six fluoroquinolones(10ng/mL)
3 结论
针对具有广谱性抗菌作用氟喹诺酮类药物的残留监测,快速准确的多残留免疫分析法是一种有效的筛选手段。通过免疫分析法对样品进行初步筛查,进一步通过色谱仪器分析法对阳性样品含量进行确证分析,有效提高了检测工作的效率和准确度,近年来已逐步成为农兽药残留检测的主要研究方向。本研究建立了检测水产品中6种FQs类药物残留的dcELISA方法,方法灵敏度高,满足相关限量标准的检测要求,在三种水产品中的加标回收率为70.4%~104.1%,相对标准偏差为5.0%~14.7%,与HPLC-MS/ MS具有良好的相关性,结果准确可靠,可用于水产品中氟喹诺酮类药物多残留的快速测定。
[1]Wang Z,Zhu Y,Ding S,et al.Development of a monoclonal antibody-based broad-specificity ELISA for fluoroquinolone antibiotics in foods and molecular modeling studies of crossreactive compounds[J].Anal Chem,2007,79(12):4471-4483.
[2]Moema D,Nindi M M,Dube S.Development of a dispersive liquid-liquid microextraction method for the determination of fluoroquinolones in chicken liver by high performance liquid chromatography[J].Anal Chim Acta,2012,730:80-86.
[3]王战辉,沈建忠,张素霞.喹诺酮类药物抗体制备研究进展及策略分析[J].中国农业科学,2008,41(10):3311-3317.
[4]Lee S,Kim B,Kim J.Development of isotope dilution-liquid chromatography tandem mass spectrometry for the accurate determination of fluoroquinolones in animal meat products:optimization of chromatographic separation for eliminating matrix effects on isotope ratio measurements[J].J Chromatogr A,2013,1277:35-41.
[5]Leivo J,Chappuis C,Lamminmaki U,et al.Engineering of a broad-specificity antibody:detection of eight fluoroquinolone antibiotics simultaneously[J].Anal Biochem,2011,409(1):14-21.
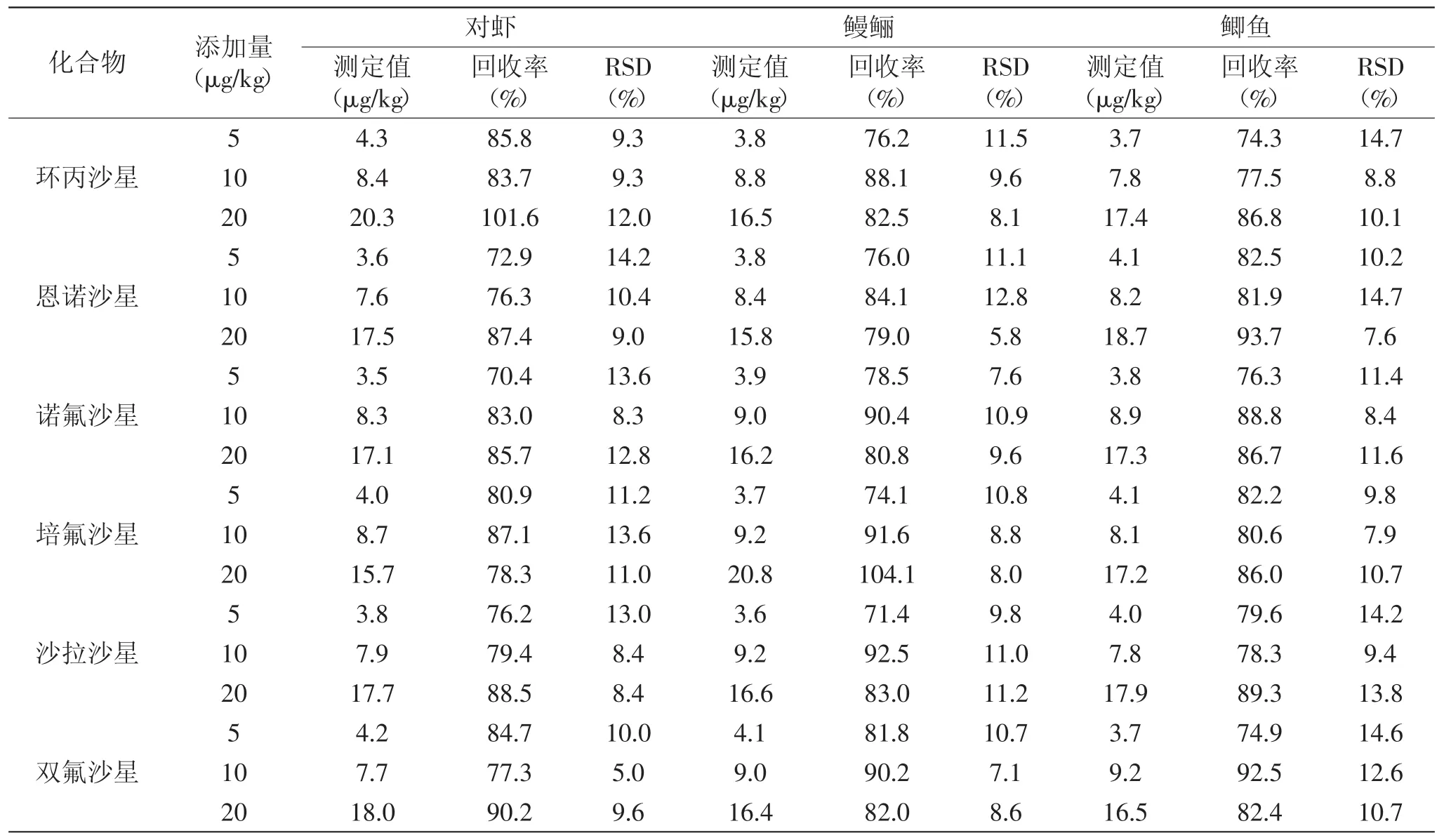
表2 水产品中6种氟喹诺酮类药物的添加回收率(n=3)Table 2 Recovery of six fluoroquinolones from spiked aquatic product(n=3)
[6]Herrera-Herrera A V,Hernandez-Borges J,Rodriguez-Delgado M A.Fluoroquinolone antibiotic determination in bovine,ovine and caprine milk using solid-phase extraction and high-performance liquid chromatography-fluorescence detection with ionic liquids as mobile phase additives[J].J Chromatogr A,2009,1216(43):7281-7287.
[7]Kantiani L,Farre M,Barcelo D.Rapid residue analysis of fluoroquinolones in raw bovine milk by online solid phase extraction followed by liquid chromatography coupled to tandem mass spectrometry[J].J Chromatogr A,2011,1218(50):9019-9027.
[8]Hernandez M,Aguilar C,Borrull F,et al.Determination of ciprofloxacin,enrofloxacin and flumequine in pig plasma samples by capillary isotachophoresis-capillary zone electrophoresis[J].J Chromatogr B Analyt Technol Biomed Life Sci,2002,772(1):163-172.
[9]Li J,Liu J,Zhang H C,et al.Broad specificity indirect competitive immunoassay for determination of nitrofurans in animal feeds[J].Anal Chim Acta,2010,678(1):1-6.
[10]Shen Y D,Deng X F,Xu Z L,et al.Simultaneous determination of malachite green,brilliant green and crystal violet in grass carp tissues by a broad-specificity indirect competitive enzyme-linked immunosorbent assay[J].Anal Chim Acta,2011,707(1-2):148-154.
[11]Emmanuella Uwamahoro,吕书为,唐秋实,等.基于洛美沙星免疫原的喹诺酮药物广谱特异性抗体制备的研究[J].食品工业科技,2012,33(20):156-159.
[12]杨正涛,张乃生,魏东.氟喹诺酮类药物多组份残留的酶免疫分析法[J].中国兽医学报,2008,28(9):1057-1060.
[13]Lei H T,Shen Y D,Song L J,et al.Hapten synthesis and antibody production forthe developmentofa melamine immunoassay[J].Anal Chim Acta,2010,665(1):84-90.
[14]Xu Z L,Deng H,Deng X,et al.Monitoring of organophosphorus pesticides in vegetables using monoclonal antibody-based direct competitive ELISA followed by HPLC-MS/MS[J].Food Chemistry,2012,131(4):1569-1576.
[15]杨星星,刘细霞,王弘,等.细交链孢菌酮酸酶联免疫吸附分析方法研究[J].分析化学,2012,40(9):1347-1352.
[16]Esteve-Turrillas F A,Abad-Fuentes A,Mercader J V. Determination of fenhexamid residues in grape must,kiwifruit,and strawberry samples by enzyme-linked immunosorbent assay [J].Food Chemistry,2011,124(4):1727-1733.
Rapid determination of six fluoroquinolones in aquatic product by direct competitive enzyme-linked immunosorbent assay
WANG Qiang,WANG Xu-feng,YANG Jin-lan,CHEN Pei-ji,YANG Hong-liang,LI Zhi-guang,LI Liu-dong*
(South China Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences;Key Laboratory of Aquatic Product Processing,Minisitry of Agriculture;Laboratory of Quality and Safety Risky Assessment for Aquatic Product on Storage and Preservation(Guangzhou),Ministry of Agriculture,Guangzhou 510300,China)
In this study,a direct competitive enzyme-linked immunosorbent assay(dcELISA)was developed for rapid determination six fluoroquinolones in aquatic product.Horseradish peroxidase-labelled ciprofloxacin monoclonal antibody(MAb-CIP-HRP)was synthesized by NaIO4method.The effect of coating antigen concentration,competitive reaction time and organic solvents on the sensitivity of dcELISA were investigated. Under the optimized assay conditions,the dcELISA showed the limit of detection below 0.5ng/mL for ciprofloxacin,enrofloxacin,norfloxacin,pefloxacin,sarafloxacin and difloxacin,and the linear range(IC20~IC80)of 1.0 to 12.1ng/mL. Recoveries from spiked shrimp,eel and crucian at levels of 5.0,10 and 20μg/kg were in the range of 70.4%~104.1%,with relative standard deviation ranging from 5.0%to 14.7%.Results indicated that the established dcELISA was suitable for multi-analytes rapid determination of fluoroquinolones residues in aquatic product.
fluoroquinolone;antibody;direct competitive ELISA;aquatic product
TS207.3
A
1002-0306(2014)06-0061-05
10.13386/j.issn1002-0306.2014.08.004
2013-08-19 *通讯联系人
王强(1988-),男,研究实习员,研究方向:渔业环境及水产品质量与安全。
中央级公益性科研院所基本科研业务费专项资金(2013TS08);农业部农产品贮藏保鲜质量安全风险评估实验室(广州)暨广东省食品质量安全重点实验室开放课题基金(KLFQS201202)。
