黄酒及其酸败组分的高效毛细管电泳检测方法的研究
2014-03-17陈乃东罗志强李望远
陈乃东,胡 平,罗志强,马 莉,李望远
(1.皖西学院生物与制药工程学院,安徽六安237012;2.皖西中药与天然药物工程技术研究中心,安徽六安237012;3.植物细胞工程安徽省工程技术研究中心,安徽六安237012)
黄酒及其酸败组分的高效毛细管电泳检测方法的研究
陈乃东1,2,3,胡 平1,罗志强1,马 莉1,李望远1
(1.皖西学院生物与制药工程学院,安徽六安237012;2.皖西中药与天然药物工程技术研究中心,安徽六安237012;3.植物细胞工程安徽省工程技术研究中心,安徽六安237012)
黄酒生产与陈化过程中发生酸败变质,是黄酒业面临的头等难题。本文中以黄酒原酒为对象,从检测波长、缓冲液组成、分离电压等方面对高效毛细管区带电泳法检测黄酒组分的条件进行研究。结果表明,选择检测波长215nm、0.075nmol/L的pH=10.0的磷酸氢二钠-四硼酸钠缓冲液、分离电压8kV检测,可以得到理想的黄酒原酒、黄酒料酒与酸败黄酒原酒的高效毛细管区带电泳图谱。通过对比分析,确定导致酸败的可能组分峰位于保留时间27.0~31.0min区段。研究结果为黄酒酸败组分的检出、质量标准构建及黄酒生产过程中的质量控制奠定基础,具有一定的应用价值。
黄酒,高效毛细管电泳,酸败
黄酒因酒精含量较低,在生产、陈化和储运过程中易感染细菌而导致变酸甚至发臭,这种现象称为酸败,俗称“起醭”。酸败是我国黄酒业面临的头等难题[1-2]。轻度酸败既降低原料出酒率,又损害了黄酒应有的风味,直接影响了黄酒的品质。重度酸败时黄酒因变质而无法饮用,造成了大量的人力、物力损失,还会引发因清理困难而导致的环境污染[3-4]。酸败现象已成为困扰黄酒生产企业、使黄酒生产成本居高不下的主要技术难题之一[5]。运用现代分析技术,建立黄酒酸败组分检测方法进而构建酸败预警机制对降低黄酒酸败的发生具有重要意义。
在黄酒生产中,多以味道是否变酸、发臭、目测是否“起醭”等感官手段判断黄酒是否发生酸败,这种全靠经验的做法一旦发现已是深度酸败。李勇波[1]、冯德明等[2]运用高效液相色谱法对黄酒的酸败组分进行了探讨,本实验室[6]在前期实验也对酸败黄酒原酒的酸败组分HPLC法检测条件进行了研究,由于发生酸败的黄酒pH较低(本实验使用的酸败黄酒原酒的pH=1~2),在色谱柱使用允许的pH范围内,酸性较强的酸败组分多以离子状态存在,很难建立有效的酸败组分检出HPLC分析方法。
高效毛细管电泳技术以毛细管柱为分离通道,以高压直流电源为驱动力对物质分子等进行高效分离和检测[7-8],由于其进样量少,分析速度快、效率高和样品消耗少等优点,已广泛应用于食品、药品等的成分分析、质量标准的制定及质量控制[9-12],在缓冲液为碱性条件下,黄酒的组分尤其是酸败组分均以离子状态存在,在高压电场驱动下,在毛细管柱中按荷质比不同实现分离。然而高效毛细管电泳用于黄酒酸败组分研究尚未见报道。本文以黄酒原酒为研究对象,构建黄酒组分的HPCE检测方法。在此基础上,对酸败的黄酒原酒进行对比分析,确定导致黄酒酸败的可能组分,为进一步探讨酸败的基源、建立预防黄酒酸败的质量控制方法、对黄酒酿造的各个环节中建立酸败预警系统及黄酒生产工艺改进提供参考依据。
1 材料与方法
1.1 材料与仪器
硼酸 上海实意化学试剂有限公司;磷酸二氢钠 南京化学四试剂一厂;四硼酸钠 新科电化剂厂;氢氧化钠 陇西化工股份有限公司,均为国产分析纯;黄酒原酒、酸败黄酒原酒、黄酒料酒 由黄酒原酒加入适当的调味品并稀释而成的直接投入市场销售的料酒,2012年4月26日从安徽禾裕黄酒集团有限公司生产车间随机抽取,每种样品抽取10个,采回后于4℃冰箱保存、备用。
TU1901紫外-可见分光光度计 北京普析;K1060型高效毛细管电泳仪 北京凯奥;42.8cm×45μm未涂层石英毛细管的毛细管 北京凯奥;精密pH试纸 上海三爱思。
1.2 实验方法
1.2.1 样品预处理 缓冲液、样品黄酒原酒、黄酒料酒、酸败黄酒原酒,测定前以稀盐酸、碳酸钠溶液调pH=3.0后,以0.45μm纤维素膜过滤后备用。
1.2.2 毛细管电泳的条件优化
1.2.2.1 电泳缓冲液的选择 由于黄酒中含有大量的酸性成分,参考相关文献[7-10]选择硼砂、磷酸氢二钠-四硼酸钠作为候选缓冲溶液。
1.2.2.2 检测波长的选择 在200~400nm范围扫描黄酒原酒,获吸收光谱,进而确定HPCE检测最佳波长。
1.2.2.3 分离电压的选择 在1.2.2.2确定的波长下,考察分离电压为5.0、6.0、7.0、8.0、9.0、10.0、20.0kV时黄酒原酒的HPCE谱,对比分析,确定适合黄酒组分分析的分离电压。
1.2.2.4 缓冲溶液pH的选择 实验选择测定缓冲液的pH分别为8.0、9.0、10.0、11.0时黄酒原酒HPCE谱,根据测定结果选择适合黄酒组分分离的缓冲液pH。
1.2.2.5 缓冲溶液离子浓度的选择 在前几步检测的基础上,考察缓冲液离子浓度对黄酒组分分离的影响。参考相关文献[7-12],实验考察离子浓度为0.025、0.05、0.075、0.1mmol/L时,黄酒原酒的HPCE谱,根据测定结果,选择最佳缓冲液离子浓度。
2 结果与分析
2.1 缓冲体系的选择
缓冲液体体系测定结果见图1。用硼砂做缓冲液时,运行电流过大,有漏电现象,基线不稳,峰形不好,迁移时间重现性差。用磷酸氢二钠-四硼酸钠缓冲液时,黄酒各组分分离效果较好,峰面积和迁移时间的重现性好,基线也很稳定。因此选择磷酸氢二钠-四硼酸钠作为缓冲溶液。
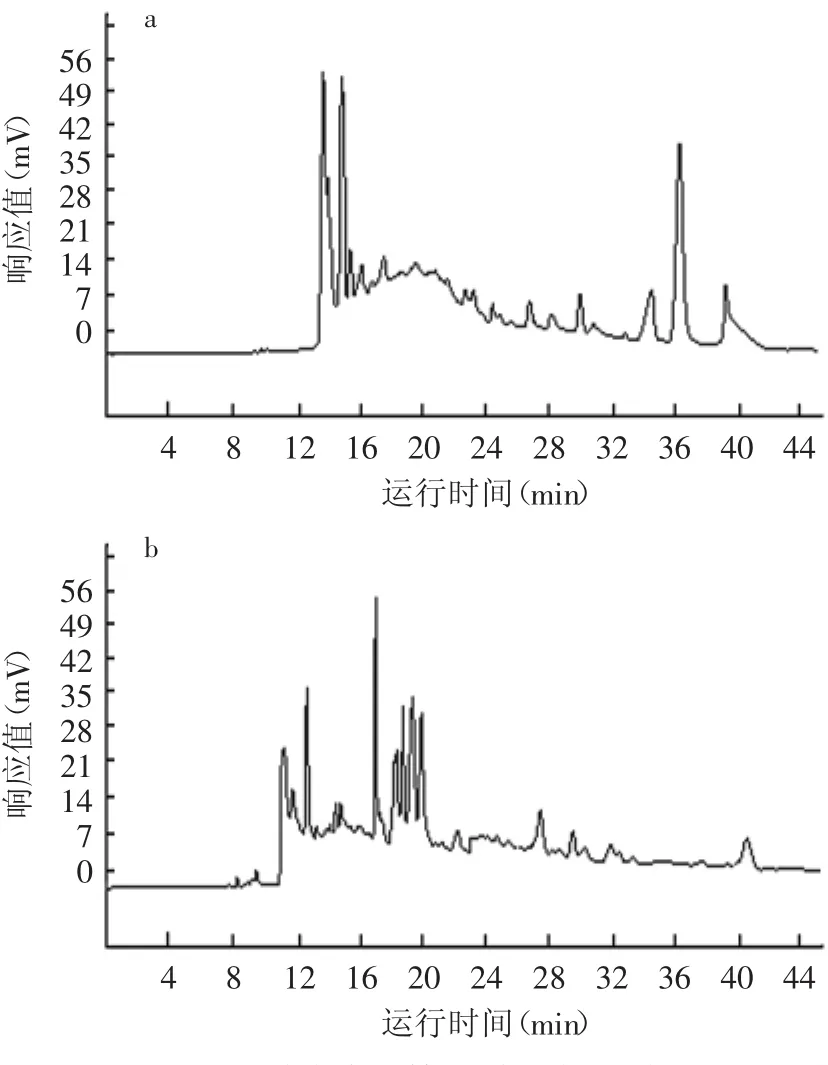
图1 缓冲液对检测结果的影响Fig.1 The HPCE graphs detected with different buffers
2.2 检测波长的选择
黄酒的200~400nm紫外扫描结果如图2所示。
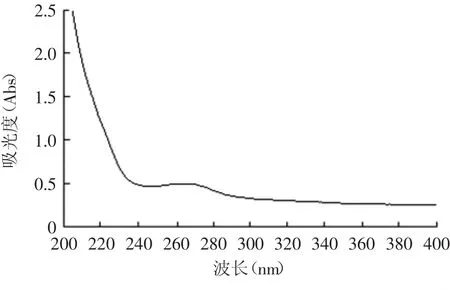
图2 黄酒原酒的紫外吸收光谱Fig.2 The UV absorption spectrum of wine base
黄酒原酒在200~240nm,250~280nm波长范围内有较强吸收,另外在365nm附近亦有弱吸收。实验选择了215、235、265和365nm作为检测波长。分析检测结果(图3)可知,检测波长在235、265和365nm时检测不够灵敏,峰面积较小。综合考虑,选择215nm作为黄酒组分分析的检测波长。

图3 不同检测波长下黄酒原酒的HPCE检测结果Fig.3 The electrophoretograms of wine base detected with different wavelengths
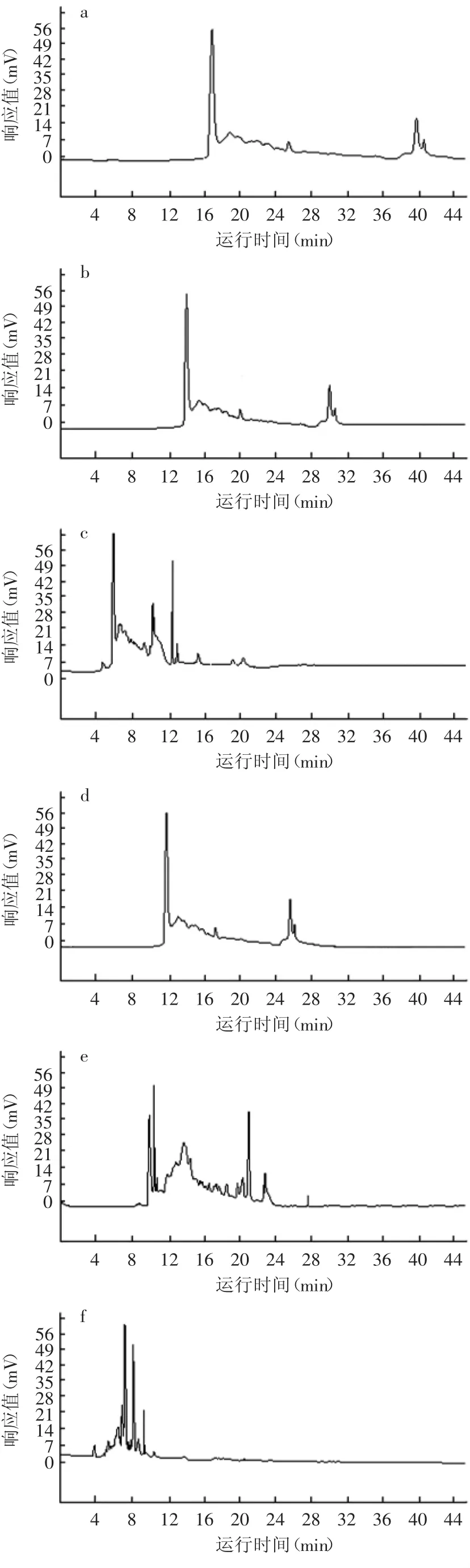
图4 电压对黄酒原酒组分分离的影响Fig.4 The electrophoretograms of wine base detected with different voltages
2.3 分离电压的选择
黄酒原酒在分离电压分别为5.0、6.0、7.0、8.0、9.0、10.0、20.0kV时的HPCE测定结果如图4所示。
分析测定结果,黄酒原酒各组分的出峰时间随分离电压的增加而提前。电压10.0kV时,毛细管内电流过大,引起毛细管电解质产生自热,柱效明显下降;分离电压达20.0kV时(图4),各组分信号堆叠无法辨认;当电压过低于7.0kV时,迁移时间延长,谱带展宽,峰高降低,灵敏度下降。综合考虑,选择8.0kV作为分离电压。
2.4 缓冲溶液pH选择
由于黄酒中的物质多以酸性物质为主[13-18],导致了它在酸性和中性条件下基本不能电离,电泳中的迁移速度与溶剂相等,其吸收峰与溶剂峰重叠,从而使精确度和重现性变差。实验选择pH为8.0、9.0、10.0及11.0进行检测。结果(图5)表明,pH为10.0时,峰形较好,基线正常,峰面积和迁移时间的重现性好。因此选择缓冲液的pH为10.0。
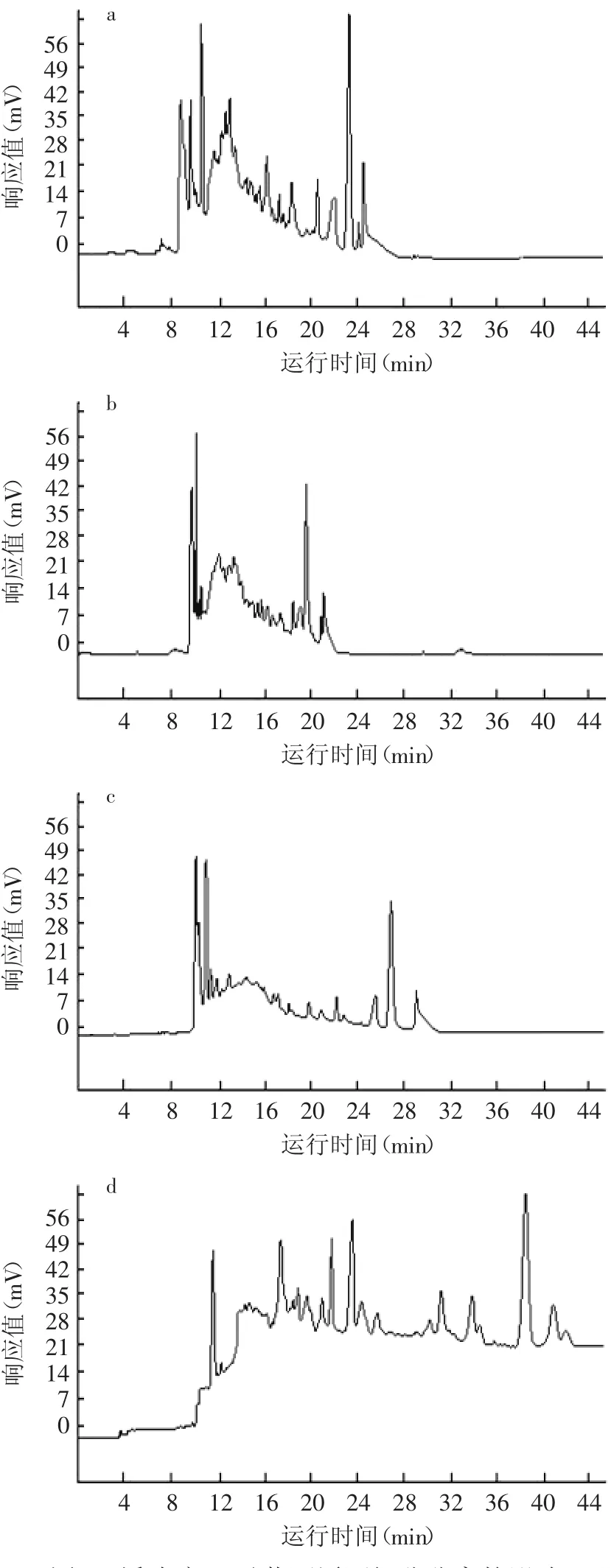
图5 缓冲液pH对黄酒原酒组分分离的影响Fig.5 The electrophoretograms of wine base detected with different pH values of buffers
2.5 缓冲溶液离子浓度选择
实验考察了磷酸氢二钠的浓度在0.025、0.05、0.075、0.1mmol/L时的基线、峰形、迁移时间和峰面积的重现性。实验结果如图6所示,可见,随着浓度的增加,基线逐渐漂移,各组分保留时间延长;在低浓度时,峰形有拖尾且峰高逐渐增加的现象,在高浓度时出现基线漂移;整个过程中,迁移时间和峰面积的重现性都较好。综合以上因素,选择缓冲液离子浓度为0.075mmol/L。
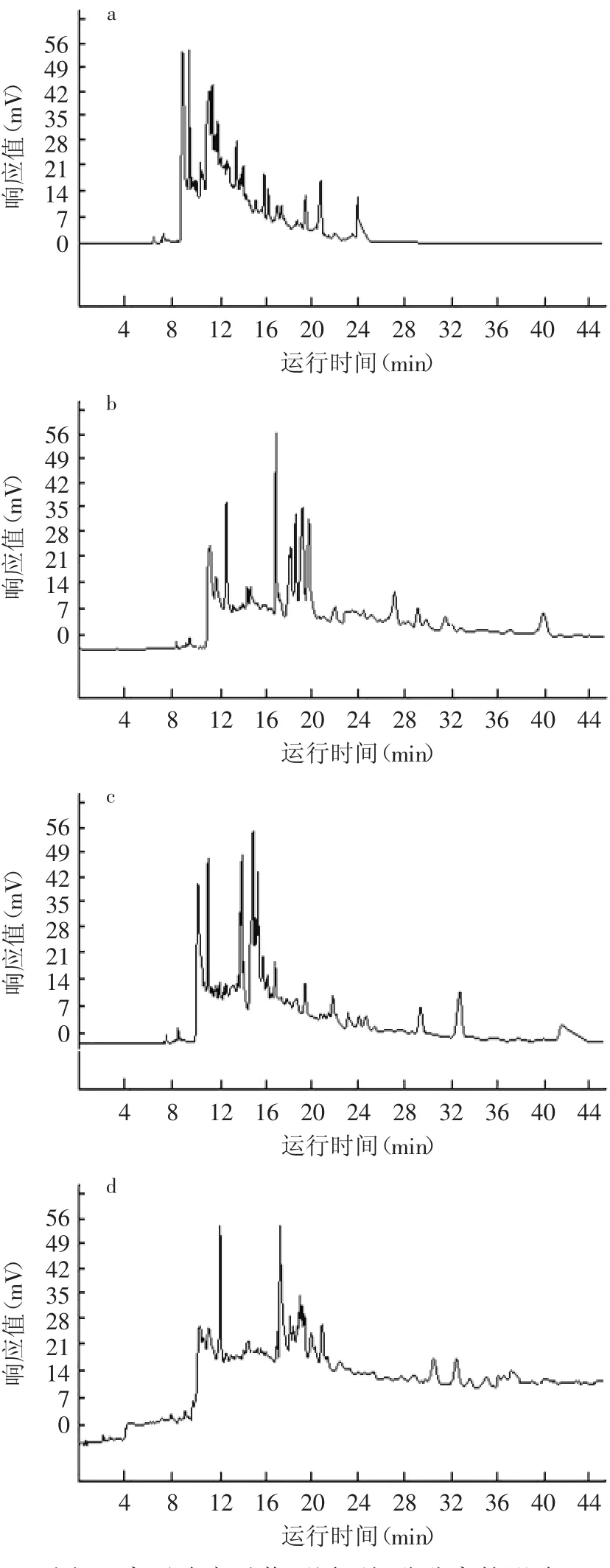
图6 离子浓度对黄酒原酒组分分离的影响Fig.6 The electrophoretograms of wine base detected with different ion concentration of buffers
综合上述实验结果,确定黄酒组分HPCE分析条件为:pH=10.0的0.075mmol/L磷酸氢二钠-四硼酸钠、检测波长215nm、分离电压8.0kV。在此检测条件下,大部分黄酒原酒组分达到基线分离。
2.6 黄酒原酒、酸败黄酒原酒原酒、黄酒料酒组分分析
为了验证依据上述实验建立的分析条件的稳定性与重现性,采用上述最佳HPCE条件下,测得黄酒原酒结果如图7a所示。在该条件下,黄酒原酒各组分基本实现基线分离,各组分出峰时间主要集中在11.0~14.0min(7个组分峰)和17.0~24.0min(11个组分峰)。此外,7.0~9.0min之间存在5个弱峰。多次重复测定,检测到黄酒原酒的物质峰数量、各组分的保留时间、峰面积等重现性良好,证明实验建立的黄酒原酒HPCE检测方法稳定性、重现性较好。
同样条件检测黄酒料酒(图7b),与黄酒原酒对比分析保留时间、相对峰位置、峰形等,在7.0~27.0min具有相同数量的组分峰,且均为共有峰。主要差别体现在黄酒料酒HPCE谱的37.0~44.0min增加了3个组分峰,可能是原酒加工成料酒过程中增加的风味组分。黄酒料酒是由黄酒原酒稀释并加入适当的调味组分勾兑而来,其化学成分与黄酒原酒基本类似。二者的HPCE谱的相似性进一步证明实验建立检测方法的稳定性和重现性。
相同条件下检测酸败黄酒原酒(图7c),与黄酒原酒对比分析其保留时间、相对峰位置、峰形,在11.0min前,未检测到明显组分峰,在11.0~14.0min只有三个峰(仅有一个为共有峰,tR=11.8min),17.0~ 24.0min部分仅有2个共有峰(tR=22.4min,23.6min)及三个小峰。在27.0~31.0min间,增加了5个峰,在tR= 46.3min处,新增了1个较强的峰。酸败黄酒原酒与黄酒原酒、黄酒料酒HPCE检测结果存在显著差异。酸败黄酒原酒是在生产黄酒原酒过程中混进有害微生物,其生长代谢消耗醪液中的营养物质,产生导致酸败的物质形成的。因此,酸败黄酒原酒的HPCE图中新增的峰包含导致黄酒酸败的部分或全部物质,在11~27.0min内缺失的共有峰代表有害微生物发酵所消耗的组分。生产过程灭菌不彻底导致有害微生物残留或侵入是黄酒酸败的主要原因。建立酸败黄酒原酒组分高效毛细管电泳检测方法,可用于黄酒生产环节中监控酸败的产生及黄酒的质量评价和质量控制。此外,可从酸败醪液中分离纯化微生物,采用本实验建立的检测方法检测这些微生物的发酵产物,通过检测其在27.0~31.0min内及46.5min处与酸败黄酒原酒共有峰的存在与否,追踪可能导致黄酒酸败的基源微生物,根据该微生物的习性,在生产过程中改进生产工艺,采取针对性灭菌或预防措施,抑制有害微生物侵入或生长,从而有效降低酸败的发生,降低黄酒生产成本。本实验可为这些后续研究奠定了基础。
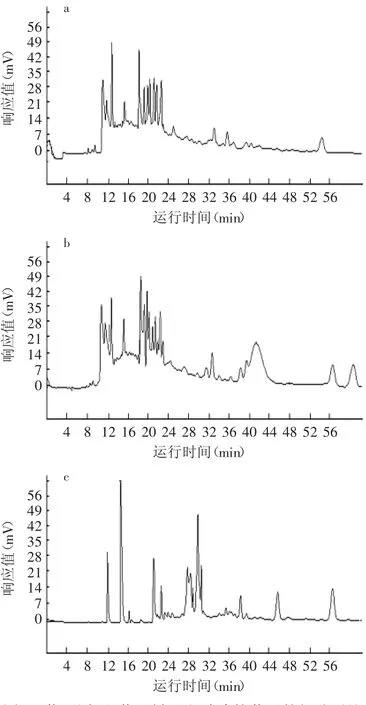
图7 黄酒原酒、黄酒料酒和酸败的黄酒的组分对比Fig.7 The HPCE analysis of wine base,marked and rancid Chinese rice wine detected with the established HPCE method
3 结论与展望
高效毛细管电泳法可有效检测黄酒原酒、黄酒料酒及酸败黄酒原酒的组分,其最适检测条件为:pH=10.0的0.075mol/L磷酸氢二钠-四硼酸钠、检测波长215nm、分离电压8.0kV,在此条件下,可实现黄酒原酒、黄酒料酒及酸败黄酒原酒组分的有效分离和检出。在本实验确立的最适检测条件下,安徽禾裕黄酒有限责任公司生产中产生的酸败黄酒原酒在HPCE图上主要表现为在保留时间27.0~31.0min内及46.5min检测到信号峰,可据此判断黄酒或生产某个环节中的醪液是否发生酸败。
[1]李勇波,赖樱花,成坚,等.HPLC检测客家黄酒酸败前后有机酸变化及工艺优化[J].中国酿造,2011(11):178-182.
[2]冯德明,剥峙清,马红霞,等.黄酒酸败时主要有机酸种类及含量分析[J].中国酿造,2010(1):125-128.
[3]蔡明迪,陈希,李汴生,等.超高压处理对黄酒陈化的影响[J].食品与发酵工业,2011,37(1):26-31.
[4]朱一松,赵光鳌,帅桂兰,等.超滤法生产的纯生黄酒非生物稳定性的研究[J].食品与发酵工业,2005,31(2):26-29.
[5]夏艳秋,朱强,汪志君.黄酒醪液酸败的影响因素及控制[J].食品与发酵工业,2004,30(7):33-37.
[6]陈乃东,陈乃富,王庆红,等.黄酒成分HPLC分析[J].安徽农学通报,2012,18(13):177-178.
[7]朱金花,陈兴国,刘绣华.高效毛细管电泳分离测定水中的乙酸和氯代乙酸[J].化学研究,2011,22(2):56-60.
[8]彭进进,罗泽娇,李龙媛.高效毛细管电泳-二极管阵列检测法测定土壤中的苯酚[J].分析科学学报,2012,28(1):98-100.
[9]汪红,王强,罗辉明,等.丹参多糖的含量测定及高效毛细管电泳法测定其单糖组分[J].中华中医药·学刊,2007,25(4):827-829.
[10]王辰,黄慧玲,莫丽冬,等.脑蛋白水解物中多肽组分的高效毛细管电泳分析[J].中国医药,2012,7(5):603-605.
[11]陈盛余,邓光辉,张桂华,等.高效毛细管电泳紫外检测法分离检测射干苷和鸢尾黄素[J].分析实验室,2011,30(3):80-82.
[12]祝仕清,牛长群.高效毛细管电泳法/液质联用分离与测控硫酸卷曲霉素各组分[J].中国抗生素杂志,2009,34(7):416-418.
[13]吕旭聪,黄志清,黄若兰,等.反相高效液相色谱法同时快速测定黄酒和葡萄酒中有机酸的含量[J].食品与发酵工业,2010,36(6):132-136.
[14]钟其顶,姚亮,熊正河.采用GC/MS和HPLC-ELSD 2种方法测定黄酒中的EC含量[J].食品与发酵工业,2007,33(3):115-119.
[15]江超,林峰,邹慧君,等.陈年绍兴黄酒的成分分析与品质鉴定[J].食品与发酵工业,2009,35(10):119-123.
[16]江伟,兰玉倩,黄毅,等.固相微萃取与气相色谱-质谱联用法对不同酒龄黄酒的微量风味分析与应用[J].食品与发酵工业,2011,37(2):144-150.
[17]戴军,谢广发,陈尚卫,等.绍兴黄酒中一种ACE活性抑制肽的分离和鉴定[J].食品与发酵工业,2005,31(5):98-101.
[18]俞关松.黄酒pH指标范围的探讨及超标的预防控制[J].食品与发酵工业,2002,28(1):76-78.
Study on establishment of HPCE method on the possible rancid constituents of yellow rice wine
CHEN Nai-dong1,2,3,HU Ping1,LUO Zhi-qiang1,MA Li1,LI Wang-yuan1
(1.College of Biotechnology and Pharmaceutical Engineering,West Anhui University,Liu’an 237012,China;2.West Anhui Biotechnology Research Center of Natural Medicine,West Anhui University,Liu’an 237012,China;3.Anhui Biotechnology Research Center of Plant Cell Engineering,Liu’an 237012,China)
Rancidity is a large challenge commonly encountered in Chinese rice wine business.In order to establish a convenient and operable assaying method for detecting main components and rancid constituents of yellow rice wine,HPCE zone electrophoresis was primarily explored involving wavelength,voltage and buffer solution including its kinds,the pH values and the ionic concentration.It was found that ideal electrophoretograms of wine base and its corresponding rancid sample as well as the marketed yellow rice wine could be obtained with wavelength 215nm,0.075nmol/L of disodic phosphate-sodium tetraborate buffer and 8.0kV of separation voltage.The remarkable differences existed between the rancid sample and the other two.These peaks represented potential rancid constituents of metamorphous Chinese rice wine could be determined by the established HPCE method.The result was helpful for the detection of rancid constituents,the establishment of quality standards and the quality control of Chinese rice wine in the future.
yellow rice wine;high performance capillary electrophoresis(HPCE);rancidity
TS255.1
A
1002-0306(2014)06-0069-06
10.13386/j.issn1002-0306.2014.08.006
2013-08-05
陈乃东(1972-),男,博士后,副教授,主要从事食品化学、天然药物活性成分分离鉴定、中药与天然药物质量标准与质量控制方面的研究。
安徽省教育厅重点项目(KJ2012A277,KJ20108259);国家自然科学基金(81274021);安徽省自然科学基金(090413113);六安市定向委托皖西学院市级研究重点项目(2011LWA001);皖西学院研究性学习项目(WXXYX2013061,WXXYX2012064,WXXYX2012066)。
