Sulfiredoxin-1通过调节peroxiredoxins表达提高大鼠星形胶质细胞抗氧化作用
2014-03-15周云川巫静娴喻姗姗
周 杨,周云川,巫静娴,喻姗姗,赵 涌
(重庆医科大学基础医学院病理学教研室分子医学与肿瘤研究中心,重庆400016)
Sulfiredoxin-1(Srxn1)是内源性的小分子抗氧化蛋白,Srxn1 在组织细胞中具有抗氧化、抗凋亡和抗炎性反应等保护作用,但具体的机制仍不清楚。在低水平H2O2刺激下,缺少Srxn1 功能的细胞,会导致其氧化还原平衡失调及凋亡[1]。吸烟人群易患COPD,同时患者肺组织内Srxn1 的表达极低,可能与吸烟打破患者肺内氧化/抗氧化平衡系统有关[2]。Peroxiredoxins(Prdxs)属于新的抗氧化蛋白超家族,它包含PrdxⅠ~PrdxⅣ,其中PrdxI ~Ⅳ是最主要抗氧化亚型。其在机体的抗氧化防御系统中有着至关重要的作用[3]。Srxn1 作为抗氧化因子能通过催化过氧化的Prdxs,使其重新恢复抗氧化功能。本研究旨在探讨星形胶质细胞氧化应激损伤过程中Srxn1 对Prdxs 活性的调控作用,为脑组织缺血后过氧化应激损伤保护提供新的实验依据。
1 材料与方法
1.1 主要试剂
新生SD 大鼠[重庆医科大学、SPF 级、动物合格证号SCXY(渝)20020003]、Srxn1 干扰慢病毒载体与阴性载体(上海吉玛制药技术有限公司)、DMEM/F12 和FBS(Gibco 公司)、H2O2(Sigma 公司)、LDH 和SOD(南京建成公司)、RNAiso Plus、RT-PCR 试剂盒、SYBR® Premix Ex Taq® (TaKaRa公司)、兔抗-GFAP 多克隆抗体(Santa Cruz 公司)、兔抗-Srxn1 多克隆抗体(北京博奥森公司)、兔抗-PrdxI-Ⅳ和兔抗Prdx-SO2/3H(Abcam 公司)。
1.2 星形胶质细胞的原代培养及纯度鉴定
提取大脑皮质细胞,进行星形胶质细胞原代培养。GFAP 免疫组化染色鉴定星形胶质细胞纯化率。0.01 mol/L PBS 快速漂洗待鉴定细胞,并用4%多聚甲醛固定30 min。用0.01 mol/L PBS 再次漂洗,5 min × 3 次。滴加适量封闭血清,湿盒,37 ℃,30 min,勿洗,滴加一抗GFAP(1∶50),4 ℃湿盒过夜。0.01 mol/L PBS 漂洗,5 min ×3 次,滴加荧光二抗Alexa Fluor 594 (1∶100),湿盒,37 ℃,30 min,PBS 清洗,避光加入Hoechst 33342 工作液标记所有细胞核,室温作用20 min,PBS 清洗,甘油封片,荧光显微镜下发光。Hoechst 33342 染色显示细胞核并代表细胞总数,随机选取4 个高倍视野,观察GFAP 阳性率,并可以同时观察细胞的慢病毒转染效率。
1.3 星形胶质细胞的转染
根据前期实验结果,由上海吉玛制药技术有限公司设计、构建shRNA-Srxn1-LV3 干扰的慢病毒载体片段,Sh-RNA 序列为5'-CATCCACACCAGACTTG CAGT-3',阴性对照序列为5'-TTCTCCGAACGTGTC ACGT-3'。将Sh-RNAs 按照说明书转染至星形胶质细胞中,并在荧光显微镜下观察其转染效率。
1.4 H2O2 星形胶质细胞模型的建立
1)用DMEM/F12 完全培养液将H2O2母液稀释至浓度为10-3mol/L。2)加入稀释后H2O2至需处理的星形胶质细胞中,并加入适量的DMEM/F12 完全培养液使其浓度为100 μmol/L。移至37 ℃、5%CO2孵箱内继续培养。3)6 h 后即可进行后续试验。
1.5 LDH 漏出率的检测
根据其试剂盒说明书进行操作。酶标仪检测(A450nm)待测组吸光度值。
1.6 SOD 的检测
根据其试剂盒说明书进行操作。酶标仪检测(A450nm)待测组吸光度值从而计算出SOD 含量。
1.7 Western blot 检测Srxn1 蛋白表达水平
提取细胞总蛋白,采用BCA 法测定蛋白浓度。根据所测蛋白浓度配平后进行上样、SDS 凝胶电泳、切胶、转膜、TBST 洗膜和封闭,加入稀释好的目的蛋白一抗4 ℃孵育过夜,复温20 min 后,TBST 洗膜,加入稀释好的目的蛋白的二抗,室温孵育1.5 h,TBST 洗膜,ECL 化学发光检测。运用Quantity One软件分析,检测目的蛋白条带吸光度值与内参β-actin 条带吸光度值。目的蛋白的相对表达量=目的蛋白条带吸光度值/内参β-actin 条带吸光度值。
1.8 Real-time QPCR 检测Srxn1 mRNA 表达水平
根据试剂盒说明书,提取细胞总RNA,反转录成cDNA 作为模板,进行QPCR 反应。引物序列:Srxn1 上游5'-CCCAAGGCGGTGACTACTAC-3',下游5'-GGCAGGAATGGTCTCTCTCTGTG-3';β-actin 上游5'-CACCCGCGAGTACAACCTTC-3',下游5'-CCCAT ACCCACCATCACACC-3'。反应体系:2 μL cDNA 模板,各1 μL 10 mol/L 的上下游引物,12.5 μL 2 ×SYBR® Premix Ex Taq®,8.5 μL ddH2O2。反应条件:95 ℃10 s;95 ℃5 s,60 ℃15 s,72 ℃15 s,39个循环;72 ℃5 s,95 ℃持续。运用2ΔΔCt[10]方法Bio-Rad CFX Manager Software 软件进行分析。
1.9 统计学分析
2 结果
2.1 大鼠星形胶质细胞纯度鉴定及转染效率鉴定
传2 代星形胶质细胞胞体大,胞核大而圆常偏于胞体一侧。细胞突触分支多,且丰富,相互交织成网状。星形胶质细胞红色荧光阳性率达到90%以上(图1A,B)。同时观察到,细胞慢病毒载体的绿色荧光转染效率达到85%以上(图1C,D)。
2.2 Sh-RNA 干扰效率及干扰Srxn1 对氧化应激损伤的星形胶质细胞Srxn1 表达的影响
与对照组及阴性对照组相比,干扰Srxn1 后Srxn1 蛋白表达下调约59.2%(P<0.01);H2O2处理后Srxn1 蛋白上调137.3% (P<0.01)。与Sh-Srxn1组相比,Sh-Srxn1 + H2O2组的Srxn1 蛋白表达增高135.6%(P<0.01)(图2)。与对照组相比较,干扰Srxn1 后Srxn1 基因水平降低至36.4%(P<0.01)(图2)。
2.3 干扰Srxn1 对氧化应激损伤的星形胶质细胞损伤程度的影响
与对照组及阴性对照组相比,H2O2处理星形胶质细胞后,LDH 漏出率增加170.9%(P<0.01)。当干扰Srxn1 后,细胞的损伤程度进一步增高98.2%(P<0.01)(图3)。
2.4 干扰Srxn1 对氧化应激损伤的星形胶质细胞SOD 活性的影响
与对照组及阴性对照组相比,Sh-Srxn1 组SOD 活性降低32.8% (P<0.01);H2O2组SOD 活性降低56.4%(P<0.01);当给予H2O2处理后再干扰Srxn1,SOD 活性进一步降低76.9%(P<0.05)(图4)。
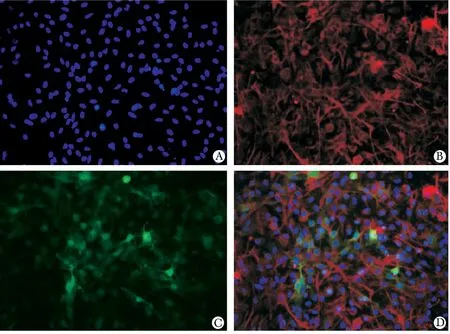
图1 原代星形胶质细胞纯度及转染效率Fig 1 Identification of astrocytes purity and transfection efficiency(×200)
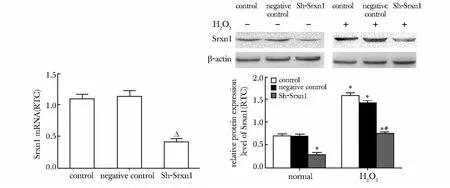
图2 Sh-RNA 干扰效率及干扰Srxn1 对氧化应激损伤的星形胶质细胞Srxn1 表达的影响Fig 2 The efficiency of Sh-RNA interference and the expression of Srxn1 in response to oxidative stress(n=3)

图3 干扰Srxn1 对氧化应激损伤的星形胶质细胞损伤程度的影响Fig 3 Sh-Srxn1 mediated Srxn1 increased cell damage(n=6)
2.5 干扰Srxn1 对氧化应激损伤的星形胶质细胞2-Cys Prdxs 和Prdx-SO2/3H 表达的影响
与对照组及阴性对照组相比,H2O2损伤后PrdxⅠ~Ⅳ和Prdx-SO2/3H 的蛋白水平上调(P<0.01)。干扰Srxn1 则可抑制PrdxⅠ~Ⅳ蛋白水平的增高,提高Prdx-SO2/3H 蛋白水平的表达(图5)。
3 讨论
脑血管病是当今3 大致死疾病之一,是首位致残因素[4]。氧化应激很可能是造成缺血性脑血管病不可逆损伤的关键因素。前期研究表明Srxn1 可以保护PC12 细胞免H2O2诱导的氧化应激性损伤[5]。目前Srxn1 在星形胶质细胞中的抗氧化保护作用及可能机制尚不清楚。
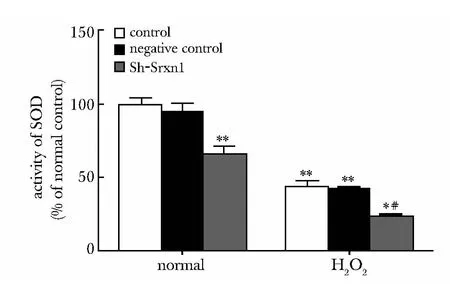
图4 干扰Srxn1 对氧化应激损伤的星形胶质细胞SOD 活性的影响Fig 4 Effects of Srxn1 on superoxide dismutase(SOD)activity(n=6)
为了进一步探讨Srxn1 在脑血管疾病中的神经保护功能。本研究采用大鼠星形胶质细胞作为靶细胞,构建H2O2模型,应用慢病毒干扰技术,研究Srxn1 的神经保护。Srxn1 作为一个内源性的小分子抗氧化蛋白,在细胞受到外界损伤刺激会诱导其表达水平增高[6]。H2O2损伤后,Srxn1 蛋白水平升高。LDH 是衡量细胞损伤的重要指标,结果显示H2O2损伤后,细胞LDH 漏出率显著增加,且干扰Srxn1 后LDH 漏出率增加更显著。SOD 是反映氧化应激损伤的有效指标。H2O2损伤后,细胞内SOD活力明显下降,且干扰Srxn1 后使SOD 活力下降更为明显。这些结果表明干扰Srxn1 会加重细胞的氧化应激性损伤。
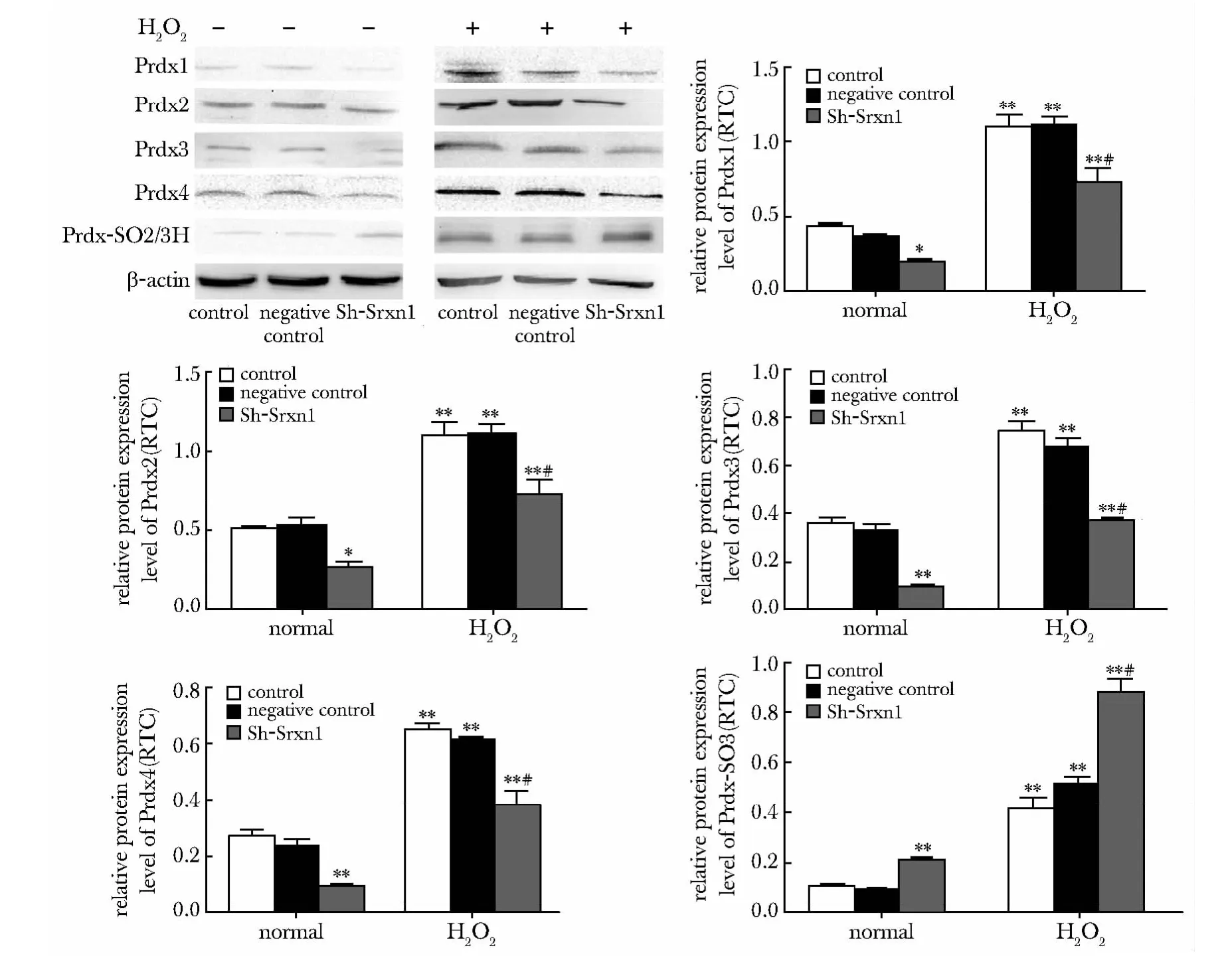
图5 干扰Srxn1 对氧化应激损伤的星形胶质细胞2-Cys Prdxs 和Prdx-SO2/3H 表达的影响Fig 5 Srxn1 depletion resulted in decreased expression of Prdxs and retarded the reduction of Prdx-SO2/3H(n=3)
Peroxiredoxins(Prdxs)属于新的不断扩展的抗氧化蛋白超家族,它包含PrdxⅠ~PrdxVI[3]。当脑缺血再灌注损伤发生时,Prdxs 过度氧化。在MCA供血区域,包在中枢神经系统中,Prdxs 作为自由基清除剂,对很多细胞起着重的保护作用,括皮质和纹状体[7]。在神经细胞体外缺血的研究中,2-Cys Prdxs 在高表达的模型和神经退行性病变组织中都起着重要的作用[8-10]。Srxn1 可以特异性地将过氧化的Prx-SO2/3H 还原为带有巯基的形式,恢复Prdxs 的抗氧化活性,可以进一步维持细胞内环境氧化/抗氧化平衡。在胶质细胞氧化应激损伤过程中是否存在着Srxn1 对其下游Prdxs 因子的调控作用未见有文献报道。结果显示,干扰Srxn1 后,2-Cys Prdxs 表达降低,而Prdx-SO2/3H 作为过氧化的标志物在星形胶质细胞中明显的增高。这些结果表明,在分子水平上Srxn1 可通过抑制Prdx-SO2/3H 的形成,增加2-Cys Prdxs 的活性而发挥抗氧化损伤的作用。
综上所述,Srxn1 作为一个重要的氧化应激诱导的基因,在干扰Srxn1 后导致星形胶质细胞对H2O2诱导的氧化应激性损伤的敏感性增加。Srxn1在星形胶质细胞氧化应激损伤中的确起着重要的保护作用。且Srxn1 可通过抑制Prdx-SO2/3H 的形成,提高抗氧化蛋白2-Cys Prdxs 的活性,从而发挥抗氧化应激损伤的作用。
[1]JY Baek,SH Han,SH Sung,et al.Sulfiredoxin protein is critical for redox balance and survival of cells exposed to low steady-state levels of H2O2[J].J Biol Chem,2012,287:81-89.
[2]A Singh,G Ling,AN Suhasini,et al.Nrf2-dependent sulfiredoxin-1 expression protects against cigarette smoke-induced oxidative stress in lungs[J].Free Radical Biol Med,2009,46:376-386.
[3]SG Rhee,HA Woo,IS Kil,et al.Peroxiredoxin functions as a peroxidase and a regulator and sensor of local peroxides[J].J Biol Chem,2012,287:4403-4410.
[4]A Liesz,L Sun,W Zhou,et al.FTY720 reduces post-ischemic brain lymphocyte influx but does not improve outcome in permanent murine cerebral ischemia[J].PloS one,2011,6:e21312,doi:10.1371/journal.
[5]Q Li,S Yu,J Wu,et al.Sulfiredoxin ‐1 protects PC12 cells against oxidative stress induced by hydrogen peroxide[J].J Neurosci Res,2013,91:861-870.
[6]W Jeong,SH Bae,MB Toledano,et al.Role of sulfiredoxin as a regulator of peroxiredoxin function and regulation of its expression[J].Free Radical Biol Med,2012,53:447-456.
[7]FX Soriano,P Baxter,LM Murray,et al.Transcriptional regulation of the AP-1 and Nrf2 target gene sulfiredoxin[J].Mol Cells,2009,27:279-282.
[8]SH Bae,SH Sung,HE Lee,et al.Peroxiredoxin III and sulfiredoxin together protect mice from pyrazole-induced oxidative liver injury[J].Antioxid Redox Signal,2012,17:1351-1361.
[9]I Bendix,U Weichelt,K Strasser,et al.Hyperoxia changes the balance of the thioredoxin/peroxiredoxin system in the neonatal rat brain[J].Br Res,2012,1484:68-75.
[10]Iván Iglesias-Baena,Sergio Barranco-Medina,Alfonso Lázaro-Payo,et al.Characterization of plant sulfiredoxin and role of sulphinic form of 2-Cys peroxiredoxin[J].J Exp Botany,2010,61:1509-1521.
