环孢素A改善创伤失血性休克大鼠血管及器官功能
2014-03-15董兆君
雷 艳,董兆君
(第三军医大学1.卫勤训练基地医学综合教研室;2.军事预防医学院毒理学研究所,重庆400038)
线粒体通透性转换孔(mitochondrial permeability transition pore,MPTP)是线粒体膜上的重要的通道结构,在缺血缺氧和再灌注引起的器官功能损害中有重要作用[1-2]。环孢素A(cyclosporin A,CsA)是目前发现的特异性MPTP 关闭剂,能够通过抑制MPTP 开放发挥对缺血再灌注心脏的保护作用[3]。笔者曾发现,CsA 对创伤失血性休克动物有较好的治疗作用,能有效改善休克后的酸中毒状态[4]。严重创伤休克后血管功能障碍是影响休克患者组织灌注不足和随后发生的器官功能障碍的关键因素[5-6]。但CsA 能否改善休克后血管功能,改善组织灌注,发挥对器官功能的保护作用,目前尚不清楚。本实验采用大鼠创伤失血性休克模型,观察不同剂量CsA 对休克动物血管收缩/舒张功能的影响,同时观察CsA 对肝、肾重要器官血流量、肝肾功能及线粒体功能的影响,以探讨CsA发挥对休克动物保护作用的途径。
1 材料与方法
1.1 实验动物与试剂
清洁级SD 大鼠48 只,体质量180 ~220 g,雌雄各半[第三军医大学大坪医院实验动物中心提供,合格证号SCXK(渝)2007-0005]。CsA、二磷酸腺苷(ADP)、乙酰胆碱(Sigma 公司),天冬氨酸氨基转移酶(AST)检测试剂盒、丙氨酸氨基转移酶(ALT)检测试剂盒、血尿素氮(BUN)检测试剂盒、血肌酐(CREA)检测试剂盒(Bechman 公司)。其他试剂均为国产分析纯。
1.2 创伤失血性休克大鼠模型建立及实验分组
复制创伤失血性休克模型[6]:大鼠右侧股动脉及股静脉插管,通过股动脉插管放血使血压降至40 mmHg,并维持3 h,折断左侧股骨。大鼠随机分为6 组(n =8):对照组、休克组、乳酸林格氏液(LR)复苏组、CsA 1、5 和10 mg/kg 组。休克模型完成后按照分组进行复苏:LR 组给予2 倍失血量的LR 输注,CsA 组在LR 中加入不同剂量的CsA 输注;休克组在休克模型完毕后不复苏;对照组仅插管、不放血、不复苏。在复苏后2 h,检测各项功能指标。
1.3 肝/肾血流量和肝/肾功能检测
将大鼠行剖腹手术,通过激光多普勒血流监测仪(PeriFlux System 5000)测定肝/肾的血流量[7]。从股动脉抽血,用全自动生化分析仪(Beckman)测定肝肾功能,包括AST、ALT、BUN 和CREA[7]。
1.4 血管收缩/舒张反应性测定
采用离体血管环张力测定技术[6],记录血管在梯度浓度去甲肾上腺素(norepinephrine,NE,1×10-9、1×10-8、1×10-7、1 ×10-6和1 ×10-5mol/L)下的收缩力(收缩反应性用NE 诱导血管收缩力与124 mmol/L的高K+诱导的预收缩力的百分比表示)[8]。随后记录血管对不同浓度的乙酰胆碱(acetylcholine,ACh,1 ×10-9、1 ×10-8、1 ×10-7、1 ×10-6和1 ×10-5mol/L)的舒张反应性(以加入ACh 后血管环收缩力减少的百分比反映)。
1.5 线粒体功能检测
提取肝、肾和小肠的线粒体,通过溶氧仪(MT 200)测定在有ADP 刺激下(3 态呼吸)和无ADP 刺激下(4 态呼吸)的氧气消耗量,以呼吸控制率(RCR,即3 态呼吸耗氧率和4 态呼吸耗氧率的比值)来反映线粒体功能[6]。
1.6 统计学分析
2 结果
2.1 CsA 对创伤失血性休克大鼠血管收缩/舒张功能的影响
休克后大鼠肠系膜上动脉对NE 诱导的血管收缩反应明显降低(P<0.01)。LR 组大鼠的血管收缩功能有轻度回升,但仍显著低于对照组。CsA 输注可使休克大鼠血管收缩功能明显恢复,其中CsA 5 和10 mg/kg 组血管最大收缩反应明显高于LR 组(P<0.01)(图1)。CsA 也明显恢复了休克后降低的血管舒张反应性,CsA5 mg/kg 组血管最大舒张反应性明显高于LR 组(P<0.05)(图2)。

图1 NE 诱导的收缩反应的量效曲线Fig 1 Effects of CsA on the concentration-response curve for NE(1 ×10 -9 ~1 ×10 -5 mol/L)in SMA of rats after traumatic hemorrhagic shock(% of the contraction produced by 124 mmol/L K +,±s,n=8)
2.2 CsA 对创伤失血性休克大鼠器官血流量的影响
与对照组相比,休克后大鼠肝及肾的血流量均显著降低(P<0.01)。5 mg/kg 和10 mg/kg 的CsA输注可明显恢复器官血流量,明显高于LR 组(P<0.01,P<0.05)(表1)。
2.3 CsA 对创伤失血性休克大鼠肝肾功能的影响
休克后肝、肾功能的重要指标都明显升高,包括AST、ALT、BUN 和CREA(P<0.01)。与LR 组相比,CsA(1 和5 mg/kg)可明显降低休克大鼠血浆中ALT 和CREA 的水平(P<0.01,P<0.05)。但LR和CsA 对AST 和BUN 无明显影响(表2)。

图2 ACh 诱导的舒张反应的量效曲线Fig 2 Effects of CsA on the concentration-response curve for ACh(1 ×10 -9 ~1 ×10 -5 mol/L)in SMA of rats after traumatic hemorrhagic shock(±s,n=8)
表1 CsA 对创伤失血性休克大鼠器官血流量的影响Table 1 Effects of CsA on blood flow in the liver and kidney after traumatic hemorrhagic shock(±s,U/min,n=8)

表1 CsA 对创伤失血性休克大鼠器官血流量的影响Table 1 Effects of CsA on blood flow in the liver and kidney after traumatic hemorrhagic shock(±s,U/min,n=8)
*P<0.01 compared with sham group;#P<0.05,##P<0.01 compared with LR group.
groupliverkidney sham614 ±53302 ±29 shock356 ±58*67 ±15*LR328 ±65132 ±34 CsA 1 mg/kg413 ±47189 ±28#CsA 5 mg/kg444 ±50##224 ±48##CsA 10 mg/kg428 ±55#192 ±24#
2.4 CsA 对创伤失血性休克大鼠器官线粒体功能的影响
休克也使肝、肾、肠的线粒体功能明显降低(P<0.01)。LR 复苏后各器官线粒体功能无明显改改善。CsA 5 mg/kg 输注能明显改善各器官的线粒体功能,其作用明显优于单用LR 复苏(P<0.01)(表3)。
表2 CsA 对创伤失血性休克大鼠肝肾功能的影响Table 2 Effects of CsA on the liver and kidney function after traumatic hemorrhagic shock (±s,n=8)
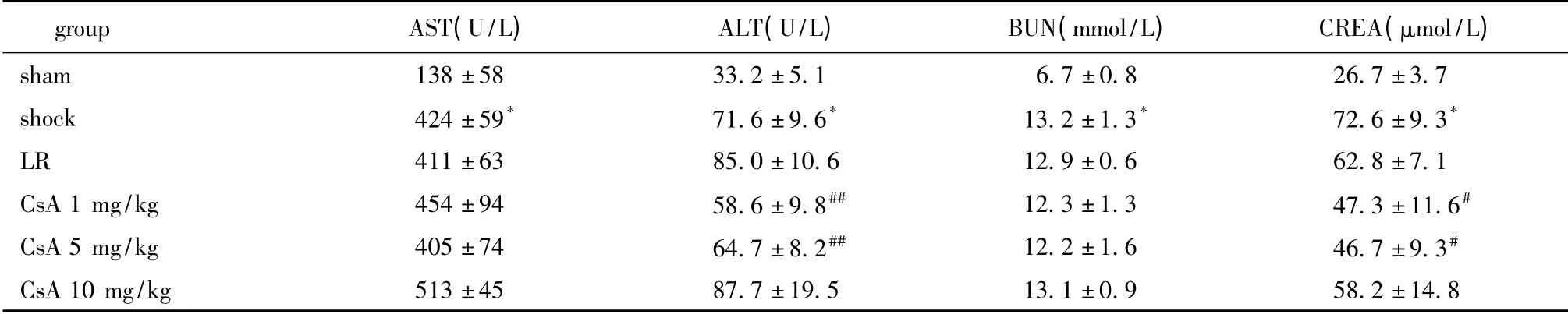
表2 CsA 对创伤失血性休克大鼠肝肾功能的影响Table 2 Effects of CsA on the liver and kidney function after traumatic hemorrhagic shock (±s,n=8)
*P<0.01 compared with sham group;#P<0.05,##P<0.01compared with LR group.
groupAST(U/L)ALT(U/L)BUN(mmol/L)CREA(μmol/L)sham138 ±5833.2 ±5.16.7 ±0.826.7 ±3.7 shock424 ±59*71.6 ±9.6*13.2 ±1.3*72.6 ±9.3*LR411 ±6385.0 ±10.612.9 ±0.662.8 ±7.1 CsA 1 mg/kg454 ±9458.6 ±9.8##12.3 ±1.347.3 ±11.6#CsA 5 mg/kg405 ±7464.7 ±8.2##12.2 ±1.646.7 ±9.3#CsA 10 mg/kg513 ±4587.7 ±19.513.1 ±0.958.2 ±1 4.8
表3 CsA 对创伤失血性休克大鼠器官线粒体功能的影响Table 3 Effects of CsA on the mitochondrial function(RCR)in the liver,kidney and intestine after traumatic hemorrhagic shock (±s,n=8)

表3 CsA 对创伤失血性休克大鼠器官线粒体功能的影响Table 3 Effects of CsA on the mitochondrial function(RCR)in the liver,kidney and intestine after traumatic hemorrhagic shock (±s,n=8)
*P<0.01 compared with sham-operated group;#P<0.01 compared with LR group.
groupliverkidneyintestine sham6.58 ±1.195.61 ±0.927.38 ±1.34 shock3.45 ±0.91*3.51 ±0.73*3.73 ±0.38*LR3.39 ±0.593.13 ±0.854.20 ±0.86 CsA 1 mg/kg5.21 ±0.825.21 ±1.33#6.50 ±1.42#CsA 5 mg/kg6.11 ±1.23#5.40 ±0.60#6.70 ±1.21#CsA 10 mg/kg4.07 ±1.553.54 ±1.314.94 ±1.50
3 讨论
血管低反应性是严重创伤休克及脓毒症等临床重症患者常出现的一种血管功能障碍,是导致严重器官功能损害甚至患者死亡的重要原因[6]。前期研究发现,MPTP 的关闭剂CsA 能明显改善休克动物的存活状态,并纠正休克后的酸中毒状态[4]。CsA 是一种免疫抑制剂,广泛用于治疗器官移植后的排斥反应,近来研究发现它能有效地抑制MPTP的开放,对缺血再灌注后心、脑损伤有较好的保护作用[3]。但CsA 对休克后血管低反应性的作用及其与器官功能的关系,目前尚少见报道。本研究显示CsA 可明显恢复休克后降低的血管收缩/舒张功能,其中5 mg/kg 的CsA 效果最为明显。CsA 5 mg/kg对肝及肾组织血流量、肝肾功能和线粒体功能也有明显改善作用。提示CsA 除了对缺血再灌注损伤的心肌有保护作用,还可通过恢复休克后血管反应性,改善重要器官的血流灌注,改善器官功能和线粒体功能,来发挥抗休克作用。
在本实验中也发现,CsA 10 mg/kg 也可改善休克血管功能和器官血流量,但对于肝肾功能及线粒体功能,其作用与单用LR 无明显差异,提示CsA 剂量增加并未提高其治疗作用。有研究显示高剂量CsA 可能引起严重的不良反应[9]。因此,合适的CsA 使用剂量需更多的实验来验证。根据本结果,CsA 5 mg/kg 可能是合适的剂量。
以上结果显示,CsA 对休克后血管的收缩和舒张功能都有明显的恢复作用,并可提高组织器官的血流灌注,改善器官和线粒体功能,发挥对创伤休克的治疗作用。但是,CsA 作为免疫抑制剂,用于治疗休克等临床重症时,是否会影响患者的免疫功能,尚需进一步研究。
[1]Assaly R,de Tassigny Ad,Paradis S,et al.Oxidative stress,mitochondrial permeability transition pore opening and cell death during hypoxia-reoxygenation in adult cardiomyocytes[J].Eur J Pharmacol,2012,675:6-14.
[2]Schwarzkopf TM,Hagl S,Eckert GP,et al.Neuroprotection by bilobalide in ischemia:improvement of mitochondrial function[J].Pharmazie,2013,68:584-589.
[3]Gill RS,Lee TF,Manouchehri N,et al.Postresuscitation cyclosporine treatment attenuates myocardial and cardiac mitochondrial injury in newborn piglets with asphyxia-reoxygenation[J].Crit Care Med,2013,41:1069-1074.
[4]雷艳,董兆君.环孢素A 对大鼠缺血缺氧后酸碱平衡的调节作用[J].局解手术学杂志,2013,22:374-376.
[5]杨光明,李涛,徐竞,等.ERK 和P38 MAPK 升高MLC20 磷酸化调节大鼠平滑肌低氧反应性[J].基础医学与临床,2011,31:366-370.
[6]Yang GM,Li T,Xu J,et al.PKC plays an important mediated effect in arginine vasopressin induced restoration of vascular responsiveness and calcium sensitization following hemorrhagic shock in rats[J].Eur J Pharmacol,2010,628:148-154.
[7]Li T,Lin X,Zhu Y,et al.Short-term,mild hypothermia can increase the beneficial effect of permissive hypotension on uncontrolled hemorrhagic shock in rats[J].Anesthesiology,2012,116:1288-1298.
[8]Wirth A,Benyó Z,Lukasova M,et al.G12-G13-LARGmediated signaling in vascular smooth muscle is required for salt-induced hypertension[J].Nat Med,2008,14:64-68.
[9]程根阳,李建生,刘章锁.罗格列酮抑制CsA 引起的大鼠肝细胞TGF-β1 和FIBRONECTIN 的表达[J].基础医学与临床,2009,29:198-200.
