五水硫代硫酸钠相变蓄热材料的制备*
2014-03-15高学农胡小冬陈思婷方玉堂
高学农 胡小冬 陈思婷 方玉堂
(华南理工大学传热强化与过程节能教育部重点实验室∥化学与化工学院,广东广州510640)
作为一种应对能源危机的重要手段,蓄热技术能解决热能供求在时间或空间上不匹配的矛盾,提高能源利用效率.目前常用的蓄热技术主要包括显热蓄热、潜热蓄热和化学反应热蓄热3种[1].潜热蓄热是利用相变材料在相变过程中从环境吸收或向环境释放热量,从而达到热量储存或释放的目的;相变蓄热具有储能密度高、蓄/放热近似等温、过程易控制等优点.相变材料是相变蓄热技术的基础,水合无机盐是其中重要的一类,可提供多达70余种的熔点从几摄氏度到一百多摄氏度的相变材料[2].水合无机盐具有价格便宜、体积蓄热密度大、熔解热高、熔点固定、热导率比有机相变材料大、一般呈中性等优点[3-4];但此类相变材料通常存在过冷和相分离现象,严重影响了其蓄热性能,缩短了材料的使用寿命.目前,常用的解决过冷的方法主要有添加成核剂和冷指法;常用的解决相分离的方法主要有添加增稠剂、添加晶体结构改变剂、采用薄壁容器盛装相变材料、摇晃或搅动等.
近年来,研究者对十水硫酸钠[5-6]、六水氯化钙[7-8]、三水醋酸钠[9-18]、十二水磷酸钠[19-20]等水合无机盐蓄热性能进行了研究,提出通过添加成核剂和增稠剂来解决各水合无机盐的过冷和相分离问题.五水硫代硫酸钠是一种重要的水合无机盐,其相变温度为48.5℃,相变焓为210 J/g,作为蓄热材料主要适用于房间采暖和电子设备热管理等,近年来亦有研究者对其进行了相关研究.李艳等[21]将相变温度和相变焓分别为45.2℃和206.0J/g的五水硫代硫酸钠-硫酸钠二元体混合物应用于CPU散热;李金[22]将五水硫代硫酸钠吸附在多孔结构的水泥内,制备出水合无机盐-水泥复合相变储热材料,并应用于建筑采暖.然而,五水硫代硫酸钠相当不稳定,硫元素处于中间价态,使得硫代硫酸钠与空气接触时易发生氧化还原反应;此外,纯五水硫代硫酸钠熔融后静置在室温下,甚至不会出现结晶放热现象.五水硫代硫酸钠性能方面的这些不足,使其作为相变蓄能材料的应用受到了限制.截至目前,有关五水硫代硫酸钠改性研究的报道相对较少.相关研究表明[23],在五水硫代硫酸钠中添加2% ~4%的羧甲基纤维素(CMC)可解决相分离的问题;丁益民等[24]研究了水合无机盐的成核原理,提出为减小水合无机盐的过冷度,必须选择与其具有相同晶型、相似原子排列且两者的晶格参数相差在15%以内的物质作成核剂.
由于目前制备五水硫代硫酸钠相变蓄热材料的方法仍在摸索阶段,所以文中基于爱迪生法则和前人相关研究成果,选择萘酚和二水硫酸钙作为成核剂,以活性白土、CMC和水溶性石蜡等为增稠剂,对五水硫代硫酸钠进行改性;并通过步冷曲线和差示扫描量热分析(DSC)对改性后的五水硫代硫酸钠蓄/放热性能进行研究,制备出性能稳定的五水硫代硫酸钠相变蓄能材料.
1 实验
1.1 实验材料与设备
五水硫代硫酸钠、二水硫酸钙,分析纯,天津市科密欧化学试剂有限公司生产;萘酚,分析纯,国药集团化学试剂有限公司生产;氯化钠,分析纯,天津市大茂化学试剂有限公司生产;CMC、水溶性石蜡、活性白土等其他试剂纯度均不低于99.0%.
HH-2型数显恒温水浴锅,常州澳华仪器有限公司生产;GZX-9140MB型电热恒温鼓风干燥箱,上海博讯实业有限公司医疗设备厂生产;XP1203S型Sartorius电子精密天平,北京赛多利斯仪器系统有限公司生产;DSC2910型差示扫描量热仪,美国TA仪器公司生产;Agilent 34970A型数据采集仪,美国Aglient公司生产,可通过热电偶自动采集相变材料蓄/放热过程中各测点的温度;实验选用的K型热电偶均由testo 735标准温度计标定,标定时,热电偶与标准温度计的pt100精密探头一同置于恒温水槽中,热电偶的温度值直接由Agilent 34970A型数据采集仪读取,标定后系统测量误差为±0.05℃.
1.2 实验过程
往五水硫代硫酸钠中添加不同成核剂或增稠剂,于试管中混合,试管用锡箔纸包裹避光保存.试管盖与热电偶连接处用AB胶密封,在70℃恒温水浴锅中加热,熔融1 h,取出在室温下冷却得到步冷曲线,并做循环实验.取少量晶体进行DSC分析,得到材料的相变潜热、峰值温度及相变温度;DSC测试温度范围为0~70℃,升温速率为10℃/min,高纯氮气保护,吹扫气流量为50mL/min.材料蓄/放热性能测试装置如图1所示.
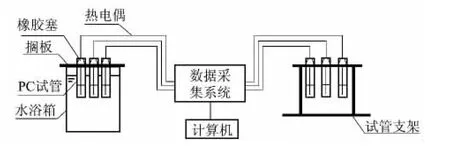
图1 实验装置示意图Fig.1 Sketch of experimental system
2 结果与讨论
2.1 二水硫酸钙改性五水硫代硫酸钠
在五水硫代硫酸钠中加入不同量的二水硫酸钙后得到的Na2S2O3·5H2O-CaSO4·2H2O体系的步冷曲线如图2所示.
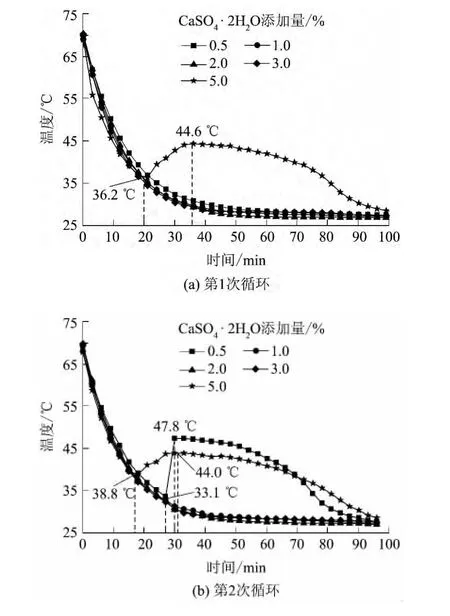
图2 Na2S2O3·5H2O-CaSO4·2H2O体系的步冷曲线Fig.2 Cooling curves of Na2S2O3·5H2O-CaSO4·2H2O systems
由图2(a)可见,二水硫酸钙的添加量为5.0% (质量分数,以五水硫代硫酸钠质量为基准计,余同)时,体系温度降低至36.2℃时开始结晶,温度逐渐升至44.6℃后开始下降.以系统结晶开始温度上升时刻为起始点,以放热至最终温度基本保持不变时为终点,这个过程所需的时间记为放热时间,该系统的放热时间长达70min.
由图2(b)可见:在第2次循环中,Na2S2O3· 5H2O-CaSO4·2H2O体系结晶时最高温度达到47.8℃,放热时间约60 min,且放热温度维持在47.0℃附近的时间较长;而二水硫酸钙添加量为1.0%、2.0%、3.0%时,体系温度降低至27℃都没有观察到结晶.由此可见,二水硫酸钙添加量为0.5%、5.0%时对五水硫代硫酸钠具有较好的成核效果,并且二水硫酸钙添加量为5.0%时,两次循环过程中五水硫代硫酸钠都在30℃以上就结晶,第2次循环放热时间超过了80min,相对较长,所以添加5.0%二水硫酸钙的五水硫代硫酸钠体系具有更优的蓄/放热性能.
2.2 增稠剂对 Na2S2O3·5H2O-CaSO4· 2H2O体系的影响
在二水硫酸钙添加量为 0.5%、5.0%的Na2S2O3·5H2O-CaSO4·2H2O体系中再添加2.0% (质量分数,以五水硫代硫酸钠的质量为基准计,余同)的增稠剂(CMC、活性白土、水溶性石蜡)后体系的步冷曲线如图3所示.
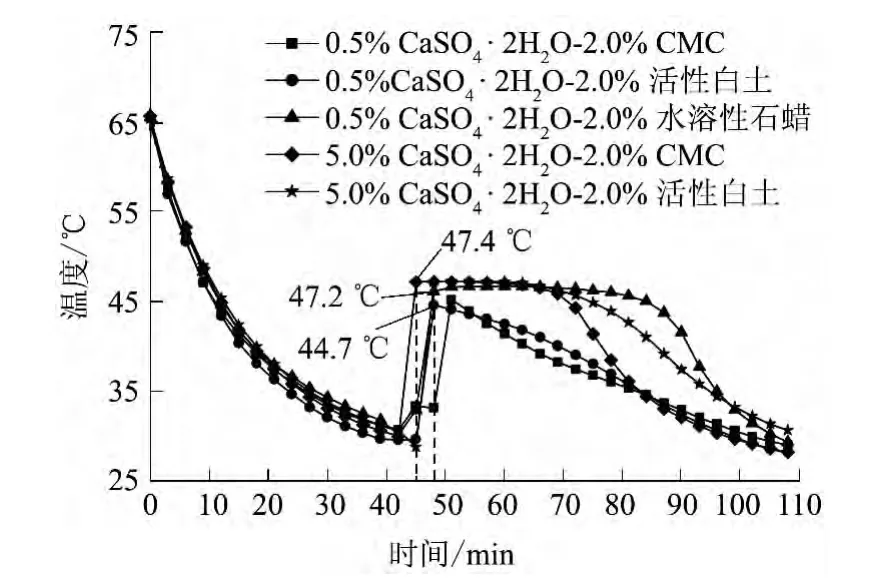
图3 Na2S2O3·5H2O-CaSO4·2H2O体系中添加不同增稠剂后的步冷曲线Fig.3 Cooling curves of Na2S2O3·5H2O-CaSO4·2H2O systems with different kinds of thickening agents
由图3可见:0.5%二水硫酸钙-2.0%水溶性石蜡、5.0%二水硫酸钙-2.0%CMC、5.0%二水硫酸钙-2.0%活性白土对应的体系开始结晶时温度即升到46~48℃,放热时间接近60min,并且放热温度在较长的时间内维持稳定;0.5%二水硫酸钙-2.0% CMC、0.5%二水硫酸钙-2.0%活性白土对应的体系没有出现稳定的放热温度.增稠剂添加量相同时,水溶性石蜡及活性白土的增稠效果优于CMC.添加增稠剂后,克服了体系相变过程的相分离现象,使结晶放热过程更加稳定,进一步改善了Na2S2O3·5H2OCaSO4·2H2O体系的放热性能.同时图中也反映出5.0%二水硫酸钙-2.0%CMC、5.0%二水硫酸钙-2.0%活性白土对应的体系具有更长、更稳定的放热过程,这再次说明了在五水硫代硫酸钠中添加5.0%二水硫酸钙的改性效果良好.
在二水硫酸钙添加量为5.0%的 Na2S2O3· 5H2O-CaSO4·2H2O体系中再添加不同量的活性白土后,各体系的步冷曲线如图4所示.
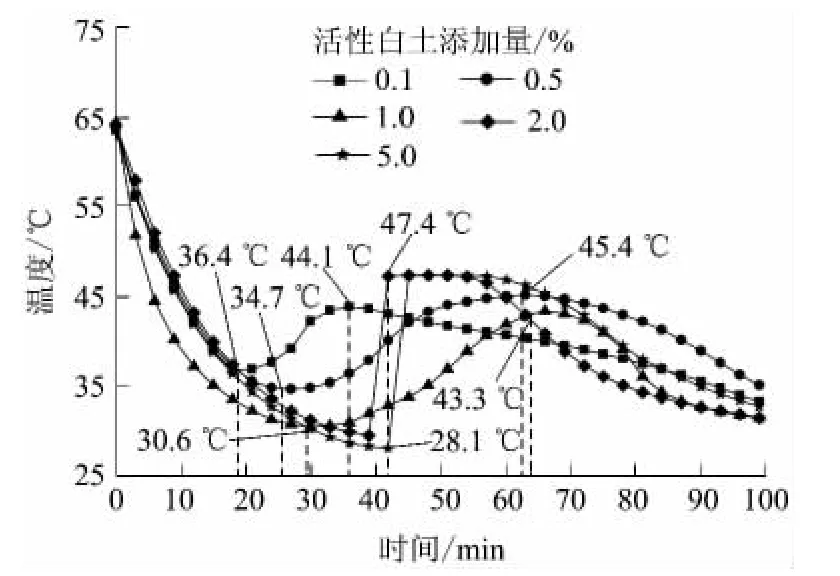
图4 Na2S2O3·5H2O-5.0%CaSO4·2H2O体系中添加不同量的活性白土后的步冷曲线Fig.4 Cooling curves of Na2S2O3·5H2O-5.0%CaSO4· 2H2O systems with different mass fractions of activated clay
由图4可见,在温度分别下降到36.4、34.7、30.6℃时,活性白土添加量为0.1%、0.5%和1.0%的体系开始结晶放热,放热过程中各体系温度最高可升至44.1、45.4和43.3℃,且放热过程持久,最长可达80min以上,虽然未出现稳定的结晶温度,但总体放热效果良好.活性白土添加量为2.0%和5.0%的体系在28.1℃才开始结晶,温度立刻升高至47.4℃,放热时间维持50~60 min.由此可见,添加活性白土和二水硫酸钙后的五水硫代硫酸钠体系在27℃以上均可完成结晶过程并放出所储存的热量,能很好地满足向室温环境放热的需求,特别适合于温棚及我国北方建筑的室内取暖.
在五水硫代硫酸钠中添加5.0%的二水硫酸钙和5.0%的活性白土对其进行改性,改性后的Na2S2O3·5H2O-5.0%CaSO4·2H2O-5.0%活性白土体系的DSC谱图如图5所示.
由图5可见,该体系的吸热峰开始于49.2℃,相变焓为158.9J/g,峰值温度为51.6℃.相变温度和纯五水硫代硫酸钠的理论相变温度值相差很小.由于添加了成核剂和增稠剂,使得其热焓(熔融焓近似等于相变焓)有所降低,但其相变焓值在相变蓄热材料中仍属较高的范围,是一种理想的建筑蓄热相变材料.
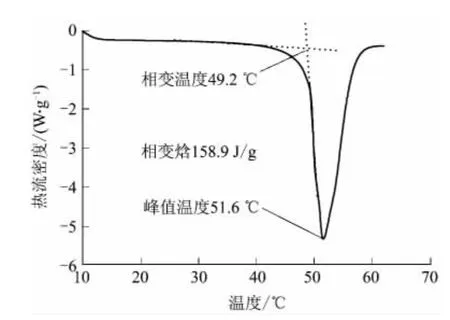
图5 Na2S2O3·5H2O-5.0%CaSO4·2H2O-5.0%活性白土体系的DSC谱图Fig.5 DSC spectrum of Na2S2O3·5H2O-5.0%CaSO4· 2H2O-5.0%activated clay system
2.3 萘酚改性五水硫代硫酸钠
添加不同量萘酚的Na2S2O3·5H2O-萘酚体系的步冷曲线如图6所示.
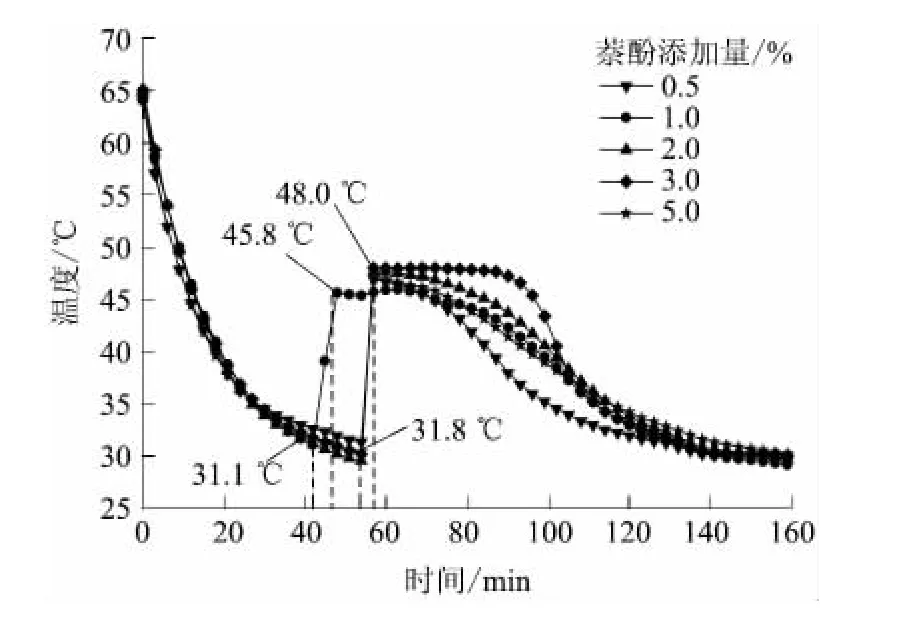
图6 Na2S2O3·5H2O-萘酚体系的步冷曲线Fig.6 Cooling curves of Na2S2O3·5H2O-naphthol systems
由图6可见:萘酚添加量为1.0%的体系,温度下降至31.1℃时开始结晶,且体系温度迅速升到45.8℃,该体系放热时间约为80min;萘酚添加量为3.0%的体系,温度下降至从31.8℃时开始结晶,且体系温度迅速升到48.0℃,该体系放热时间超过80min,并在48℃左右持续较长时间;其他几条曲线对应的体系没有出现稳定的结晶温度.由此可见,萘酚添加量为1.0%、3.0%时成核效果较好.
在萘酚添加量为0.5%、3.0%的 Na2S2O3· 5H2O-萘酚体系中分别加入2.0%的增稠剂(CMC、活性白土以及水溶性石蜡),在避光密封的条件下测定体系的步冷曲线,结果如图7所示.
由图7可见,加入增稠剂后,大多Na2S2O3· 5H2O-萘酚体系在室温条件下冷却时未出现结晶放热的现象,基本不能解决过冷问题,只有0.5%萘酚+2.0%CMC体系在冷却过程中存在结晶放热,且有稳定的结晶温度,放热时间可达50 min.这可能是由于增稠剂的存在影响了成核剂的成核能力,使结构受到了影响,导致成核能力减弱或基本抵消了成核能力.
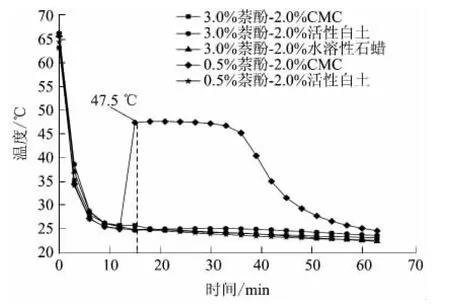
图7 Na2S2O3·5H2O-萘酚体系中添加不同增稠剂后的步冷曲线Fig.7 Cooling curves of Na2S2O3·5H2O-naphthol systems with different kinds of thickening agents
2.4 萘酚-氯化钠改性五水硫代硫酸钠
在五水硫代硫酸钠中添加0.5%萘酚和0.5%氯化钠,在密封避光条件下测定体系的步冷曲线,结果如图8所示.
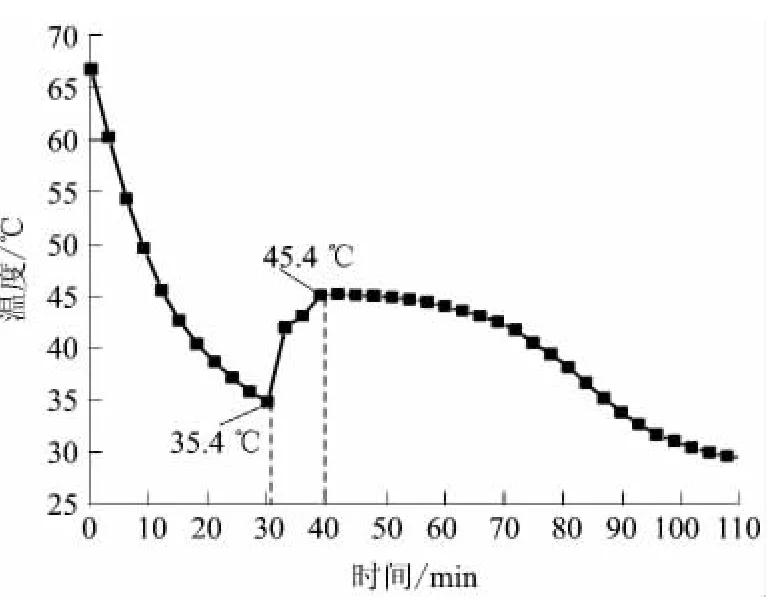
图8 Na2S2O3·5H2O-0.5%萘酚-0.5%NaCl的步冷曲线Fig.8 Cooling curve of Na2S2O3·5H2O-0.5%naphthol-0.5%NaCl
由图8可见,五水硫代硫酸钠中加入萘酚和氯化钠后,体系在温度下降到35.4℃时可自主结晶放热,温度逐渐升高到45.4℃,出现稳定结晶温度,放热时间超过70min,放热效果较好,其中氯化钠作为吸湿剂,可以促进结晶体的成核.通过多次蓄/放热循环后测定步冷曲线可对该体系的稳定性进行评价,其结果如表2所示.
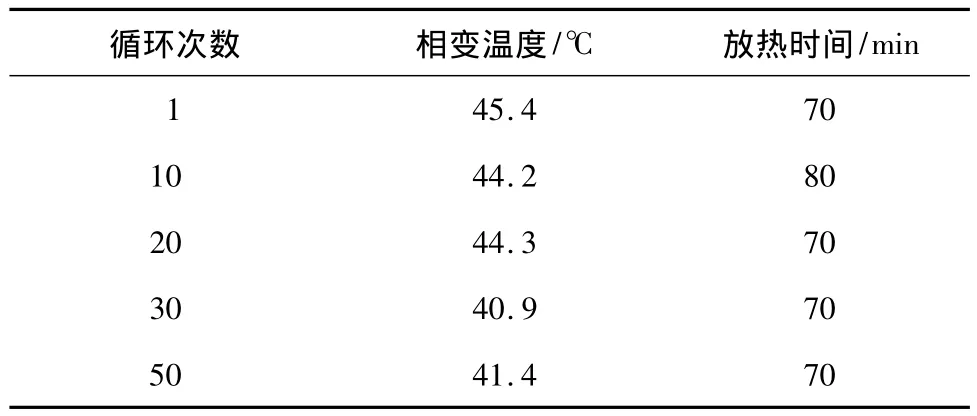
表2 Na2S2O3·5H2O-萘酚-NaCl体系的稳定性Table 2 Stability of Na2S2O3·5H2O-naphthol-NaCl systems
由表2可见,该体系经过不同次数吸热/放热循环后的相变温度在41~46℃之间变化,放热时间均可维持在70min以上,表明该体系具有良好的稳定性.
五水硫代硫酸钠中添加0.5%的萘酚和0.5%的NaCl对其进行改性,改性后的Na2S2O3·5H2O-0.5%萘酚-0.5%NaCl体系的DSC谱图如图9所示.
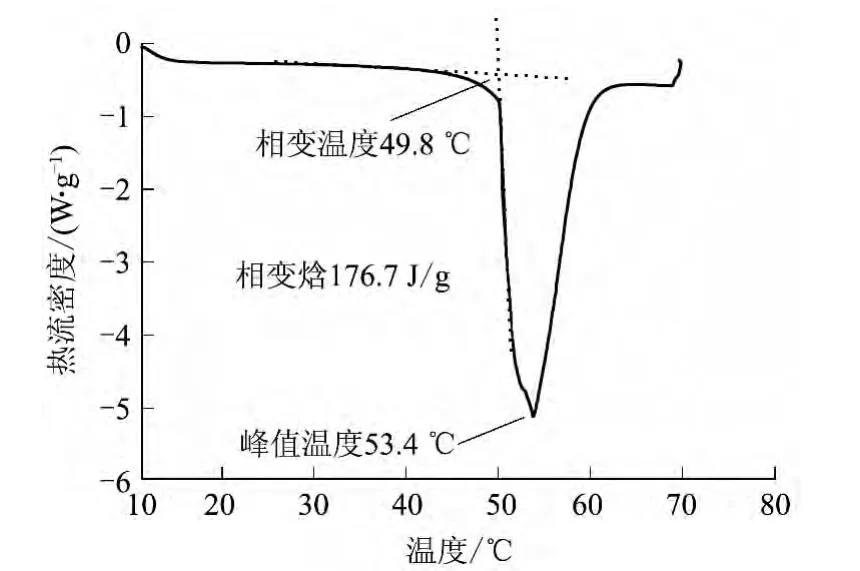
图9 Na2S2O3·5H2O-萘酚-NaCl体系的DSC谱图Fig.9 DSC spectrum of Na2S2O3·5H2O-naphthol-NaCl systems
由图9可见,Na2S2O3·5H2O-萘酚-NaCl体系的吸热峰起始温度为49.8℃,相变焓为176.7 J/g,峰值温度为53.4℃,适用于建筑蓄热采暖.萘酚的密度小于五水硫代硫酸钠,会浮于熔融体的上表层,很容易见光分解,DSC测试取样少,一般少于10mg,所以可能有一定的测试误差.在应用中要注意密封避光,防止因萘酚挥发而减弱成核能力.
3 结论
以CaSO4·2H2O、萘酚为成核剂,以CMC、活性白土、水溶性石蜡为增稠剂、NaCl为吸湿剂对Na2S2O3·5H2O进行改性,通过步冷曲线和DSC分析对改性的Na2S2O3·5H2O蓄/放热性能进行研究,得出以下结论:
(1)CaSO4·2H2O添加量为0.5%或5.0%时,Na2S2O3·5H2O的成核效果较好;对于Na2S2O3· 5H2O-0.5%CaSO4·2H2O体系或Na2S2O3·5H2O-5.0%CaSO4·2H2O体系,增稠剂用量相同时,水溶性石蜡及活性白土的增稠效果优于CMC.
(2)对于Na2S2O3·5H2O-5.0%CaSO4·2H2O体系,活性白土的用量在0.5%~5.0%之间时均有显著的改性效果,改性后体系最高放热温度在43~48℃之间变化,放热时间最长可达80 min以上;且改性Na2S2O3·5H2O体系均可在27℃以上完成结晶过程并释放热量,能很好地满足向室温环境放热的需求,特别适合于温棚及我国北方建筑的室内取暖.
(3)经5.0%CaSO4·2H2O-5.0%活性白土体系改性后的 Na2S2O3·5H2O的相变起始温度为49.2℃,相变焓为158.9J/g,峰值温度为51.6℃.
(4)萘酚用量在0.5% ~5.0%之间时,对Na2S2O3·5H2O均有较好的成核效果;在Na2S2O3· 5H2O-萘酚体系中加入增稠剂后,大多数体系不结晶放热,过冷效果无明显改善.
(5)经0.5%萘酚-0.5%NaCl体系改性后的Na2S2O3·5H2O具有良好的稳定性,经过不同次数的吸/放热循环后的相变温度在41~46℃之间变化,放热时间均可以维持在70 min以上;改性后的Na2S2O3·5H2O相变温度为 49.8℃,相变焓为176.7J/g.
[1] Hasnain S.M.Review on sustainable thermal energy storage technology(Part 1):heat storage materials and techniques[J].Energy Conversion and Management,1998,39(11):1127-1138.
[2] 张仁元,谢致薇,柯秀芳,等.相变材料与相变储能技术[M].北京:科学出版社,2009.
[3] Abhat A.Low temperature latent heat thermal energy storage:heat storage materials[J].Solar Energy,1983,30 (4):313-332.
[4] Farid M M,Khudhair A M,Siddique A K,et al.A review on phase change energy storage:materials and applications[J].Energy Conversion and Management,2004,45(9/ 10):1597-1615.
[5] 马江生.相变储热材料——Na2SO4·10H2O的研制[J].海湖盐与化工,1994,23(1):37-39.Ma Jiang-sheng.Development of phase change heat storage material:Na2SO4·10H2O[J].Salt and Chemical, 1994,23(1):37-39.
[6] 黄金,柯秀芳.无机水合盐相变材料 Na2SO4·10H2O的研究进展[J].材料导报,2008,22(3):63-67.Huang Jin,Ke Xiu-fang.Research and development of Na2SO4·10H2O as phase change materials[J].Materials Review,2008,22(3):63-67.
[7] 徐云龙,刘栋.六水氯化钙相变材料过冷性质的研究[J].材料工程,2006(S1):218-221.Xu Yun-long,Liu Dong.Preliminary supercooling research on calcium chloride hexahydrate as phase change material[J].Materials Engineering,2006(S1):218-221.
[8] 刘栋,徐云龙.成核剂对CaCl2·6H2O相变材料储热性能的影响[J].太阳能学报,2007,28(7):732-738.Liu Dong,Xu Yun-long.Thermoproperties research on nucleators-CaCl2·6H2O composites under distinctive systems[J].Acta Energiae Solaris Sinica,2007,28(7): 732-738.
[9] 唐钰成,郑瑞佩,王振国.三水合乙酸钠蓄热特性的研究[J].河北省科学院学报,1988(2):18-26.Tang Yu-cheng,Zheng Rui-pei,Wang Zhen-guo.Research of the sodium acetate trihydrate thermal properties[J].Journal of Hebei Academy of Sciences,1988(2):18-26.
[10] 石海民,梁德青,李栋梁.三水醋酸钠相变材料的相变性能研究[J].制冷学报,2009,30(2):8-11.Shi Hai-min,Liang De-qing,Li Dong-liang.Sodium acetate trihydrate phase change material properties of the phase transition[J].Journal of Refrigeration,2009,30 (2):8-11.
[11] 郎雪梅,叶菊招.三水合醋酸钠的相变贮热性能[J].材料开发与应用,2003,8(1):4-7.Lang Xue-mei,Ye Ju-zhao.Phase change property of sodium acetate trihydrate as heat storage material[J].Development and Application of Materials,2003,8(1):4-7.
[12] 童莉葛,尹少武,王立,等.三水醋酸钠混合相变体系的蓄热性能实验研究[C]∥第十届海峡两岸冷冻空调学会暨技术交流会论文集.[出版地不详]:中国制冷学会,2011:319-330.
[13] 李晶,刘忠良,马重芳.改善三水醋酸钠固液相变性能的实验研究[J].工程热物理学报,2006,27(5): 817-819.Li Jing,Liu Zhong-liang,Ma Chong-fang.Experimental study on improving solid-liquid phase change performance of acetate hydroxide trihydrate[J].Journal of Engineering Thermophysics,2006,27(5):817-819.
[14] 王智平,郭长华,王克振.三水醋酸钠相变材料的研究和发展趋势[J].材料导报,2010,24(8):60-63.Wang Zhi-ping,Guo Chang-hua,Wang Ke-zhen.Experimental study on heat storage performance of sodium acetate trihydrate as phase change material[J].Chemical Engineering,2010,24(8):60-63.
[15] 曲丰作,于长顺,王岩,等.三水合醋酸钠体系蓄放热性能的实验研究[J].大连轻工业学院学报,2005,24 (2):93-95.Qu Feng-zuo,Yu Chang-shun,Wang Yan,et al.Experimental study on heat storage-release property of trihydrol acetate sodium system[J].Journal of Dalian Institute of Light Industry,2005,24(2):93-95.
[16] Hiroshi K,Junjiro K.Phase change stability of sodium acetate trihydrate and its mixtures[J].Solar Energy,1985,35(6):527-534.
[17] Xing Jin,Mario A,Medina,et al.Phase-change characteristic analysis of partially melted sodium acetate trihydrate using DSC[J].International Journal of Thermophysics,2014,35(1):45-52.
[18] Lu Da-Jie,Hu Peng,Zhao Bin-Bin,et al.Study on the performance of nanoparticles as nucleating agents for sodium acetate trihydrate[J].Journal of Engineering Thermophysics,2012,33(8):1279-1282.
[19] Abrandstetter A.On the stability of calcium chloride hexahydrate in thermal storage systems[J].Solar Energy,1988,41(2):183-191.
[20] 鄢瑛,林小花,张会平.十二水磷酸氢二钠相变材料的改性研究[J].高校化学工程学报,2011,25(6): 1068-1073.Yan Ying,Lin Xiao-hua,Zhang Hui-ping.Modification of disodium hydrogen phosphate dodecahydrate phase change material[J].Journal of Chemical Engineering of Cheniese Universities,2011,25(6):1068-1073.
[21] 李艳,聂光华.五水硫代硫酸钠在防止CPU瞬时过热中的应用研究[J].电脑知识与技术,2006(17):150-151.Li Yan,Nie Guang-hua.Application study on sodium thiosulfate pentahydrate preventing CPU from overheating[J].Computer Knowledge and Technology,2006(17): 150-151.
[22] 李金.相变储热材料应用研究进展[J].北京联合大学学报:自然科学版,2005,19(3):74-77.Li Jin.Research advancement application of phase change heat storing materials[J].Journal of BeijingUnion University:Natural Sciences,2005,19(3):74-77.
[23] Ryu H W,Woo S W,Shin B C,et al.Prevention of supercooling and stabilization of inorganic salt hydrates as latent heat storage materials[J].Solar Energy Materials and Solar Cells,1992,27(2):161-172.
[24] 丁益民,阎立诚,薛俊慧.水合盐储热材料的成核作用[J].化学物理学报,1996,9(1):95-98.Ding Yi-min,Yan Li-cheng,Xue Jun-hui.Nueleation of salt-hydrates as the thermal energy storage material[J].Journal of Chemical Physics,1996,9(1):95-98.
