i-CHROMATMReader免疫荧光分析仪测定超敏C反应蛋白性能评价
2014-03-14金明超任春云
金明超,任春云,王 星
(浙江大学医学院附属第一医院,浙江杭州310003)
·仪器使用与排障·
i-CHROMATMReader免疫荧光分析仪测定超敏C反应蛋白性能评价
金明超,任春云,王 星
(浙江大学医学院附属第一医院,浙江杭州310003)
目的对i-CHROMATMReader免疫荧光分析仪检测超敏C反应蛋白(hypersensitive C-reactive protein,hs-CRP)的性能进行验证和评价。方法根据美国临床和实验室标准化协会(CLSI)标准,结合工作实际,设计实验方案,对韩国i-CHROMATMReader免疫荧光分析仪检测hs-CRP的检出限、精密度、准确度、线性、可比性、参考区间、加样量、干扰等主要分析性能进行验证和评价,将实验结果与厂商(韩国Boditech Med Inc公司)提供的分析性能进行比较。结果批内精密度(CV%)为3.90%~6.17%、批间精密度(CV%)为4.04%~5.56%,均在厂商承诺范围内;检出限为0.5mg/L,符合临床要求;准确度实验显示i-CHROMATMReader免疫荧光分析仪与Beckman-Coulter Immage免疫分析仪检测结果有较好的相关性;仪器对标本类型无特殊要求,全血与血清标本测定hs-CRP结果差异无统计学意义(P>0.05),有较好的可比性;20个结果均小于8mg/L,即大于8mg/L样本为0,可以引用厂商参考范围0.00~8.00mg/L;甘油三酯、胆红素对检测结果的影响在可接受的范围内,抗干扰能力符合要求。结论i-CHROMATMReader免疫荧光分析仪检测hs-CRP各项性能指标符合质量目标要求,同时它具有操作简便、检测迅速、精密度高、准确度好、线性范围广、抗干扰能力强等优点,值得推广应用。
i-CHROMATMReader;hs-CRP;性能评价
根据美国临床和实验室标准化协会(CLSI)相关标准,参照医学实验室质量和能力认可准则(CNAS-CL02)和医学实验室质量和能力认可准则在临床血液学检验领域的应用说明(CNASCL027),实验室在仪器投入使用前,应通过对分析系统的评价,验证其性能是否能达到设备说明书的性能要求。本科室近期引进一台韩国Boditech Med Inc公司i-CHROMATMReader免疫荧光分析仪,以免疫荧光定量测试和干化学层析技术为检测原理,可检测hs-CRP项目。为了保证检验结果的准确、可靠,根据CLSI的相关标准,自行设计实验方案,对该免疫荧光分析仪检测hs-CRP进行了性能评价,现总结如下。
1 材料与方法
1.1 标本来源选取本院门诊患者,采集静脉血。全血标本为EDTA-K2抗凝、血清标本为分离胶高速离心。干扰物:TG含量6.72mmol/L的乳糜标本;TBIL含量341μmol/L的黄疸标本,且干扰物自身hs-CRP浓度均<0.5mg/L。
1.2 仪器与试剂韩国Boditech Med Inc公司i-CHROMATMReader免疫荧光分析仪及配套hs-CRP试剂盒及质控品、校准品(批号2108CP,2109CP,2110CP;M209266);美国Beckman-Coulter Immage免疫分析仪及配套试剂盒及质控品、校准品(批号M202312,M202313;M209266)原理为速率散射比浊法,可溯源至WHO,IFCC,BCR-470内部方法标准化。BD一次性采血针及非可替真空采血管、定时器、Eppendorf移液器、生理盐水。
1.3 检测方法
1.3.1 检出限实验检出限(limit of detection,LoD)或检测低限(lower limit of detection,LLD)是指检测系统可检测的最低分析物浓度,按文献[1]介绍的方法,以缓冲液为空白样品,对空白样品进行20次检测,与厂商给出的LoD值进行比较。
1.3.2 精密度实验[1-3]
1.3.2.1 批内精密度实验选取同一批号试剂盒,选取hs-CRP低、中、高浓度三个水平病人新鲜全血各一份,每份重复测定20次,计算批内精密度,与厂商提供的性能参数相比较,判断其符合性。
1.3.2.2 批间精密度实验选取hs-CRP低、中、高浓度三个水平质控品,每天测定一次,连续测定20d,计算批间精密度,与厂商提供的性能参数相比较,判断其符合性。
1.3.3 准确度实验(方法学比对)[1,2,4]选取40份患者血清标本,hs-CRP浓度范围应覆盖临床可报告范围,并保证结果有50%落于参考区间之外。每天分别在i-CHROMATMReader免疫荧光分析仪以及Beckman-Coulter Immage免疫荧光分析仪检测8份标本,每份重复检测2次(检测顺序为1,2……8;8,7……1),连续检测5d,共收集40个患者标本,记录80对数据。对数据进行方法内离群值检验、数据作图,线性分析、方法间离群值检验、X值合适范围检验、线性回归。
1.3.4 线性实验[1,2,5]选取接近检出限低浓度标本(L)(本实验选用试剂盒缓冲液),另选取一份接近预期上线高值全血标本(H),按比例配制成5个不同浓度标本即1H,8H+2L,6H+4L,4H+6L,2H+8L (100%、80%、60%、40%、20%比例稀释),每个标本重复测定3次,计算均值。根据系列浓度测量值绘制y轴为所有浓度测定均值,x轴为理论值的图形,建立y=bx+a的回归方程,验证线性范围。
1.3.5 可比性实验(全血与血清)选取10份新鲜血标本,浓度范围覆盖仪器线性区间。用全血、血清分别在i-CHROMATMReader免疫荧光分析仪上检测这10份标本,每份重复检测两次,计算全血和血清在该免疫荧光分析仪的结果偏差百分比。
1.3.6 参考范围评估实验[1,2,6]选取20份新鲜血标本,男女比例为1:1,浓度范围在正常区间内(0.00~8.00mg/L),要求结果大于8mg/L的个数小于等于2个。
1.3.7 加样量实验选取低、中、高浓度的质控品,每种质控品分三组,每组实验样本量均为10μl样本和缓冲液的混合液。将三组混合液加到检测板上的量分别为1滴,2滴(对照组),3滴,验证其结果准确性。
1.3.8 干扰实验[1,2,7]分别将干扰物用生理盐水按100%、90%、80%……20%、10%、0%比例稀释成不同浓度的溶液,然后将不同浓度的干扰物溶液与待测血清按1:1混合,最后将混合液在i-CHROMATMReader免疫荧光分析仪上检测2次,结果取均值。根据影响度作为干扰实验评价指标。影响度=[(加入干扰物的全血测定值-未加入干扰物的全血测定值)/未加入干扰物的全血测定值]×100%。1.4统计学方法采用SPSS16.0软件进行统计分析。两组间比较采用配对t检验,以P<0.05为差异有统计学意义。
2 结果
2.1.1 检出限对空白样品进行20次检测,空白样品有18次结果小于0.5mg/L,2次检测结果大于0.5mg/L,根据文献,若超过LoD的测定值不超过3个,则给出的LoD值可用。
2.1.2 精密度批内精密度(CV%)为3.90%~6.17%、批间精密度(CV%)为4.04%~5.56%,详见表1。
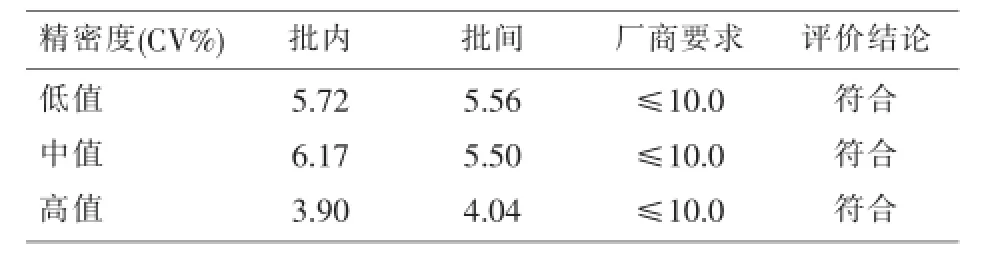
表1 不同浓度水平下hs-CRP批内、批间精密度(CV%)(n=20)
2.1.3 准确度(方法学比对)根据EP9-A2标准计算i-CHROMATMReader免疫荧光分析仪与Beckman-Coulter Immage免疫分析仪的2次检测数据组内和组间均无离群值。回归方程为y=0.9939x+ 0.8140(y:i-CHROMATMReader,x:Beckman-Coulter Immage),r2=0.9865。
2.1.4 线性回归方程为y=0.9873x-0.3595(y:理论值,x:实测值),r2=0.9963,临床可报告范围与厂商承诺范围(0.5~200mg/L)接近。
2.1.5 全血与血清可比性全血与血清标本在i-CHROMATMReader免疫荧光分析仪上测定hs-CRP结果差异无统计学意义(P>0.05),有较好的可比性。
2.1.6 参考范围20个结果均小于8mg/L,即大于8mg/L样本为0,可以引用厂商参考范围0.00~8.00mg/L。
2.1.7 加样量加1滴时,仪器报警或结果报>200mg/L。加3滴与2滴(对照组)结果无明显差异。2.1.8干扰将不同浓度的干扰物与待测全血等量1:1混合,加入干扰物浓度、测定值及影响度详见表2、表3。
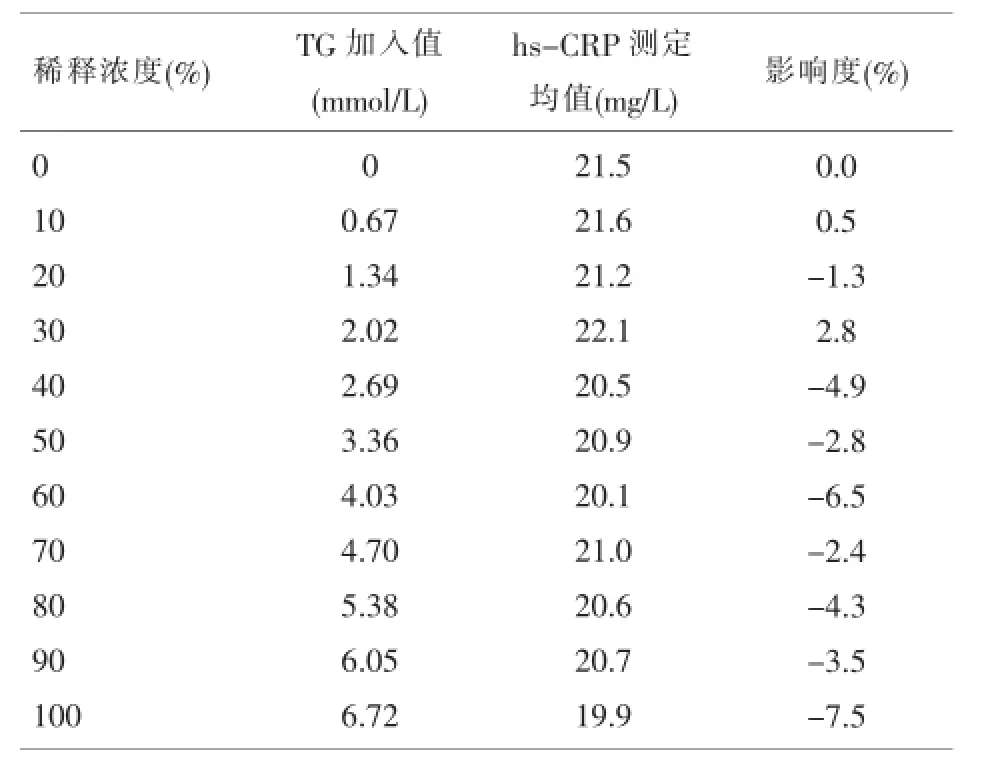
表2 TG对hs-CRP结果的干扰影响度
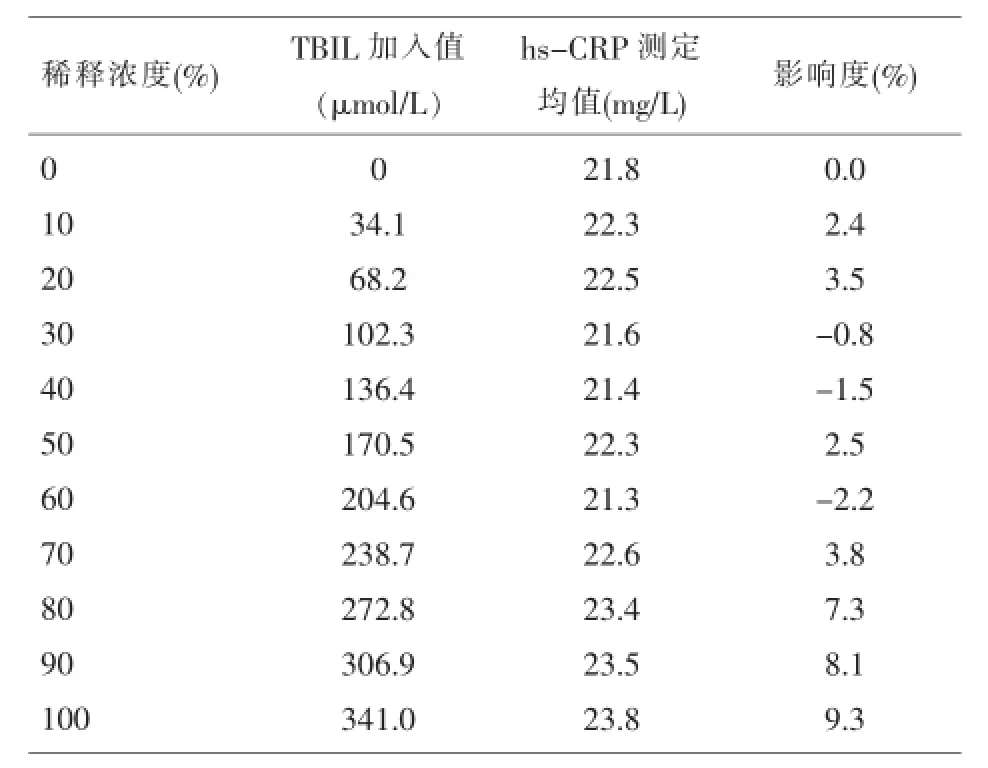
表3 TBIL对hs-CRP结果的干扰影响度
3 讨论
临床检验结果的质量直接关系到患者的诊断、治疗和预后,这就要求我们保证hs-CRP检测结果的准确、可靠。按照CAP及CNAS认可要求,对一个新的检测系统进行性能评价是必须的,这也是质量监控的前提。我们根据CLSI的相关标准,自行设计方案,对韩国i-CHROMATMReader免疫荧光分析仪检测hs-CRP的主要分析性能进行验证,结果显示该仪器检出限LoD为0.5mg/L;精密度(CV%)批内为3.90%~6.17%,批间为4.04%~5.56%,均在厂家声明范围内;方法学比对显示回归方程为y=0.9939x+0.8140,r2=0.9865,说明两种分析系统检测hs-CRP相关性较好、检测性能相当,经配对t检验(t=1.733,P>0.05)显示两种分析系统检测结果的差异无统计学意义;选取一份接近预期上线高值作系列稀释成5个不同浓度水平,用理论值和实测值作回归分析,回归方程为y= 0.9873x-0.3595,r2=0.9963,表明线性范围较好,且与厂家声明的临床可报告范围接近,经F检验(F= 1613,P<0.001),相关系数t检验(t=40.158,P<0.001)显示回归方程有统计学意义;对全血与血清10份样本t检验(P>0.05)显示全血与血清测定hs-CRP结果差异无统计学意义,说明该仪器对标本类型无明显要求,有较好的可比性。实验中发现应用血清检测比全血检测与Beckman-Coulter Immage相关性更好,可能为全血中有抗凝物质存在一定干扰,但测定结果的误差在临床可接受范围内;加样量显示加1滴时,仪器报警或者结果报>200mg/L,加3滴时,检测结果与2滴(对照组)无明显差异。即只要加到检测板上的量足够(75μl),对准确性无影响,量不够时,仪器会报警,需重做。脂血和黄疸标本对检测的影响度分别为-7.5%~2.8%和-2.2%~9.3%绝对值都小于10%,说明该仪器具有较强的抗干扰能力,干扰实验显示随干扰物浓度的增高对hs-CRP测定影响度也相应增加。
综上可见,韩国i-CHROMATMReader免疫荧光分析仪的主要分析性能指标符合质量目标要求,可用于临床检测。
[1]王治国.临床检验方法确认与性能验证[M].北京:人民卫生出版社,2009:246-253.
[2]冯仁丰.临床检验质量管理技术基础[M].第2版.上海:上海科学技术文献出版社,2008.
[3]CLSI.EP15-A User Demonstration of Performance for Precision and Accuracy[S].Wayne,PA:CLSI,2001.
[4]CLSI.EP9-A2 Method Comparison and Bias Estimation Using Patient Samp les[S].Wayne,PA:CLSI,2002.
[5]CLSI.EP6-A Evaluation of the Linearity of Quantitative Measurement Procedures[S].Wayne,PA:CLSI,2003.
[6]CLSI.C28-A2 How to Define and Reference Intervals in the Clinical Laboratory.CLSI,2000.
[7]邓芳梅,林晓文,李德发.i-CHROMATMREADER免疫荧光分析仪性能评价[J].临床输血与检验杂志,2010,12(2):107-109.
R446.62
A
1674-1129(2014)02-0227-03
10.3969/j.issn.1674-1129.2014.02.050
2013-10-22;收回日期2013-11-11)
