LIMK1在结肠癌中表达与沉默对人结肠癌细胞迁移与侵袭的影响
2014-03-13潘志兵向姝霖廖爱军
苏 坚,潘志兵,史 玲,向姝霖,夏 红,董 琳,廖爱军,苏 琦
(1.南华大学附属第二医院病理科湖南省胃癌研究中心,湖南衡阳421001;2.南华大学肿瘤研究所湖南省高校肿瘤细胞与分子病理学重点实验室;3.南华大学附属第一医院病理科)
结肠癌是世界上第三位最常见恶性肿瘤,据最新统计,全球每年新发病例120余万和近61万人死亡,且其发生率和死亡率有逐渐上升的趋势[1]。由于临床上患者就诊时大多已发生侵袭转移,治疗效果较差。因此,研究结肠癌迁移侵袭的机制和开发新一代有效低毒的抑制剂,对结肠癌的防治有重要意义。
研究证实,LIMK1在肿瘤中高表达,并通过调控肌动蛋白解聚因子ADF/Cofilin磷酸化与去磷酸化之间的平衡,影响actin细胞骨架结构,促进肿瘤细胞侵袭,而RNA干扰LIMK1基因可明显减少肿瘤细胞迁移侵袭。LIMK1经由上游信号分子介导调控的信号通路中处于中心地位,可能是有价值的靶点[2-4]。然而,有关LIMK1在人结肠癌表达以及对细胞迁移和侵袭的影响鲜有报道,本文就此做一研究。
1 材料与方法
1.1 细胞与试剂
人结肠癌SW480细胞株由本实验室保存。培养于含10% 胎牛血清的RPMI1640完全培养基中(Gibco公司)。在37℃、5%CO2饱和湿度温箱中培养,每2天传一代。小牛血清(杭州四季青生物工程公司),RPMI-1640培养基(Gibco公司)。Transwell小室(Corning公司),Matrigel(BD公司),Total RNA Kit(Omega公司),RT reagent kit(TaKaRa公司),PCR试剂盒(Promega公司)。BCA蛋白定量检测试剂盒(Pierce公司),ECL发光检测试剂盒和免疫组化试剂盒(北京中杉金桥生物技术有限公司),LIMK1(ab39641),Phospho LIMK1(ab131341)和β-actin兔多克隆抗体(Abcam公司)。
1.2 结肠癌标本与免疫组化染色
本院手术切除的结肠癌标本87例,其中,<50岁38例,≥50岁49例;肿块直径52例≥5 cm,35例<5 cm;高分化腺癌10例,中分化腺癌47例,低分化腺癌30例;淋巴结转移45例,无转移42例;Dukes A+B期41例,C+D期46例。SP试剂盒、DAB显色剂、0.1 mol/L PBS、0.01 mol/L柠檬酸盐抗原修复液、EDTA修复液均购自福州迈新生物技术公司,按试剂盒说明进行。结果判定:LIMK1阳性表达为棕黄或棕褐色,定位于胞浆或胞核。根据阳性细胞染色程度及着色细胞百分率记分:0分不着色,1分浅棕色,2分深棕色;着色细胞<5%为0分,5% ~25%为1分,26% ~50%为2分,>50%为3分。两种分值相加,1分为(-),2分为弱阳性(+),3分为阳性(++);>4分为强阳性(+++)。
1.3 建立稳定低表达LIMK1基因的人结肠癌SW480细胞
1.3.1 重组质粒的构建与鉴定 LIMK1-microRNA重组质粒pcDNATM6.2-GW/EmGFPmiR由Invitrogen公司构建和鉴定(共构建了4个,分别为pcDNA6.2/LIMK1-miRNA 1、2、3、4)。 根据分子克隆提供的操作步骤进行转化细菌,挑选阳性转化细菌,抽提质粒,并经公司测序鉴定正确后用于实验。质粒的抽提按照质粒抽提试剂盒说明书进行。
1.3.2 建立稳定低表达LIMK1基因的人结肠癌SW480细胞 取对数生长期的SW480细胞,调整细胞至1×105/mL,取0.5 mL接种于24孔板,37℃培养至细胞贴壁覆盖率达70%~90%时进行转染。无血清培养基清洗细胞2~3次后再换opti-MEM培养基洗2~3次,加 400 μL无血清opti-MEM培养基,继续培养。加入0.8 μg重组质粒(pcDNA6.2/LIMK1-miRNA)于无血清opti-MEM培养基中,设立空载体对照组(Vector),各组终体积为50 μL。将2 μL LipofectamineTM2 000 加入到48 μL 无血清 opti-MEM中并充分混匀,37℃孵育3~5 min。滴入上述混合物于细胞,充分混匀,培养6 h后,更换为10%胎牛opti-MEM培养液。48 h后,以1∶10比例传代。调整细胞浓度至10/mL,以100 μL/孔接种于96孔板。24 h后,观察并在培养板上标注有单个细胞的培养孔。确定最佳杀稻瘟菌素的筛选浓度为4 mg/L。加药后筛选阳性细胞单克隆,每隔3天换液并加药,筛选4周后可见有抗性的单克隆出现,免疫荧光显微镜观察。将阳性单克隆细胞扩大培养,依次转入24、6孔板及培养瓶并冻存细胞。RT-PCR与Western Blot鉴定阳性克隆LIMK1干扰效果。
1.4 划痕愈合实验
调整细胞为1×106/mL,吸1 mL细胞悬液接种于6孔板,加无血清DMEM培养6 h,使细胞呈单层贴壁生长状态。用10 μL Eppendorf Tip在细胞板上划痕,无血清培养液洗3次,加新鲜的无血清培养基。实验分SW480细胞组、空载体组、LIMK1-miR组。37℃、5%CO2培养箱中培养24 h。按0、24 h取样、拍照,用Image-Pro Plus 6.0软件测量划痕距离,计算平均值与标准差。细胞迁移率计算:迁移率(%)=(原划痕宽度-现划痕宽度)/原划痕宽度×100%。实验重复3次。
1.5 Transwell侵袭实验
采用孔径8.0 μm的24孔Transwell小室。实验分组同上。准备基质胶,将冻存于-80℃冰箱的matrigel 4℃过夜,变成液态;无血清培养基以1∶9稀释,吸50 μL 均匀铺到Transwell上室,37°C 过夜,当出现“白色层”时,在上室中加入100 μL预温的无血清的DMEM培养基,孵育30 min,使基质胶再水化,吸去剩余培养液,消化细胞,无血清培养基洗3次,调整细胞为1×106个/mL;取细胞悬液100 μL加入上室,下室加500 μL完全培养基;37℃、5%CO2孵育24 h,弃培养基,擦拭上室细胞;取出transwell用PBS洗2次,4%多聚甲醛固定细胞10 min,倒置,风干;加0.1%结晶紫染色20 min,PBS洗3次,擦净上室细胞;倒置显微镜下随机计数10个视野的细胞,取均数。每组设3个复孔,实验重复3次。侵袭抑制率(%)=(对照组穿膜细胞-处理组穿膜细胞)/对照组穿膜细数×100%。
1.6 RT-PCR
用Total RNA Kit提取组织总RNA,按试剂盒说明书进行操作。在AMV酶的作用下逆转录合成cDNA。LIMK1及 β-actin引物由上海生工合成。LIMK1:F5′-GGG GCA TCA TCA AGA GCA-3′,R5′-GAG GAC TAG GGT GGT TCA G-3′,扩增长度为138 bp;β-actin:F5′-ACA CTG TGC CCA TCT ACG AGG GG-3′,R5′-ATG ATG GAG TTG AAG GTA GTT TCG TGG AT-3′,扩增长度为367 bp。 LIMK1反应条件:94℃ 5 min;然后94℃ 30 s,52.3℃ 30 s,72℃1 min进行35个循环;72℃ 10 min。β-actin反应条件:94℃ 5 min;然后94℃ 30 s,55.0℃ 30 s,72℃1 min进行35个循环;72℃ 10 min。PCR产物用2%琼脂糖凝胶电泳,溴化乙锭染色,BIO-RAD凝胶成像系统拍照,AlphaImager 2200软件进行扫描,以相对光密度代表基因表达丰度,以LIMK1表达丰度/β-actin表达丰度计算平均光密度值。实验重复3次。
1.7 Western blot检测
收集细胞,预冷PBS洗3次,吸尽残留液后,加入适量体积裂解液(100 mmol/L NaCl,10 mmol/L Tris-Hcl pH7.6,1 mmol/L EDTA pH 8.0,1 μg/mL Aprotinin,100 μg/mL PMSF),冰上裂解 1h,刮下后转移至EP管中,12 000×g 4℃离心30 min,吸取上清液,即为细胞总蛋白。BCA法进行蛋白浓度测定。调节样品浓度,以每孔30 μg蛋白加样,加入等体积2×SDS加样缓冲液,煮沸5 min,SDS-PAGE胶电泳;电泳分离后的蛋白电转至PVDF膜上;脱脂牛奶封闭PVDF膜1 h;加一抗4℃孵育过夜,TBST洗3次,每次15 min;羊抗兔Ⅱ抗,37°C孵育1 h,TBST洗3次,每次15 min;用ECL发光法检测蛋白表达状况,图像分析软件AlphaImager 2 200测定印迹区带的光密度。实验重复3次。
1.8 统计学处理
采用SPSS 13.0软件One-Way Anova或t检验进行统计学处理,不同组间的比较采用χ2检验,P<0.05为有统计学意义。
2 结 果
2.1 LIMK1蛋白表达与结肠癌临床病理的关系
图1和表1显示,LIMK1在结肠癌组织阳性表达(75.86%)明显高于结肠正常组织(P<0.05);高分化腺癌表达(40.00%)明显低于中分化(70.21%)与低分化腺癌(96.67%)(P<0.05),而低分化高于中分化腺癌(P<0.05);<50岁与≥50岁患者表达差异无统计学意义(P>0.05);肿瘤直径<5.0 cm的结肠癌表达(57.14%)明显低于≥5.0 cm(88.46%)(P<0.05);淋巴结转移组表达(97.78%)显著高于无转移的(52.38%)(P<0.05);Dukes分期A+B组表达(60.98%)明显低于C+D组(89.13%)(P<0.05)。表明LIMK1表达与患者年龄无关,而与肿瘤发生、大小、淋巴结转移及Dukes分期有关。
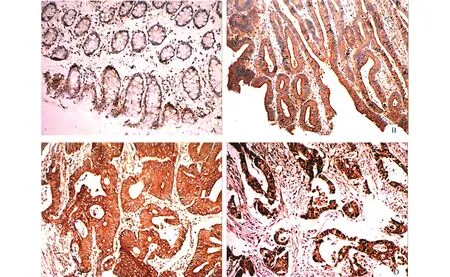
图1 LIMK1蛋白在结肠癌组织中表达(SP×10)
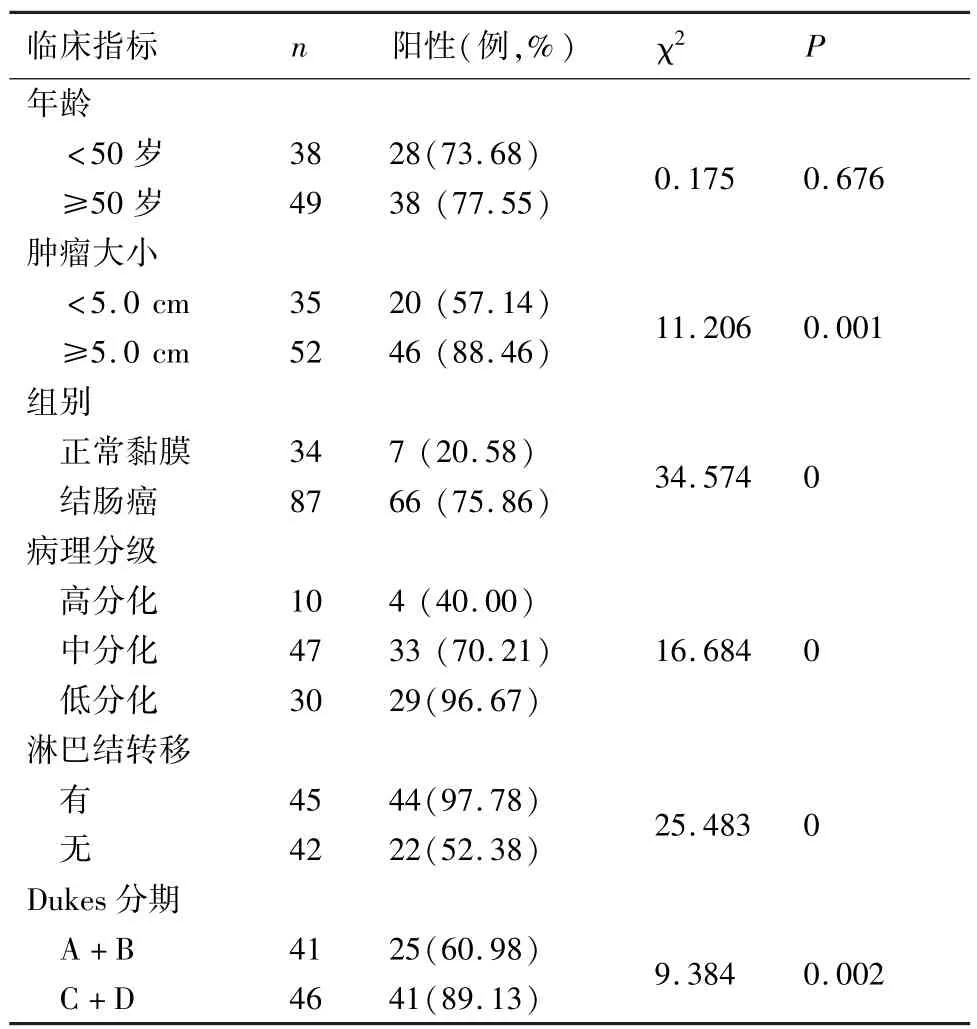
表1 LIMK1蛋白表达与临床病理的关系
2.2 沉默LIMK1基因pcDNA6.2/LIMK1-miRNA/SW480细胞的建立和鉴定
构建的LIMK1基因干扰质粒(pcDNATM6.2-GW/EmGFP-LIMK1-miRNA1、 miRNA2、 miRNA3、miRNA4)在脂质体的介导下转染SW480细胞,可见大量绿色荧光表达,表明LIMK1基因干扰质粒已成功转染入细胞中(图2A)。
图2B所示,各组总RNA可见较明显的28S、18S带。 RT-PCR 检测显示,LIMK1-miR1、-miR2、-miR3和-miR4各组较未转染组与空载体组LIMK1 mRNA表达明显下调,而LIMK1-miR1组干扰效率可达90%以上(图2C)。Western blot检测也显示,LIMK1-miR1、-miR2、-miR3和-miR4 各组较未转染组与空载体组 LIMK1蛋白表达显著降低,且以LIMK1-miR1干扰组效果最明显,与RT-PCR结果一致(图 2D)。因此,选取 LIMK1-miR1作为后续研究。

图2 稳定低表达LIMK1基因SW480细胞系的建立和鉴定
2.3 沉默LIMK1对SW480细胞LIMK1和p-LIMK1蛋白表达的影响
图3A显示,沉默组LIMK1和p-LIMK1蛋白表达较未转染组与空载体组明显下调(P<0.05)。免疫细胞化学检测证实,沉默组LIMK1蛋白表达较未转染组与空载体组明显降低(图3B)。表明沉默LIMK1可明显下调SW480细胞LIMK1蛋白表达和抑制LIMK1蛋白磷酸化。
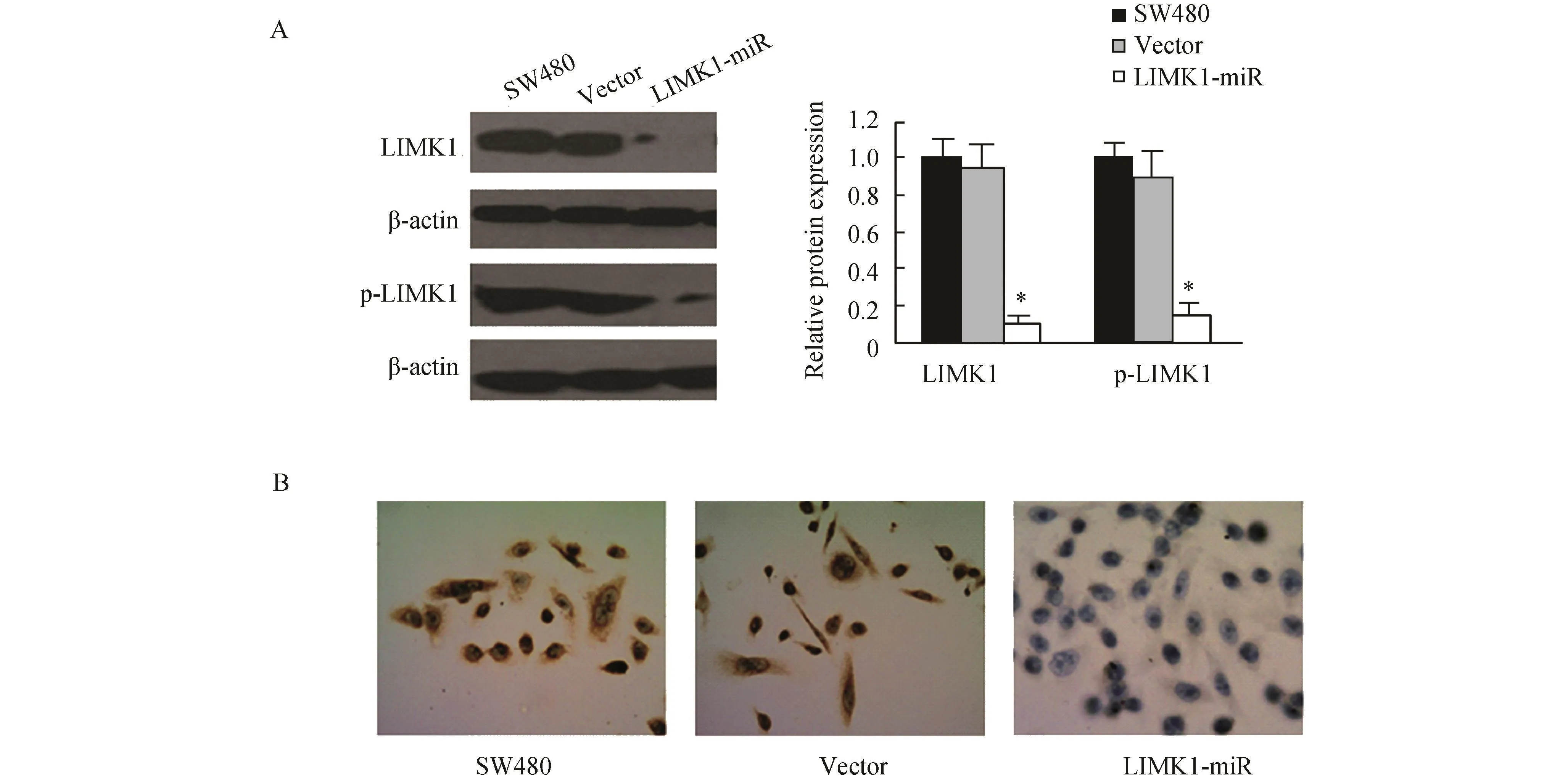
图3 沉默LIMK1对SW480细胞LIMK1与p-LIMK1蛋白的表达影响
2.4 LIMK1基因沉默对SW480细胞迁移的影响
图4显示,对照组、空载体组与LIMK1沉默组在0 h时,划痕距离分别为 190.90±0.57 μm、195.20 ±0.30 μm 与 195.30 ±0.22 μm,差异无显著性(P>0.05)。24 h后,LIMK1沉默组划痕距离151.1±12.1 μm 较对照组44.6±17.28 μm 与空载体组 54.30±8.38 μm明显增宽,细胞迁移率(22.53%)较对照组(76.50%)与空载体组(72.14%)明显降低(P<0.05)。表明沉默LIMK1基因可抑制SW480细胞迁移能力。

图4 沉默LIMK1基因对SW480细胞迁移的影响(×10)
2.5 LIMK1基因沉默对SW480细胞侵袭的影响
侵袭实验结果显示,沉默LIMK1组穿膜细胞(43.67±1.51个)较未处理组(143.33±1.52个)与空载体组(136.34±1.53个)明显减少(P<0.05);未处理组与空载体组差异无统计学意义(P>0.05)(图5)。表明沉默LIMK1基因可抑制SW480细胞侵袭能力。

图5 沉默LIMK1基因对SW480细胞侵袭的影响(×20)
3 讨 论
肿瘤转移的关键因素是肿瘤细胞获得迁移和侵袭能力,靶向抑制肿瘤细胞迁移侵袭过程的基因为治疗肿瘤提供了新思路。大量研究证实,细胞迁移是由细胞伪足启动的高度整合的多阶段过程。迁移和侵袭的细胞形成的伪足结构取决于其形态、结构与功能特征,这些结构的形成由时空调控的肌动蛋白聚合作用所驱动。actin细胞骨架重组是肿瘤细胞迁移、粘附和侵袭的基本,有众多分子参与了肌动蛋白聚合与解聚的调节,其中,LIMK基因就是一个重要的分子[5-8]。
LIMK在肿瘤迁移侵袭过程中发挥重要作用,其通过对ADF/cofilin磷酸化与去磷酸化的平衡进行调节而影响肌动蛋白细胞骨架结构,促使肿瘤细胞发生迁移和侵袭。这个过程主要受Rac1-ROCK/PAK-LIMKADF/Cofilin通路调控,而LIMK位于这一精细调控信号通路的中心,因此,LIMK可能是开发肿瘤侵袭和转移新的治疗药物的候选靶点[2,5]。LIMK1磷酸化可灭活Cofilin/ADF,RNA干扰LIMK1表达可明显减少鼠腹水肝细胞癌MM1细胞迁移,提示LIMK1介导cofilin/ADF磷酸化和去磷酸化与肿瘤细胞迁移与侵袭有关[5]。采用CDK抑制剂p57(kip2)可通过LIMK/cofilin途径抑制鼻咽癌细胞迁移侵袭,而沉默p57(kip2)则可促进迁移侵袭[9]。LIMK1在乳腺癌MDA-MB-435细胞高表达可促进细胞增殖和侵袭,上调uPA和uPAR表达,增加裸鼠移植瘤生长,促进肿瘤血管形成,诱导肝、肺转移[10]。沉默LIMK1基因或LIMK1抑制剂可降低cofilin磷酸化,抑制乳腺癌等肿瘤细胞侵袭转移[3,4,11]。LIMK1高表达可促进耐药的骨肉瘤MG63/VCR细胞侵袭转移,而沉默LIMK1基因能够废除MG63/VCR细胞侵袭能力[12]。Chhavi等[13]发现宫颈癌LIMK1表达较正常组织与CIN高4.6与3.0倍。LIMK1表达与子宫颈癌侵袭呈明显正相关,而与生存率呈负相关。免疫组化检测发现,LIMK1在76%乳腺癌胞浆高表达,同时伴有52%核内表达,而正常乳腺组织仅有48%胞浆与27%胞核表达,并且,LIMK1可促进MDA-MB-231细胞侵袭与裸鼠移植瘤肿瘤生长[14]。
本研究显示,LIMK1在结肠癌中表达明显高于结肠正常组织,高分化腺癌LIMK1表达明显低于中分化与低分化腺癌,而中分化显著低于低分化腺癌;直径<5.0 cm、淋巴结转移和Dukes分期C+D组结肠癌LIMK1表达分别明显高于≥5.0 cm、无淋巴结转移和A+B组,表明LIMK1表达与结肠癌的发生、分化程度、肿瘤大小、淋巴结转移、临床分期密切相关。并且,沉默LIMK1基因后,发现LIMK1和p-LIMK1蛋白表达明显下调,迁移与侵袭能力显著下降。表明沉默LIMK1基因可明显抑制SW480细胞迁移和侵袭能力,LIMK1可能是导致结肠癌侵袭转移的重要分子。
近年来,研究发现二烯丙基二硫(DADS)具有明显抑制人结肠癌细胞增殖的作用[15-17],并可通过阻断 Rac1-ROCK/PAK-LIMK-ADF/Cofilin信号通路,下调LIMK1抑制SW480细胞迁移与侵袭[18-19]。上述研究给予一个重要提示,靶向抑制LIMK1的药物将可能成为治疗结肠癌的新策略。
[1] Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[2] Manetti F.Recent findings confirm LIM domain kinases as emerging target candidates for cancer therapy[J].Curr Cancer Drug Targets,2012,12(5):543-560.
[3] Scott RW,Hooper S,Crighton D,et al.LIM kinases are required for invasive path generation by tumor and tumor-associated stromal cells[J].J Cell Biol,2010,191(1):169-185.
[4] Crighton D,Olson MF.Trailblazing LIM kinases take the lead in collective tumor cell invasion[J].Bioarchitectur,2011,1(1):5-8.
[5] Horita Y,Ohashi K,Mukai M,et al.Suppression of the invasive capacity of rat ascites hepatoma cells by knockdown of Slingshot or LIM kinase[J].J Biol Chem,2008,283(10):6013-6021.
[6] Bernard O.Lim kinases,regulators of actin dynamics[J].Int J Biochem Cell Biol,2007,39(6):1071-1076.
[7] Yamaguchi H,Condeelis J.Regulation of the actin cytoskeleton in cancer cell migration and invasion[J].Biochim Biophys Acta,2007,1773(5):642-652.
[8] Delorme V,Machacek M,DerMardirossian C,et al.Cofilin activity downstream of Pak1 regulates cell protrusion efficiency by organizing lamellipodium and lamella actin networks[J].Dev Cell,2007,13(5):646-662.
[9] Chow SE,Wang JS,Lin MR,et al.Downregulation of p57kip2promotes cell invasion via LIMK/cofilin pathway in human nasopharyngeal carcinoma cells[J].J Cell Biochem,2011,112(11):3459-3468.
[10] Bagheri-Yarmand R,Mazumdar A,Sahin AA,et al.LIM kinase 1 increases tumor metastasis of human breast cancer cells via regulation of the urokinase-type plasminogen activator system[J].Int J Cancer,2006,118(11):2703-2710.
[11] Li R,Doherty J,Antonipillai J,et al.LIM kinase inhibition reduces breast cancer growth and invasiveness but systemic inhibition does not reduce metastasis in mice[J].Clin Exp Metastasis,2013,30(4):483-495.
[12] Zhang H,Wang Y,Xing F,et al.Overexpression of LIMK1 promotes migration ability of multidrug-resistant osteosarcoma cells[J].Oncol Res,2011,19(10-11):501-509.
[13] Chhavi,Saxena M,Singh S,et al.Expression profiling of G2/M phase regulatory proteins in normal,premalignant and malignant uterine cervix and their correlation with survival of patients[J].J Cancer Res Ther,2010,6(2):167-171.
[14] McConnell BV,Koto K,Gutierrez-Hartmann A.Nuclear and cytoplasmic LIMK1 enhances human breast cancer progression[J].Mol Cancer,2011,10:75.
[15] Liao QJ,Su J,Zhou XT,et al.Inhibitory effect of diallyl disulfide on proliferation of human colon cancer cell line SW480 in nude mice[J].Ai Zheng,2007,26(8):828-832.
[16] Liao QJ,Su J,He J,et al.Effect of diallyl disulfide on cell cycle arrest of human colon cancer sw480 cells[J].Ai Zheng,2009,27(2):168-172.
[17] Huang YS,Xie N,Su Q,et al.Diallyl disulfide inhibits the proliferation of HT-29 human colon cancer cells by inducing differentially expressed genes[J].Mol Med Report,2011,4(3):553-559.
[18] 史玲,苏坚,廖前进,等.二烯丙基二硫下调LIMK1抑制人结肠癌SW480细胞迁移与侵袭[J].中国药理学通报,2011,28(2):200-205.
[19] Zhou Y,Su J,Shi L,et al.DADS downregulates the Rac1-ROCK1/PAK1-LIMK1-ADF/cofilin signaling pathway,inhibiting cell migration and invasion[J].Oncol Rep,2013,29(2):605-612.
