吉林地区仔猪水肿病病原分离与鉴定
2014-03-11呼显生付连军陈国良唐宝智刘丽敏
呼显生,付连军,陈国良,唐宝智,刘丽敏
(1.吉林农业科技学院动医学院,吉林 吉林132101;2.吉林省东辽县动物疫病预防控制中心,吉林 东辽136600;3.吉林省抚松县农业技术推广站,吉林 抚松134500;4.吉林省抚松县兴参镇农业科技站,吉林 抚松134523)
本试验对来自吉林地区发生仔猪水肿病猪场的典型发病仔猪,在无菌条件下采集仔猪的小肠黏膜刮取物及相应肠段、肠系膜淋巴结。然后进行细菌的分离培养、形态与染色、生化特性等鉴定试验,并进行血清型鉴定及毒力测定试验。
1 材料
1.1 病料 吉林地区不同的猪场中发病仔猪典型死亡病例21头,实验室解剖检,在无菌条件下采集仔猪的小肠黏膜刮取物及相应肠段、肠系膜淋结。
1.2 培养基 营养肉汤、血琼脂平板培养基、麦康凯琼脂平板培养基、营养琼脂平板培养基、营养琼脂斜面等,均按常规方法配制。
1.3 微量发酵管 由吉林农业科技学院微生物学实验室提供。
1.4 主要仪器 奥林帕斯显微镜(日本制造)、电子恒温水浴锅(天津泰斯特电子有限公司制造)、振荡培养箱等。
1.5 大肠杆菌O因子血清(O1-O163),均购自中国兽医药品监察所。
1.6 实验动物 昆明系小鼠体重16 g~18 g,购自长春生物制品研究所。断奶仔猪由各地区种畜场提供,共计30头仔猪,日龄40~45日龄,临床健康,无注射仔猪水肿病疫苗史的仔猪。
2方法
2.1 病原菌分离及纯粹性检验
2.1.1 病原菌分离 在无菌条件下采集仔猪的小肠黏膜刮取物及相应肠段肠系膜淋巴结,分别接种血琼脂平板培养基、麦康凯琼脂平板培养基,37℃培养18 h~24 h。挑取在麦康凯琼脂平板培养基上呈红色菌落和在血琼脂平板培养基呈溶血的典型菌落,分别转接于三糖铁培养基和营养琼脂斜面培养基,做初步纯培养及生化鉴定。将在三糖铁培养基反应模式符合埃希氏菌属菌株进行编号备用。
2.1.2 纯粹性检验 将编号菌株分别接种于适量营养肉汤中,37℃培养18 h~24 h。取液体培养物划线接种营养琼脂平板培养基,37℃培养18 h~24 h,挑取各菌株典型单个菌落用营养肉汤适当稀释,分别均匀涂布于血琼脂平板培养基、麦康凯琼脂平板培养基、营养琼脂平板培养基。每个菌株接种两板,37℃培养18 h~24 h,观察结果。另取一个相同菌落接种营养琼脂斜面培养基作为种子菌株,用适量生理盐水洗下,分离到离心管中,加入50%甘油放置于-70℃低温冰柜中保存。
2.2 病原菌形态及培养特性观察 将接种营养琼脂斜面培养基作为种子菌株,分别接种适量营养肉汤,37℃培养18 h~24 h,并划线接种血琼脂平板培养基、麦康凯琼脂平板培养基、营养琼脂平板培养基,37℃培养18 h~24 h,观察病原菌培养特性,并分别进行革兰染色,显微镜观察结果。
2.3 病原菌生化特性鉴定
2.3.1 糖发酵试验 取各菌株纯培养物,分别接种葡萄糖、乳糖、麦芽糖、甘露糖、蔗糖等微量发酵管中,各两支,37℃培养24 h~48 h,观察并记录结果。2.3.2 M.R./VP试验 取各菌株纯培养物,分别接种葡萄糖蛋白胨培养基两支微量发酵管中,37℃培养48 h,一支滴加M.R.指示剂5~6滴,立即观察;另一支按每2mL滴加0.2mL欧-波二氏试剂,轻摇试管,观察并记录结果。
2.4 血清型鉴定
2.4.1 玻片凝集抗原的制备取纯培养物 分别接种10mL营养肉汤,37℃培养20 h~24 h,划线接种营养琼脂平板培养基,37℃培养20 h~24 h,用适量无菌生理盐水制成浓菌液,经121℃高温处理2 h,冷却后备用。
2.4.2 血清型鉴定 分别将血清用灭菌生理盐水作5×、10×稀释备用。取0.01mL抗O单因子血清滴加到玻片上,在对应玻片滴加0.01mL供试菌株抗原,混匀后静置。以O1-O163菌株作阳性对照,以生理盐水作阴性对照,观察结果。
2.5 病原性鉴定
2.5.1 菌液制备 将菌株分别接种20mL营养肉汤中,37℃振荡培养18 h~24 h,测定菌数。并将各地区菌株按一定比例配成混合菌液。
2.5.2 菌株致病性鉴定 将通过上述方法制备的菌液进行适当稀释后(分别取原液0.05、0.1、0.2 mL,用生理盐水稀释到0.2mL),0.2mL/只,腹腔注射小鼠,每组5只,记录发病和死亡情况。将菌液进行适当稀释后(分别取原液0.1、0.2、0.4、0.6mL,用生理盐水稀释到1mL),1mL/头,肌肉注射断奶仔猪,每组3头,记录发病和死亡情况。
3结果
3.1 病原菌分离结果 从吉林地区不同猪场典型发病仔猪死亡21头病料中,分离出病原菌8株。
3.2 纯粹性检验结果 经培养后,观察,在营养琼脂平板、麦康凯琼脂平板、血琼脂平板培养基培养,菌落均为整齐的单一菌落。
3.3 病原菌形态及培养特性观察结果 经培养后,观察,在营养琼脂平板菌落形态为中等大小菌落,呈半透明灰白色;麦康凯琼脂平板为红色中等大小菌落;血琼脂平板明显溶血;营养肉汤均匀浑浊,管底有沉淀。染色特性为革兰阴性中等大小杆菌。
3.4 菌株生化特性结果 见表1。

表1 菌株生化特性
3.5 菌株血清型鉴定结果 用O139阳性菌株作阳性对照,生理盐水作阴性对照成立条件下,各菌株血清型,结果见表2。表2菌株血清型鉴定结果见表2。

表2菌株血清型鉴定
3.6 菌数测定结果 将分离到的不同菌株接种到营养肉汤培养基中,37℃培养18 h,活菌计数结果见表3。

表3 细菌计数
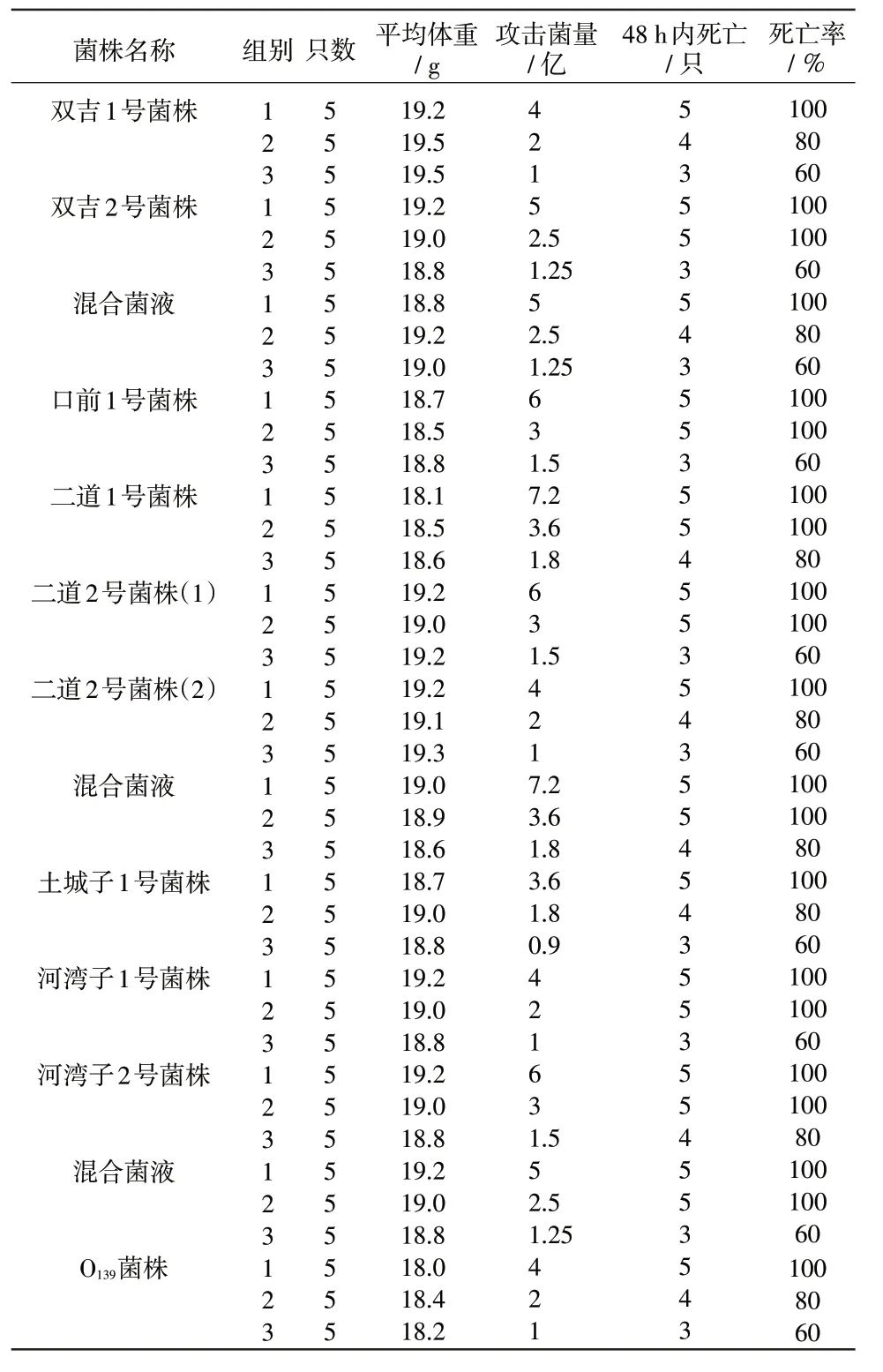
表4 毒力测定
3.7 毒力测定结果 对小鼠毒力测定结果见表4,主要临床症状均为后肢瘫痪,运动失调。对断奶仔猪致病性结果见表5。其他各菌株均采用相同方法测定,均使40日龄仔猪死亡,表明仔猪对菌液中菌体和毒素敏感。本试验接种途径采用肌肉注射方式。
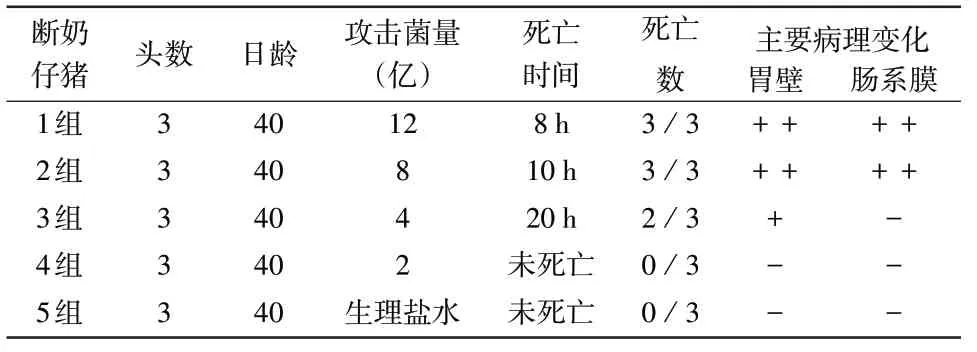
表5 双吉株混合菌液致病性
4 小结
4.1 病原菌鉴定 分别从双吉、口前、二道、土城子等吉林部分地区不同发病猪场采集21份病料中,经细菌的分离鉴定、形态与染色、培养特性、生化特性、致病性、血清性试验,符合仔猪水肿病病原菌特性的菌株有8株,它们分别是双吉1号菌株(O139),双吉2号菌株(O141),口前1号菌株(O141),二道1号菌株(O138),二道2号菌株(O139、O2)(注:由同一猪场分离二株病原菌),土城子1号菌株(O141),河湾子1号菌株(O139),河湾子2号菌株(O8)。
4.2 菌株最小致死量(MLD)确定 对小鼠双吉1号菌株、4亿,双吉2号菌株、2.5亿,混合菌液、2.5亿;口前1号菌株、3亿;二道1号菌株、3.6亿,二道2号菌株(1)、3亿,二道2号菌株(2)、4亿;混合菌液、3.6亿;土城子1号菌株、3.6亿;河湾子1号菌株、4亿,河湾子2号菌株、3亿;混合菌液、2.5亿;O139菌株、4亿。对仔猪双吉混合菌液菌株和其他菌株均为8亿。
[1] 曹立辉,王顺兴,王连福.仔猪水肿病的发病原因及防治[J].河北畜牧兽医,2001(17):24.
[2] 陈德元,曹军平,朱爱萍,等.仔猪水肿病灭活疫苗免疫效果观察[J].湖北农业科学,1999(6):57-59.
[3] 陈德坤,王文秀,孔庆波,雷利辉.用小鼠复制仔猪水肿病的模型试验.动物医学进展,2003,24(4):79-80.
[4] 陈正礼.仔猪水肿病左旋咪唑-葡聚糖佐剂苗的制备及免疫效力测定[J].中国兽医科技.2000(2):27-28.
[5] 成大荣,卞红春,陈海霞,等,猪水肿病大肠杆菌分离、鉴定及药敏试验[J].动物医学进展.2004,25(2):99-101.
