牛肠道病毒2型VP1+表达和间接ELISA方法的建立与应用
2014-03-11郭金玉高志强张鹤晓张乐萃
郭金玉,高志强,张鹤晓,张乐萃,吴 丹
(1.青岛农业大学动物科技学院,山东 青岛266109;2.北京出入境检验检疫局,北京 朝阳100026)
牛肠道病毒(Bovine enterovirus,BEV)是小RNA病毒科、肠道病毒属成员[1]。BEV呈L434结构,球形,无囊膜,大小约为25~30 nm,单股正链RNA病毒。BEV分为2型:BEV-1和BEV-2。据资料报道,在世界其他各国,牛肠道病毒病经常在牛群及其周围环境中流行[2]。在中国,有关此病流行的报道很少。2005年初北京某牛场发生牛肠道病毒感染,引起奶牛严重腹泻,降低了其生产性能,吴丹等从中分离得到1株牛肠道病毒毒株[3],对其进行全基因测序后,确定为BEV-2。2008年,李英利从犊牛粪便中分离出了1株肠道病毒[4],但不确定其基因型。
BEV一般呈隐性感染,通常只引起轻微的下痢和呼吸道症状,但在某些恶劣环境下,动物突发应激导致抵抗力下降时,可引起奶牛发生严重的腹泻,使产奶量大大下降,给畜牧业带来极大的损失。因此,对BEV-2预防和诊断技术的研究日益受到人们的重视。为了建立检测BEV-2抗体的间接ELISA方法,本研究利用原核高效表达系统在大肠杆菌中表达BEV-2型VP1+蛋白,通过对临床样品进行检测,表明该方法具有良好的特异性及重复性。
1 材料与方法
1.1 主要试剂 TRIZol,购自Invitrogen公司;DNA片段回收试剂盒、限制性内切酶EcoRⅠ和HindⅢ、质粒快速提取纯化试剂盒,购自TaKaRa公司;M-MLV反转录酶、RNA酶抑制剂、Taq DNA聚合酶,购自Promega公司;HRP标记的rec Protein G,购自北京博奥星生物技术有限责任公司。
1.2 病毒、质粒、宿主菌及阳性血清 BEV-2病毒(毒株BJ001),北京检验检疫局检验检疫技术中心提供;原核表达质粒pET-32a,本实验室保存;大肠杆菌(E.coli)Top10、Rosetta,购自北京康为世纪生物科技有限公司;BEV-2阳性血清,用BEV-2病毒免疫阴性牛制备。
1.3 牛肠道病毒2型VP1+基因扩增、克隆 用DNAMAN软件将毒株BJ001的全基因序列与Gen-Bank数据库中提交的BEV序列进行比对和分析,然后用Primer Premier 5.0设计引物,扩增包含VP1(840 bp)蛋白基因片段的VP1+(1 275 bp)序列。引物名称、序列见表1。

表1 BEV-2的引物名称和序列
提取BEV-2病毒核酸,以BEV2-VP1-f、BEV2-VP1-r为引物,进行RT-PCR扩增,扩增条件如下:94℃变性2min后进入循环,循环参数是94℃45 s、51℃45 s、72℃1min,40个循环后,72℃延伸10 min。将扩增的基因片段克隆至pMD-T19载体并转化至大肠杆菌Top10中,筛选阳性克隆子,测序正确后,放置-80℃保存。其质粒命名为pMD-T19-BEV2-VP1+。
1.4 原核表达载体的构建及鉴定 将质粒pMDT19-BEV2-VP1+和原核表达质粒pET-32a同时经限制性内切酶EcoRⅠ、HindⅢ双酶切,用连接酶连接过夜,次日转化至大肠杆菌Top10。挑取单克隆菌落扩大培养后,对菌液进行PCR鉴定,鉴定正确的送公司测序。将重组质粒命名为pET-32a-BEV2-VP1+。
1.5 重组蛋白的诱导表达及优化 将重组质粒pET-32a-BEV2-VP1+转化到Rosetta宿主菌,培养一定时间后,加入IPTG诱导表达,取诱导前后的菌液,12 000 r/min离心10min,收集菌体,充分裂解后,加入等体积的2×SDS-PAGE上样缓冲液,100℃煮沸5 min。取10μL进行SDS-PAGE电泳,电泳显示该蛋白为包涵体表达。
对培养温度、诱导时间以及加入IPTG的终浓度等一系列条件进行优化。
1.6 包涵体蛋白的洗涤、溶解 将包涵体用含2mol/L、4mol/L、6mol/L尿素的Tris缓冲液依次进行洗涤后,再用含8 mol/L尿素的Tris缓冲液溶解,最后进行SDS-PAGE检测。
1.7 蛋白的纯化、复性 蛋白纯化用HIS.BIND resin蛋白纯化试剂盒在变性条件下进行。
将纯化后的蛋白装入透析袋中,透析梯度依次为6mol/L、4mol/L、2mol/L、0mol/L尿素的Tris缓冲液,进行透析复性。蛋白复性后,用Westernblot检测其反应原性。
1.8 间接ELISA方法的建立
1.8.1 间接ELISA反应条件的确定 (1)抗原、血清工作浓度的确定:用碳酸盐缓冲液将抗原按1∶50、1∶100依次倍比稀释至1∶6 400包被酶标板;用含1%BSA的PBST将阳性血清、阴性血清按1∶20、1∶40、1∶80、1∶160稀释,进行ELISA方阵试验,测其OD450nm值,来确定抗原包被浓度和血清最佳工作浓度;(2)酶标蛋白G工作浓度的测定:确定抗原和血清最佳工作浓度后,将酶标蛋白G作1∶500、1∶1 000、1∶1 500稀释,进行间接ELISA,测其OD450nm值。
1.8.2 封闭液的确定 分别以5%脱脂奶粉、1%牛血清白蛋白和1%卵清蛋白封闭,比较封闭效果。
1.8.3 临界值的确定 按优化好的条件对30份BEV-2阴性血清样品进行间接ELISA测定,用酶标仪检测OD450nm值,以OD平均值(-x)加3个标准差(SD)作为判定的临界值[5],待检血清高于此值的判为阳性。
1.8.4 间接ELISA的特异性 用间接ELISA方法检测IBR阳性血清、BVDV阳性血清、BLV阳性血清、BEV-2阳性血清,验证该ELISA方法的特异性。
1.8.5 间接ELISA的重复性 用重组蛋白包被ELISA板,选取4份血清样品,重复4孔,进行板内重复性试验;用重组蛋白分别包被3块ELISA板,检测板间重复性,对检测结果进行统计学分析后,分别计算板内和板间变异系数。
1.9 临床样品检测 用建立的间接ELISA方法检测美国、澳大利、新西兰、加拿大进口牛的血清及国内牛血清,统计阳性率。
1.10 间接ELISA与中和试验结果分析比较 用建立的间接ELISA方法对45份不同中和效价的BEV-2阳性血清做倍比稀释,测其ELISA效价,与中和效价进行分析比较。
1.11 ELISA包被板保存期的确定 将包被的蛋白酶标板(蛋白包被时加入0.01%叠氮钠)密封后置于4℃冰箱中保存1个月、3个月、6个月、9个月、12个月进行间接ELISA检测,测定其稳定性。
2 结果
2.1 牛肠道病毒2型VP1+蛋白扩增结果 对牛肠道病毒2型VP1+蛋白基因进行RT-PCR扩增,经1%琼脂糖凝胶电泳可见1条与预期大小(1 275 bp)相符的DNA片段,见图1。
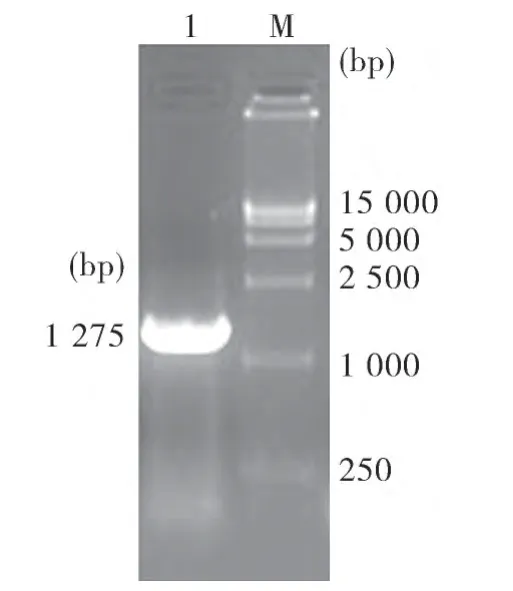
图1 RT-PCR扩增结果
2.2 原核表达载体的构建与序列分析 将克隆到pMD-T19载体的目的片段和原核表达质粒pET-32a同时经限制性内切酶EcoRⅠ、HindⅢ双酶切,用连接酶连接过夜,成功构建了原核表达载体pET-32a-BEV2-VP1+。将重组质粒进行测序,测序结果与原序列一致。
2.3 重组蛋白的诱导表达 将重组质粒pET-32a-BEV2-VP1+转化至Rosetta宿主菌后,在37℃温箱培养1段时间后,加入IPTG进行诱导表达,SDS-PAGE显示在预期分子量大小处即52kDa出现大量表达的特异蛋白条带(图2)。
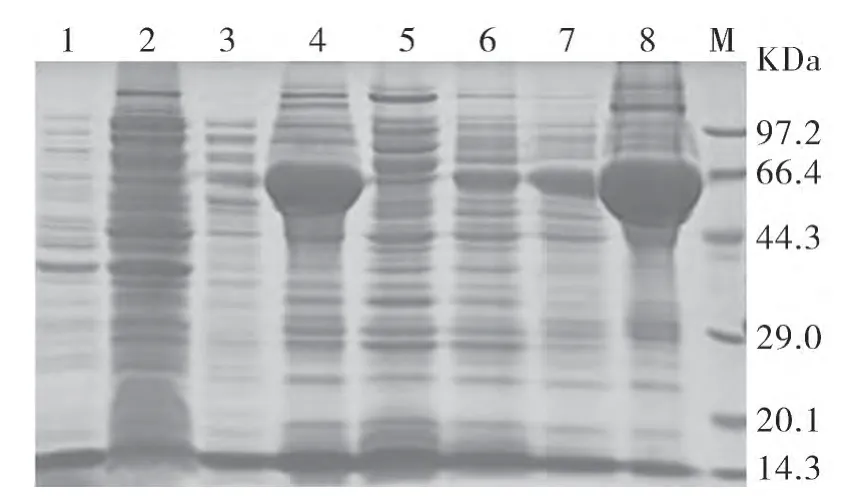
图2 SDS-PAGE电泳结果
2.4 重组蛋白的表达条件优化 经摸索确定最佳表达条件为菌液培养至OD600nm数值到达0.6时,用0.6mmol/L IPTG在37℃诱导4 h,目的蛋白为包涵体表达,最终溶于8mol/L尿素中。
2.5 重组蛋白的纯化与复性 纯化后得到高纯度的重组蛋白(图3)。Western-blot结果表明重组蛋白具有良好的反应原性。
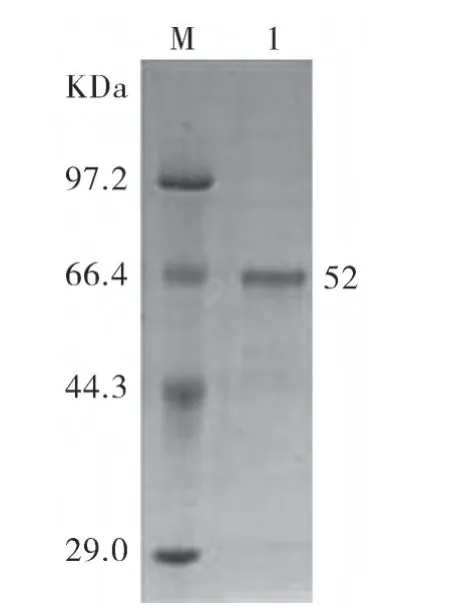
图3 纯化后的重组蛋白
2.6 间接ELISA方法的建立
2.6.1 间接ELISA反应条件确定 经测定,抗原包被浓度为1.56μg/mL,37℃温箱作用1 h后4℃放置过夜;血清最佳工作浓度为1∶40;酶标蛋白G 1:1 000稀释时,P/N值相对较大。
2.6.2 封闭液的确定 封闭液用含1%牛血清白蛋白的PBST封闭,37℃作用2 h效果最好。
2.6.3 临界值的确定 测定30份BEV-2阴性血清,其OD450nm值的-x为0.1762,SD值为0.07211,临界值为-x+3SD=0.3925。
2.6.4 间接ELISA的特异性 间接ELISA结果显示,BEV-2阳性血清为阳性。IBR阳性血清、BVDV阳性血清、BLV阳性血清OD450nm值均小于0.3925,为阴性。
2.6.5 间接ELISA的重复性 经测定计算,板内变异系数为2.20%~7.56%,板间变异系数为2.28%~8.42%,均小于10%,证明该方法准确、可靠、重复性高。
2.7 临床样品检测 用建立的间接ELISA方法检测362份不同国家牛血清,数据显示:除加拿大以外其他各国阳性率均高达80%以上(表2)。
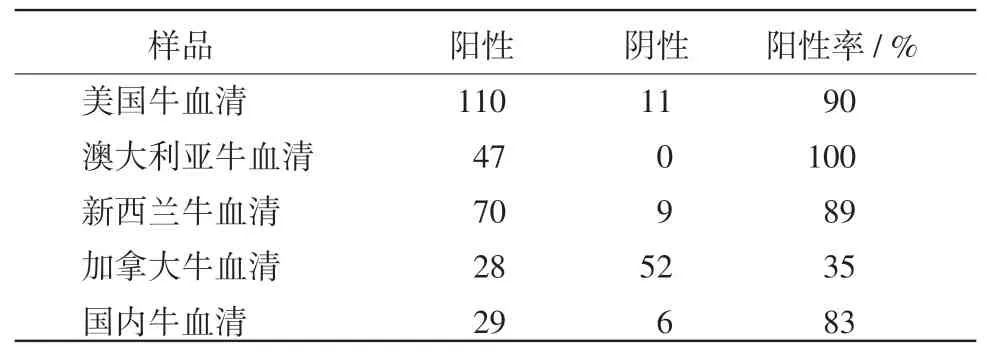
表2 对不同国家牛血清的检测
2.8 间接ELISA与中和试验(NT)结果分析比较
两种方法同时检测45份牛血清,阳性符合率为50%,阴性符合率为55.2%,总符合率为53.3%。结果显示,血清的中和效价和ELISA效价不成正相关(表3)。
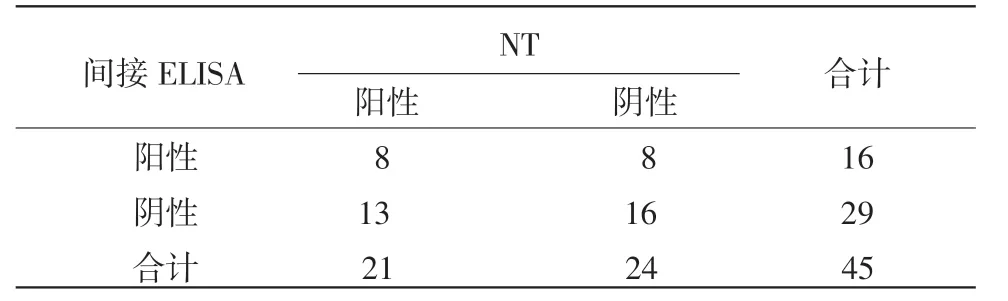
表3 NT和间接ELISA的符合率试验结果
2.9 ELISA包被板保存期的确定 试验结果显示,蛋白包被时加入叠氮钠对试验结果没有影响,保存于4℃1~6个月的ELISA包被板阴阳性血清的变异系数均小于10%,ELISA包被板保存期为6个月。
3 结论与讨论
目前,国内外对BEV-2的研究较少,本研究根据BEV-2病毒(毒株BJ001)设计引物,摸索并优化出VP1+蛋白序列的诱导表达条件,表达的重组蛋白溶于8mol/L尿素中,且保持较好的反应原性。用重组蛋白BEV-2 VP1+作为包被抗原,并用HRP标记的rec Protein G为二抗,在国内率先建立了BEV-2的间接ELISA检测方法。
牛肠道病毒通常是轻度或不显性感染,在发生应激、体质虚弱等情况下可引发显著症状,导致牛发生多种综合征,这不仅严重降低了奶牛的生产性能,而且还有污染奶制品的可能。跟踪调查显示,目前该病两年就发生1次,发生这一现象的原因可能是:当动物处于恶劣环境下,其抵抗力会下降,导致机体发病;发病后体内抗体升高,维持一段时间后抗体开始下降,从而导致再次发病。本试验通过对不同国家进口牛血清的检测(进口牛血清来自不同国家的不同牛场),可以看出美国、澳大利亚、新西兰和国内牛血清阳性率非常高,均在80%以上。之所以会出现BEV-2在美国、澳大利亚、新西兰和我国牛高阳性率的原因可能有两点:一是BEV-2在环境中非常稳定,能在环境中存在很长时间,感染后多数为亚临床表现,不易被发现;二是跟放牧形式有关,以上4个国家多采用密集型放牧形式,牛群之间密切接触,一旦有牛感染,BEV-2就会在牛群中广泛存在。加拿大牛的血清相对来说阳性率比较低,只有35%,可能与加拿大饲养方式和牛群间相距较远有关。据报道,在广延性的放牧地区,感染牛肠道病毒的机率较低。加拿大采取了低密度饲养动物的措施,大大降低了牛肠道病毒在环境中暴发的危险系数。
将中和试验和间接ELISA试验结果进行比较,可以看出二者的抗体效价不呈现正相关,原因可能是BEV-2的中和位点并非全部落在扩增的目的蛋白序列VP1+上。
本试验建立的检测牛肠道病毒2型抗体的间接ELISA方法操作简单、快捷、具有较高实用价值,该诊断方法将有望更广泛地应用于临床病例的诊断和血清学普查。下一步,拟用表达的重组蛋白制备单克隆抗体。
[1]Smyth M S,Martin JH.Structural.biochemical and electrostatic basis of serotype specificity in bovine enteroviruses[J].Arch Virol,2001,146(2):347-355.
[2] Goens SD,Botero S,Zem la A,et al.Bovine enterovirus 2:complete genomic sequence and molecularmodelmodelling of a references strain and awild-type isolate from endemically infected US cattle[J].JGen Virol,2004,85(11):3195-3203.
[3]彭小薇,董浩,张鹤晓,等.牛肠道病毒2型的分离与鉴定[J].畜牧兽医学报,2013,44(5):23-828.
[4] 李英利,常继涛,于力.牛肠道病毒的分离鉴定[J].中国预防兽医学报,2011,5:51-55.
[5]杜平.医用实验病毒学[M].北京:人民军医出版社,1985.
