活性氧参与脂多糖诱导小鼠巨噬细胞RAW 264.7活化诱导凋亡
2014-03-11张宸豪王月华王长文周露露
张宸豪,王月华,王长文,周露露,李 妍
(1.吉林医药学院检验学院,吉林 吉林132013;2.吉林医药学院公共卫生学院,吉林 吉林132013;3.吉林医药学院药学院,吉林 吉林132013)
巨噬细胞以模式识别方式结合、捕获、吞噬和杀伤细菌等病原体,细菌感染后,巨噬细胞内活性氧自由基(Reactive oxygen species,ROS)和NO迅速增加,上诉强氧化性物质参与杀伤病原体[1-2]。除介导固有免疫应答外,巨噬细胞可提呈抗原启动适应性免疫应答,并通过释放细胞因子进一步增强免疫效应。脂多糖(Lipopolysaccharide,LPS)是革兰阴性菌细胞壁的主要致病成分,巨噬细胞Toll样受体4(Toll like receptor 4,TLR4)结合和识别LPS,可启动细胞内p38MAPKs、NFκB等信号的活化,促进炎症性细胞因子释放[2-3]。通常情况下,感染后的免疫应答为自限性过程,T、B淋巴细胞通过活化诱导凋亡(Activation induced cell death/apoptosis,AICD)调节免疫效应细胞的数量。近年来,国内外学者提出巨噬细胞也可通过AICD而限制炎症的进行性发展[2-3]。研究表明,细菌或LPS诱导产生的ROS参与巨噬细胞活化信号的转导,但ROS是否也参与巨噬细胞AICD尚未明确[1-2]。本研究以小鼠巨噬细胞RAW264.7为模型,分析ROS与LPS诱导巨噬细胞AICD的关系。
1 材料与方法
1.1 材料 RAW264.7细胞源于中国科学院上海细胞所。JC-1线粒体膜电位(Mitochondrialmembrane potential,MMP)检测试剂盒(产品编号:C2006)和ROS荧光探针双氯荧光黄乙酸乙酯(Dichlorofluorescin diacetate,DCFH-DA),购自上海碧云天生物技术研究所;1640培养液,购自Gibco公司;小牛血清,购自Hyclone公司;胰蛋白酶和EDTA,购自Sigma公司产品;姜黄素,购自国家标准物质中心。PI和Annexin-V-FITC细胞凋亡试剂盒,购自eBiocience公司。流式细胞仪型号为Epics XL(美国贝克曼公司)。
1.2 细胞培养和处理 试验前1周,自液氮中取出冻存的细胞,复苏后在如下条件下培养:含10%小牛血清1 640培养液、5%CO2、饱和湿度和37℃。用含0.5%胰蛋白酶和0.2%EDTA的消化液消化细胞,2到3 d传代1次,取对数生长期细胞用于试验。接种细胞于培养瓶,按如下分组加入LPS或其他制剂:不同浓度的LPS(0,1,2,4μg/mL和8μg/mL);LPS(0和8μg/mL与H2O2(0和100μmol/L);LPS(0和8μg/mL与姜黄素(0和7.5μmol/L)。继续培养细胞24 h,消化收集细胞并完成后续试验。
1.3 活性氧检测 取5×105个细胞,PBS洗涤2次,100μL PBS重悬细胞,加入DCFH-DA储存液,至其终浓度为5μmol/L,混匀后在37℃避光反应30min,PBS洗2次后流式细胞仪分析。
1.4 细胞凋亡分析 取5×105个细胞,用PBS洗涤2次,取195μL结合缓冲液重悬细胞,加入5 μL FITC-标记Annexin-V,室温下避光反应30 min;结合缓冲液洗涤细胞2次,400μL结合缓冲液重悬细胞,加入PI溶液5μL,5min后用流式细胞仪分析。
1.5 线粒体膜电位分析 取5×105个细胞,参考试剂盒说明书提供的方法,配制JC-1染色工作液和染色缓冲液(冰沐保存)。500μL JC-1染色工作液重悬细胞,37℃避光反应30 min;离心后弃上清,染色缓冲液洗涤细胞2次;500μL染色缓冲液重悬细胞,流式细胞仪FL1通道(525 nm)检测细胞所发射的荧光。
2 结果
2.1 LPS对巨噬细胞ROS、MMP和细胞凋亡的影响 不同浓度LPS诱导RAW 264.7细胞24 h,流式细胞术检测ROS和MMP。DCFH-DA进入细胞后被酯酶水解为DCFH,该物质被氧化后生成DCF,而DCF发射的荧光可采用流式细胞仪525 nm通道(FL1)来检测,其荧光强度值代表细胞内ROS水平。与对照组比较,1,2,4μg/mL和8μg/mL的LPS作用后,细胞内ROS的水平随其浓度增加而增加(表1)。JC-1是一种新型荧光探针,进入线粒体后,其存在状态和发射荧光与线粒体功能联系紧密:线粒体功能正常时,JC-1主要聚集在线粒体基质内,形成聚合物,发射红色荧光;而在MMP较低时,JC-1主要以单体形式存在,发射绿色荧光[4]。低浓度的LPS(1,2μg/mL和4μg/mL)对线粒体功能无显著影响或具有弱的增强作用;当LPS增加为8μg/mL,代表JC-1单体的绿色荧光增强,即MMP下降(表1)。
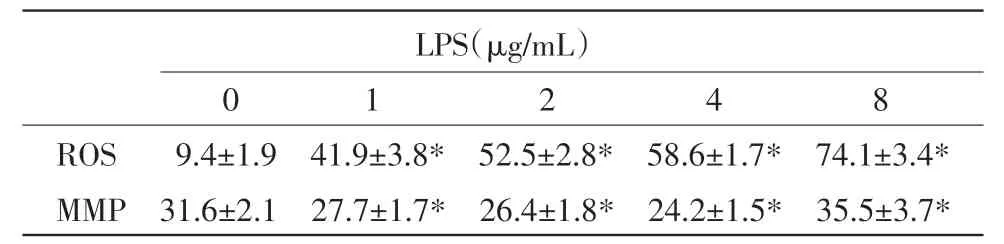
表1 LPS对RAW 264.7 ROS和MMP的影响
PI和Annexin-V试剂双染法检测细胞凋亡。图中左下、左上、右上和右下象限分别代表活细胞、坏死细胞、晚期凋亡和早期凋亡细胞,随LPS浓度的增加,活细胞百分率下降;而凋亡和坏死细胞显著增加(图1)。
2.2 H2O2和姜黄素对LPS诱导巨噬细胞ROS的影响 采用H2O2(0和100μmol/L)或姜黄素(0和7.5μmol/L)与LPS(0和8μg/mL)处理RAW细胞24 h,流式细胞术分析ROS。与LPS单独作用比较,H2O2导致细胞内ROS增加,而姜黄素降低细胞内ROS(图2)。
2.3 H2O2和姜黄素对LPS诱导巨噬细胞凋亡的影响 流式细胞术分析H2O2和姜黄素对LPS活化巨噬细胞凋亡的影响。与LPS单独作用比较,H2O2导致巨噬细胞凋亡、坏死的百分率增加,而姜黄素降低了LPS诱导的细胞凋亡、坏死(图3)。
3 讨论
淋巴细胞(T细胞和B细胞)中存在AICD现象[5]。AICD参与中枢免疫器官中自身反应性淋巴细胞的克隆清除,淋巴细胞在外周淋巴组织被抗原活化后,也通过AICD而导致数量减少,从而避免过强的免疫应答造成组织损伤。淋巴细胞发生AICD主要细胞膜表面的凋亡诱导配体和受体来介导,包括Fas和FasL,肿瘤坏死因子(Tumor necrosis factor,TNF)和TNF受体,以及肿瘤坏死因子相关的凋亡诱导配体(TNF related apoptosis inducing ligand,TRAIL)和其受体[6]。上述凋亡诱导配体和受体既是淋巴细胞执行适应性免疫功能的重要效应分子,也清除免疫效应细胞、限制炎症反应的重要机制。
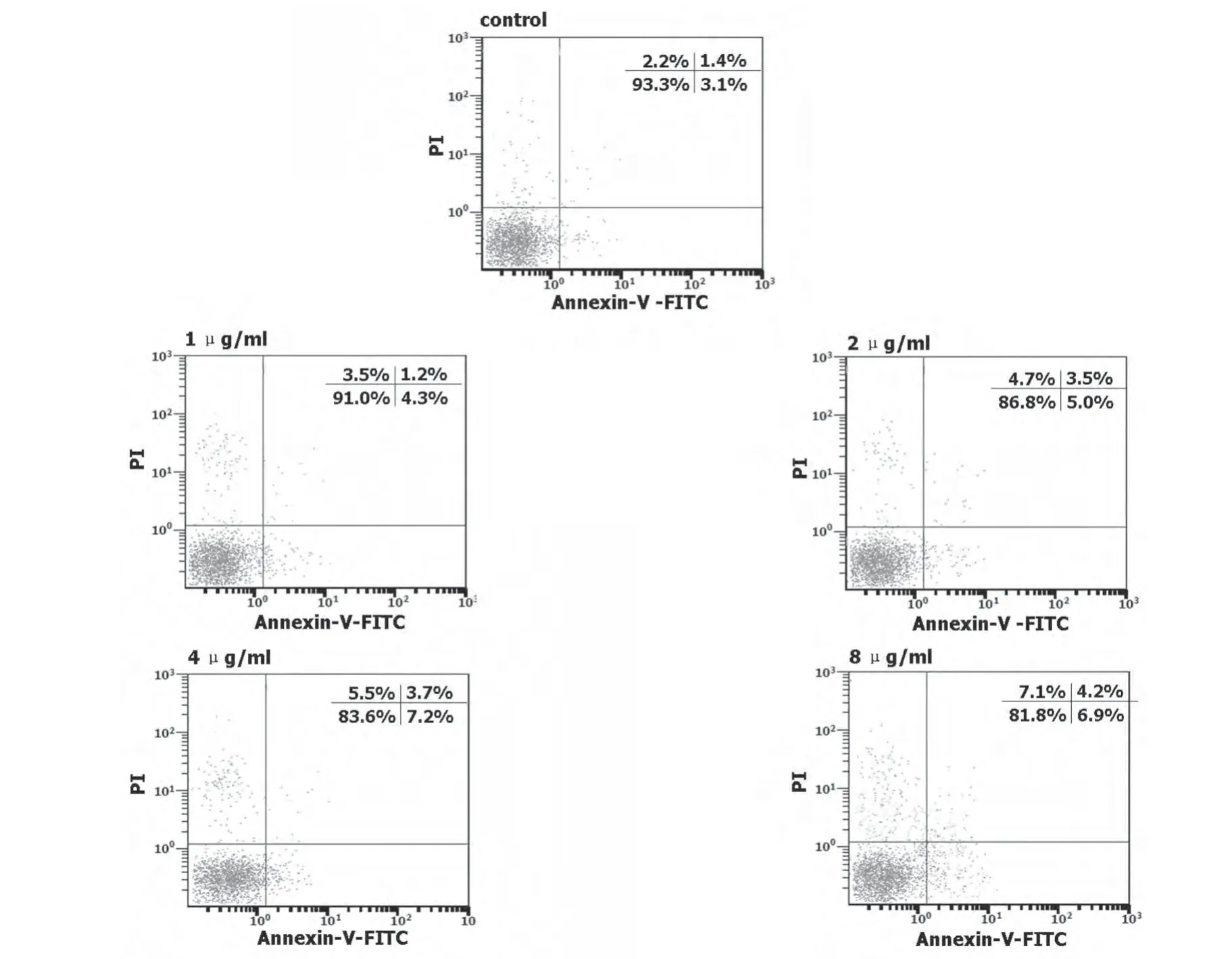
图1 LPS诱导RAW 264.7细胞凋亡
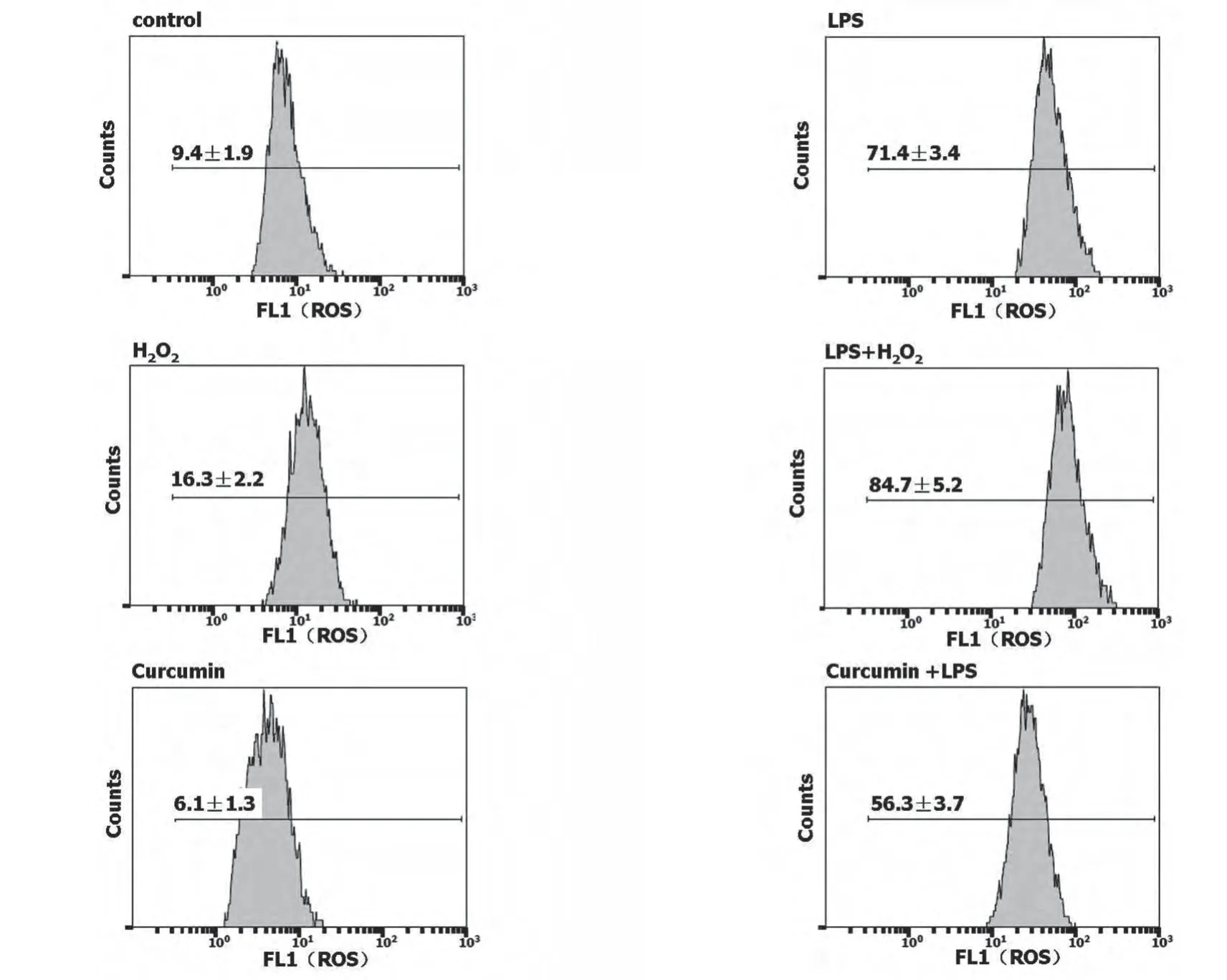
图2 H2O2和姜黄素对LPS诱导巨噬细胞ROS的影响
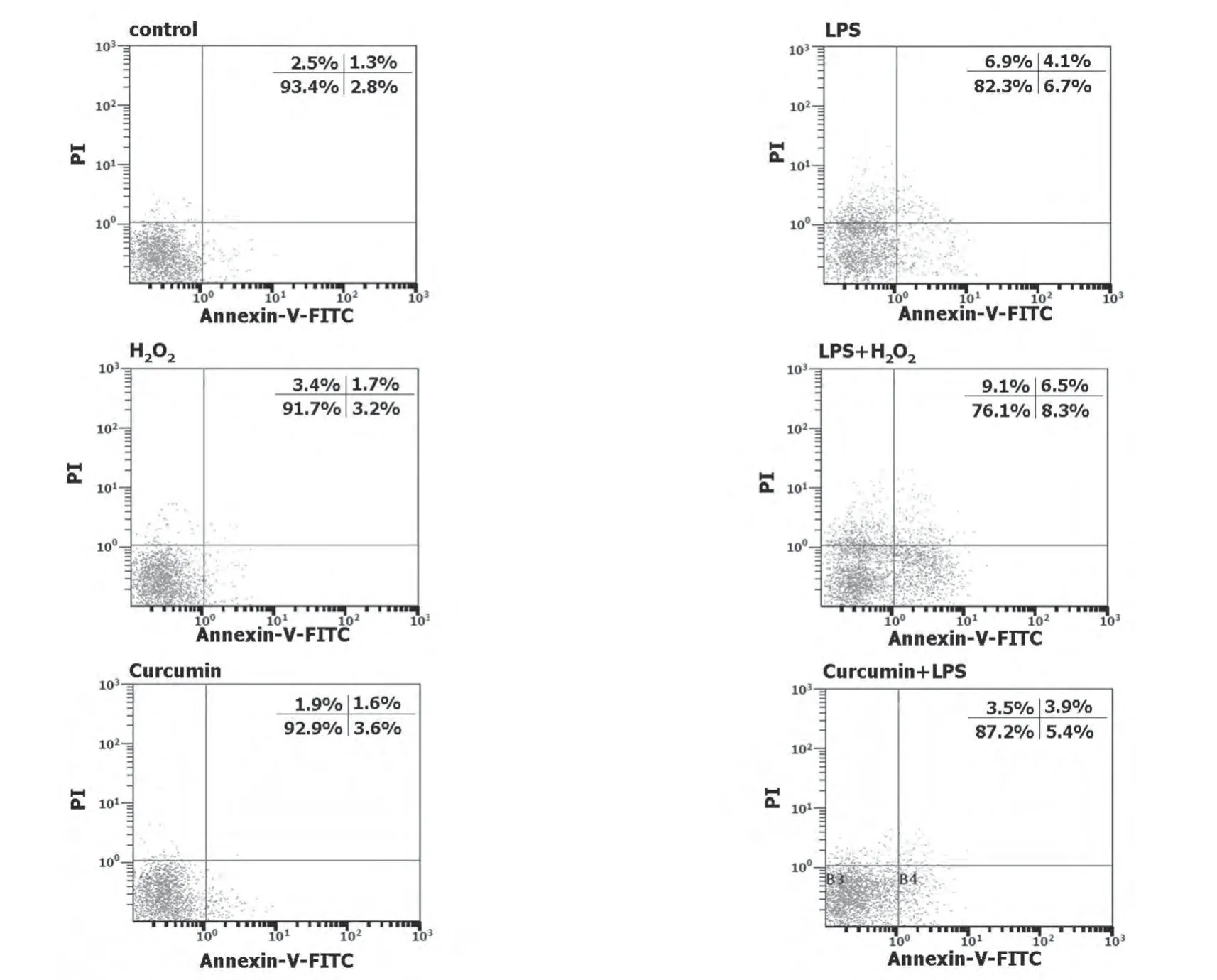
图3 H2O2和姜黄素对LPS诱导巨噬细胞凋亡的影响
单核巨噬细胞由骨髓造血干细胞分化发育而来,除介导固有免疫应答外,巨噬细胞可提呈抗原启动适应性免疫应答,并通过分泌细胞因子调节免疫应答。巨噬细胞在吞噬病原体、衰老变性细胞或粉尘等颗粒性异物后进入活化状态,表现为溶酶体功能增强、ROS和NO增加、分泌大量炎症性细胞因子等[1-2]。与静止巨噬细胞比较,活化后的巨噬细胞存活期缩短。病原体感染和其他非感染性炎症疾病中,也可观察到巨噬细胞凋亡增加,但其发生AICD的机制尚不明确。Toll样受体(Toll like receptor 4,TLR4)是巨噬细胞识别细菌或LPS的主要膜受体,TLR4与LPS结合可导致各种组织内巨噬细胞被激活。LPS诱导后,巨噬细胞内炎症相关的信号被活化,同时细胞内呼吸暴发产生大量ROS,但作为重要效应分子的ROS是否也参与巨噬细胞的活化凋亡尚不明确。本研究证实,LPS以浓度依赖的方式诱导小鼠巨噬细胞RAW264.7凋亡,伴随LPS浓度增加,细胞内ROS水平显著增加;高浓度LPS导致大量ROS产生的同时也损伤了线粒体功能。向培养体系加入H2O2可增加细胞内ROS,而本研究发现,H2O2促进了LPS所诱导细胞凋亡。姜黄素具有抗氧化和治疗肿瘤的功效[8]。用低浓度的姜黄素与LPS共同诱导细胞,细胞内ROS比LPS单独诱导组下降,细胞凋亡和坏死也有所减轻。概括而言,LPS诱导的ROS与巨噬细胞活化凋亡关系密切。
巨噬细胞的激活是其执行免疫功能所必需的,但是激活后不受控制就可能造成正常组织细胞的损伤,研究巨噬细胞活化死亡的机制将有助于深入认识其功能,为治疗、预防自身免疫病和炎症等疾病提供依据。
[1]Islam M A,PröllM,Hölker M,etal.Alveolarmacrophage phagocytic activity is enhanced with LPS priming,and combined stimulation of LPS and lipoteichoic acid synergistically inducepro-inflammatory cytokines in pigs[J].Innate Immun,2013,19(6):631-43.
[2]Fang X,Yu M M,Yuen W H,et al.Immune modulatory effects ofPrunella vulgaris L.on monocytes/macrophages[J].Int JMol Med,2005,16(6):1109-1116.
[3]周静,王轶楠,柳忠辉,等.脂多糖诱导小鼠巨噬细胞系RAW264.7活化凋亡作用[J].中国生物制品学杂志,2009,22(2):136-138.
[4]安冉,董强.凋亡过程中线粒体膜透化的常用检测方法[J].中华脑血管病杂志(电子版),2009,3(1):33-37.
[5]Martínez-Lorenzo M J,Alava M A,Gamen S,et al.Involvement of APO2 ligand/TRAIL in activation-induced death of Jurkat and human peripheral blood T cells[J].Eur J Immunol,1998,28(9):2714-2725.
[6] Weiss EM,Schmidt A,Vobis D,et al.Foxp3-mediated suppression of CD95L expression confers resistance to activation-induced cell death in regulatory T cells[J].J Immunol,2011,187(4):1684-1691.
[7]Shin E S,Hwang H J,Kim IH,etal.A glycoprotein from Porphyra yezoensis produces anti-inflammatory effects in liposaccharidestimulated macrophages via the TLR4 signaling pathway[J].Int J MolMed,2011,28(5):809-815.
[8] Das L,Vinayak M.Anti-carcinogenic action of curcumin by activation of antioxidant defence system and inhibition of NF-κB signalling in lymphoma-bearing mice[J].Biosci Rep,2012,32(2):161-170.
