恩诺沙星对大肠杆菌突变耐药菌产生和富增影响的研究
2014-03-11杨雨辉王学梅王金花赵建国
吴 昊,杨雨辉,2,王学梅,王金花,赵建国
(1.海南大学农学院,海南 海口570228;2.海南省热带动物繁育与疫病研究重点实验室,海南 海口570228)
虽然科学家们发现细菌耐药性现象仅有60多年的历史,但最近的研究却表明,它是一个古老的自然现象[1]。正是由于当前抗菌药物大量使用,破坏了原有微生物之间形成的平衡,才导致目前大量耐药菌的出现。虽然我们已经能够确定,耐药性是细菌适应性进化的结果,但是,仍有一些疑问需要解决,那就是为什么细菌耐药性的进化速度如此之快?又有哪些因素影响着耐药菌的进化速度呢?
从目前关于耐药菌进化影响因素的文献来看,耐药菌的产生速度,受到抗菌药物浓度变化和空间分布的影响[2-4]。而耐药菌的选择性富增过程受到抗菌药物浓度变化的影响[5-9]。抗菌药物的浓度变化和空间分布可对细菌生存形成强度不同的压力,从而影响细菌耐药性的进化过程。不同的给药方案和药物代谢动力学特征是造成动物体内药物浓度变化的两个最主要因素。因此,通过改变给药方案和药物代谢动力学特征,可以实现动物体内药物浓度的变化,从而影响细菌耐药性的进化过程。由于给药方案是耐药菌进化影响因素中人为可控的因素,因此,我们对抗菌药物给药方案制定的要求不仅仅是高效和低毒,更要求给药方案能够遏制耐药菌的进化速度,防止或减慢耐药菌的产生和富增。
由于传统给药方案的制定,仅是考虑疗效,而忽略了给药方案对耐药菌产生和富增的影响,因此,仅根据体外最小抑菌浓度(MIC)、消除半衰期和有效浓度维持时间等方法,确定的给药方案已不能满足目前我们对抗菌药物给药方案制定的要求。为了制定更为合理的给药方案防止耐药菌过快地产生和富增,开展给药方案对细菌耐药性产生与发展影响的研究是非常必要的。针对于此,利用体外药物代谢动力学模型研究了恩诺沙星不同给药方案对大肠杆菌耐药菌产生和富增的影响,以期确定给药方案和药动学特征在耐药菌产生和富增所产生的作用。
1 材料与方法
1.1 药品与试剂 恩诺沙星精制品,由浙江国邦药业有限公司生产,批号:070822-1,含量≥98%;恩诺沙星标准品,批号:H0080306,购自中国兽医药品监察所;乙腈和甲醇为色谱纯,氯化钠,磷酸等均为国产分析纯试剂;肉汤培养基和营养琼脂培养基,均购自广州环凯微生物科技有限公司。
1.2 待测菌株 大肠杆菌标准菌株2081(44103),购自中国兽医药品监察所。
1.3 方法
1.3.1 最小抑菌浓度的测定 本研究采用试管双倍稀释法测定MIC,加菌量为105CFU/mL。37℃培养16 h~18 h后观察结果。以最低不长菌的浓度为MIC。相同过程重复5次。
1.3.2 防突变浓度(Mutation prevention concentration,MPC)的测定 分别以2MIC、4MIC、8MIC、16MIC浓度的抗菌药制作药物平板,浓缩菌液并调整浓度。每个药物平板接种0.1mL菌液,每个药物浓度4个平板,使每个浓度最终接种菌的量达到1.2×1010CFU。37℃下培养72 h,观察结果,最低不长菌的浓度为暂定防突变浓度(MPCpr)。在MPCpr的基础上线性递减20%制作药物平板,以相同的方法接种细菌。最低不长菌的浓度就是防突变浓度(MPC)。
1.3.3 体外药物代谢动力学模型的建立 体外药物代谢动力学模型的建立及参数的确定方法参见杨雨辉报道的方法[10],本研究也是使用两个流速相同的蠕动泵来实现一室模型室内药物浓度的指数变化。其中恩诺沙星猪体内的消除半衰期参考曾振灵[11]的报道,蠕动泵的流速根据药物的消除半衰期进行确定,流速=容器体积(V)×Kel;Kel=0.693/消除半衰期。
1.3.4 模型内大肠杆菌总数及不同耐药强度大肠杆菌的计数方法 模型内大肠杆菌的总数采用无药平板菌落计数法进行细菌计数。不同耐药强度大肠杆菌的测定采用含1MIC、2MIC、5MIC、8MIC的恩诺沙星的药物浓度平板进行菌落计数进行计数。
1.3.5 试验方案及试样采集 首先制作体外药物代谢动力学感染模型,从平板上挑取单个菌落接种于5 mL肉汤中,适宜温度培养12 h后,取0.1 mL菌液接种于模型双层烧杯的肉汤中,培养12 h后,即为制作的体外药物代谢动力学感染模型。模型的给药剂量分别设定为0.15μg/mL、0.20μg/mL、0.30μg/mL、0.80μg/mL、1.50μg/mL;半衰期分别设定为3 h或6.5 h,给药间隔是12 h。加入抗菌药物,使肉汤中的药物达到所需的初始浓度。在0、4、8、12、24、36、48、60、72 h分别取出菌液进行细菌计数。试验模型的运行时间根据模型内细菌的耐药强度和数量进行调整,当模型内所有细菌均为超过8MIC耐药的强度时或模型内所有的细菌均被杀死时,试验结束。每个采样点均使用有无药平板和含药分别是1MIC、2MIC、5MIC、8MIC的药物平板进行计数。同时取2 mL菌液装在2个小离心管中放在冰箱中冷冻保存,以便进行药物浓度的测定。每个初始浓度重复3次。
1.3.6 模型内药物浓度的测定方法 本研究采用高效液相色谱法测定恩诺沙星的药物浓度,具体方法参见文献[8]。
1.3.7 数据处理 本试验平均值及标准差的计算使用Microsoft Excel、药动参数的计算使用WINNONLIN软件进行。
2 结果
2.1 恩诺沙星对大肠杆菌的MIC和MPC 经测定,恩诺沙星对大肠杆菌标准菌株2081(44103)的MIC值为0.015μg/mL,MPC值为0.1μg/mL,MIC/MPC为6.667。突变选择窗(Mutation Selection Windows,MSW)的范围在0.015μg/mL至0.1μg/mL之间。
2.2 恩诺沙星不同的给药方案对大肠杆菌突变耐药菌产生和富增影响的结果 恩诺沙星不同的给药方案对大肠杆菌突变耐药菌产生和富增影响的结果见表1~6,其中,表1~3是药物消除半衰期为3 h和给药间隔为12 h的情况下,给药剂量分别为0.20μg/mL,0.30μg/mL和0.80μg/mL的试验结果。由于给药剂量为0.15μg/mL的处理出现耐药规律一致,故此省略。表4~5是给药间隔为12 h,药物的半衰期为6.5 h,给药剂量分别为0.20μg/mL和0.80 μg/mL的试验结果。由于给药剂量为1.5μg/mL的处理与给药剂量为0.80μg/mL的处理结果均全部杀死细菌,故此省略。
由结果可见,在药物消除半衰期和给药间隔相同的情况下,如果药物不能杀灭全部的病原菌,则给药浓度越高,耐药菌出现越早,且耐药强度越高。在药物浓度和给药间隔相同的情况下,药物消除越快,就更早地富集出耐药菌。耐药菌的耐药强度随着用药时间的延长而增强,且有阶梯增强的表现。在药物浓度高到一定的值时,细菌会被全部杀死。且即使再提高药物浓度,也不能再加快杀灭细菌的速度。
2.3 不同设定条件的药物代谢动力学模型的药动学参数 使用WINNONLIN软件的一室静注模型对药物代谢动力学模型内药物浓度的变化进行模型计算,结果见表6。结果表明,计算得到的药动学参数与事先设置的参数接近,药物浓度的变化规律可用方程C=C0×e-Kelt表示。其中C0:初始药物浓度;t:模型运行的时间。
3 讨论
由结果可见,在药物消除半衰期和给药间隔相同的情况下,如果药物不能杀灭全部的病原菌,则给药浓度越高,耐药菌出现越早,且耐药强度越高。在药物浓度和给药间隔相同的情况下,药物消除越快,就更早地富集出耐药菌。耐药菌的耐药强度随着用药时间的延长而增强,且有阶梯增强的表现。在药物浓度高到一定的值时,细菌会被全部杀死。且即使再提高药物浓度,也不能再加快杀灭细菌的速度。
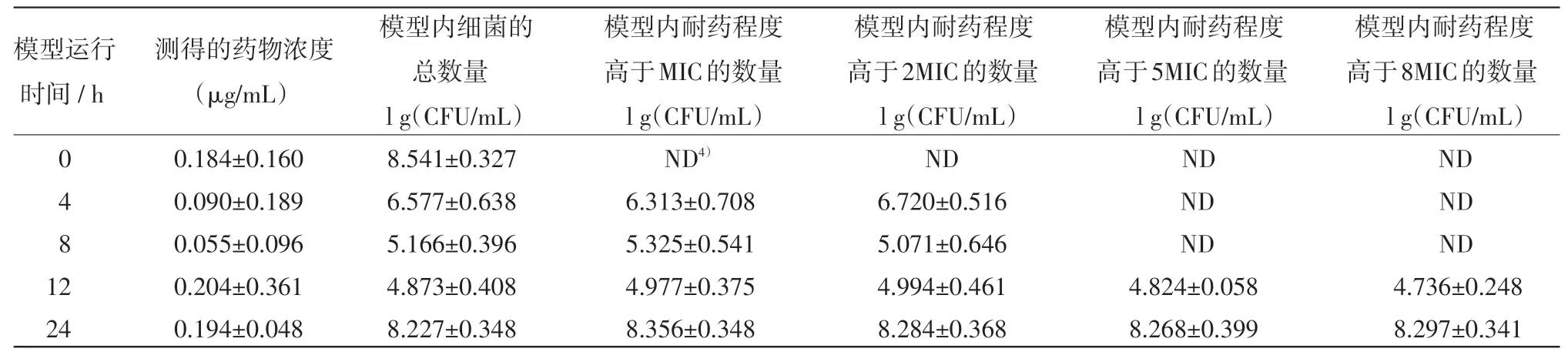
表1 在T1/21)=3 h,按D2)=0.2μg/m L及T3)=12 h的方案给药后模型内药效及耐药菌组成的变化
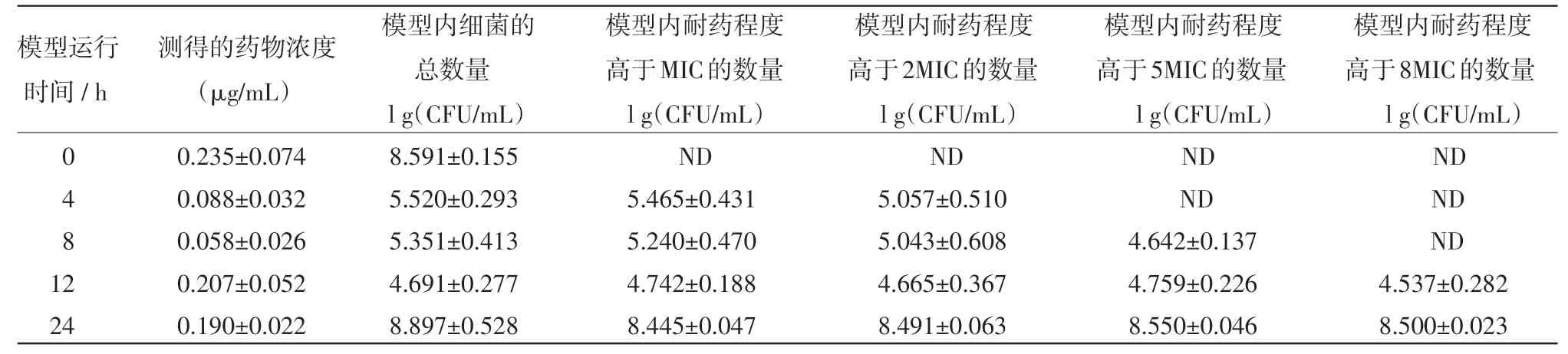
表2 在T1/2=3 h,按D=0.3μg/m L及T=12 h的方案给药后模型内药效及耐药菌组成的变化
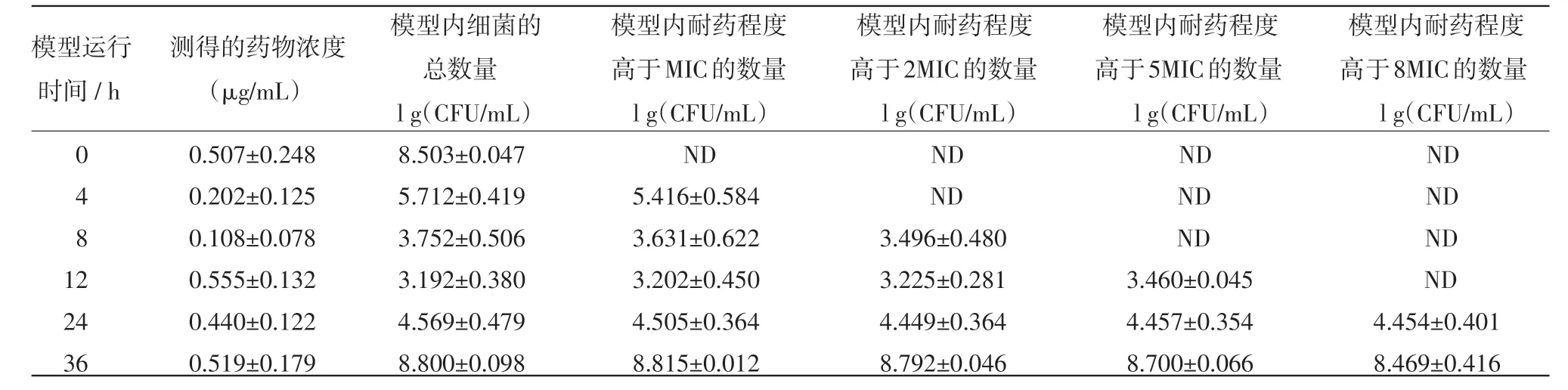
表3 在T1/2=3 h,按D=0.8μg/m L及T=12 h的方案给药后模型内药效及耐药菌组成的变化
由以上结果说明,耐药菌的出现和富集与给药方案和药物的药动学特征都有关系,这是在以前的研究中很少被论述的内容,但是,最近也有部分文献对耐药菌产生的影响因素进行了论述。2011年Zhang Q等[2]在Science上发表了一篇关于耐药菌出现影响因素的文章,该研究使用一个微流装置,研究了环丙沙星浓度梯度对大肠杆菌耐药菌出现的影响,结果表明,药物空间分布的不均一性是加速耐药菌进化的一个因素。之后又有几篇关于药物浓度梯度对耐药菌进化影响的论述。Hermsen R[3]提出了一个定量的数学模型描述药物浓度在动物体内的不均一性对耐药菌进化的影响。结果表明,浓度梯度可以培育一个在均一环境中不可能存在的模型,这样的模式使得突变耐药株逃避了更高药物浓度的包围,结果更有利于耐药菌的出现。Greulich P等[4]使用一个统计物理学模型研究了暴露在药物浓度梯度下一群恶性细胞的进化过程。结果显示,当耐药菌突变路径包括很多步骤的时候,药物分布的不均一性具有加速耐药性出现的可能性。但是,如果突变路径很短或者仅需跨过一个障碍,耐药性的出现很可能被药物浓度梯度减慢。以上两个论述是在数学模拟后的结论,需要实验的验证。
除了药物空间分布影响耐药菌出现的速度外,抗菌药物的给药方案和药动特征也影响着耐药菌出现的速度。2011年Jotam G[5]论述了耐药结核菌的出现与PK/PD因素有关,并指出非优化的给药方案是驱动结核菌对抗结核药物产生耐药性主要因素。在以前的一些研究中[6-8],虽然没有明确表明给药方案和PK/PD特征将影响耐药菌的出现速度,但研究结果表明在体外药效的模型中,当药物浓度处于MIC附近的时候,更容易导致耐药菌的发展。这也间接说明给药方案和药动特征会对耐药菌的产生速度产生影响。
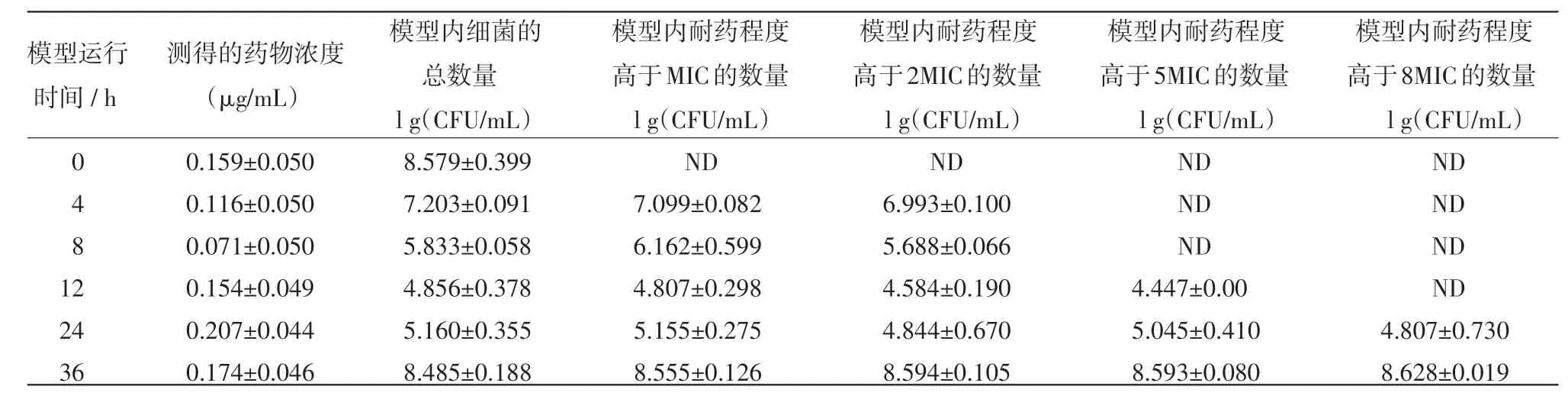
表4 在T1/2=6.5 h,按D=0.2μg/m L及T=12 h的方案给药后模型内药效及耐药菌组成的变化
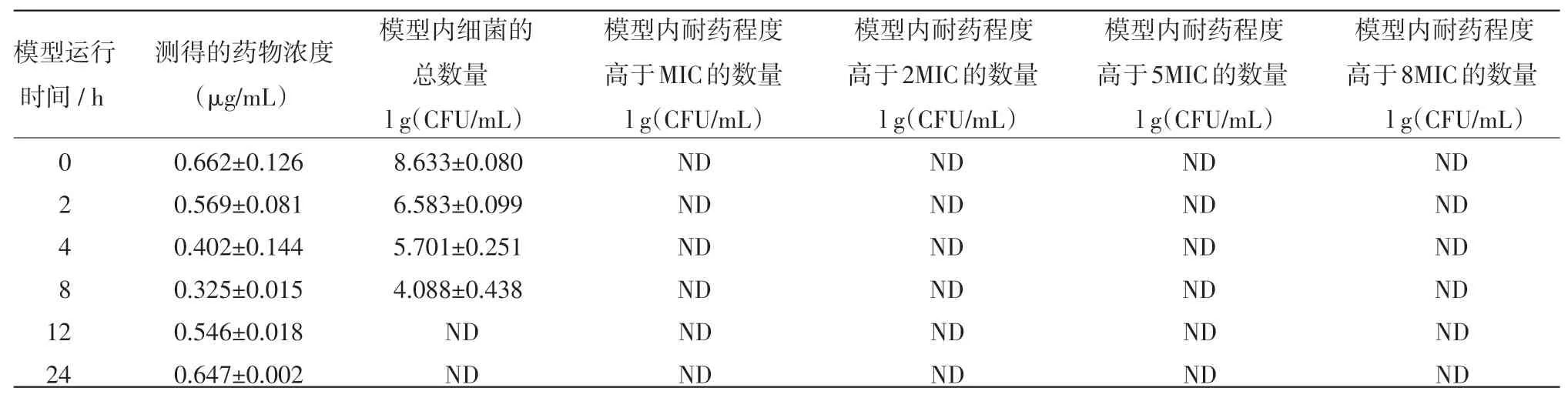
表5 在T1/2=6.5 h,按D=0.8μg/m L及T=12 h的方案给药后模型内药效及耐药菌组成的变化
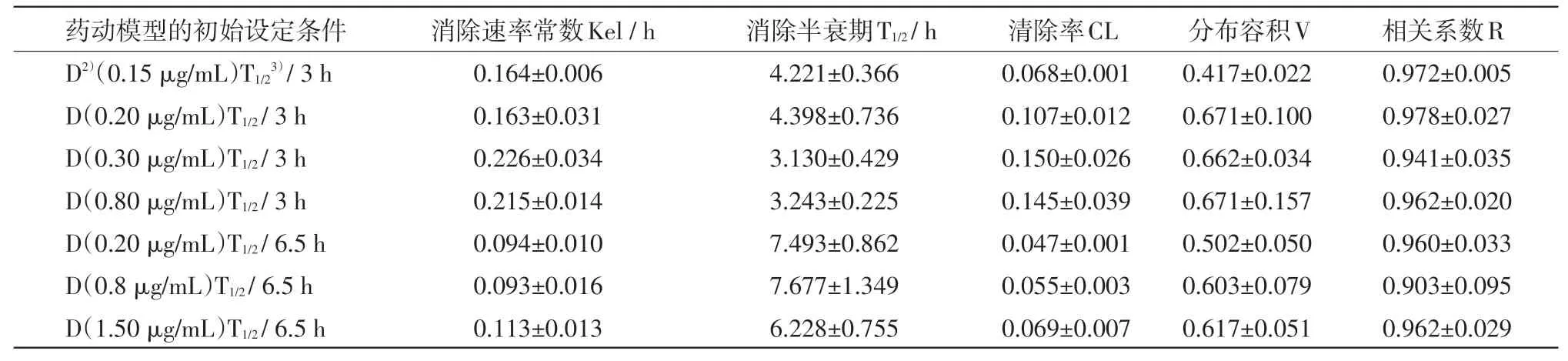
表6 不同设定条件的药物代谢动力学模型的药动学参数
模型运行结果中,给药浓度为1μg/mL、0.8 μg/mL,加药周期为12 h,半衰期为6.5 h的给药方案可以完全杀死细菌。这两个给药方案中,模型内药物浓度一直维持在MPC之上。MSW理论认为只有药物浓度持续维持在MPC之上时,才不会筛选出耐药菌,所以该结论符合MSW理论。
4 结论
由本研究的结果可见,细菌耐药性的产生是一个逐渐增高的过程,且按照一定的规律严格进行的。在以前的研究中已经能够确定药物浓度和药物结构可对细菌靶位耐药基因的突变产生影响[12-13],并表现出一定的规律性。如对于喹诺酮类药物,不同药物浓度作用于结核杆菌和肺炎链球菌,将选择出不同耐药的等位基因。当两种靶目标同时存在时(即拓扑异构酶Ⅳ和解旋酶同时存在时),突变体靶目标按照严格的顺序产生[14-15]。这些都说明,耐药性的产生是有规律的,但接触药物浓度的差异会导致耐药性产生速度和程度发生变化。因此认为,给药方案和药动学特征对对耐药菌的作用不仅仅只是富集那么简单,更涉及耐药菌的产生机制,而这样的机制和原因则需要在以后的工作中进一步研究。
[1]D'Costa V M,King C E,Kalan L,et al.Antibiotic resistance is ancient[J].Nature,2011,477(7365):457-461.
[2]Zhang Q,Lambert G,Liao D,et al.Acceleration of emergence of bacterial antibiotic resistance in connected microenvironments[J].Science,2011,333(6050):1764-1767.
[3]Hermsen R,Deris JB,Hwa T.On the rapidity of antibiotic resistance evolution facilitated by a concentration gradient[J].Proc Natl Acad SciUSA.2012,109(27):10775-10780.
[4] Greulich P,Waclaw B,Allen R J.Mutational pathway determines whether drug gradients accelerate evolution of drug-resistant cells[J].Phys Rev Lett.2012,24;109(8):088101.
[5] Pasipanodya JG,Gumbo T.A new evolutionary and pharmacokinetic-pharmacodynamic scenario for rapid emergence of resistance to single and multiple anti-tuberculosis drugs[J].Curr Opin Pharmacol,2011,5:457-463.
[6] Boak LM,Li J,Rayner C R,et al.Pharmacokinetic/pharmacodynamic factors influencing emergence of resistance to linezolid in an in vitromodel[J].Antimicrob Agents Chemother,2007,51(4):1287-1892.
[7]Drlica K,Zhao X.Mutant selection window hypothesis updated[J].Clinical Infectious Diseases,2007,44:681-688.
[8]Olofsson S K,Marcusson L L,Strömbäck A,et al.Dose-related selection of fluoroquinolone-resistant Escherichia coli[J].Journal of Antimicrobial Chemotherapy,2007,60:795-801.
[9]Gullberg E,Cao S,Berg OG,et al.Selection of resistant bacteria at very low antibiotic concentrations[J].PLoSPathog,2011,7(7):e1002158.
[10]杨雨辉,丁焕中,杨东,等.体外药动学模型中恩诺沙星对猪大肠杆菌的药效学研究[J].中国兽医科学,2007,7:636-670.
[11]曾振灵,冯淇辉.恩诺沙星在猪体内的生物利用度及药物动力学研究[J].中国兽医学报,1996,16(6):607-613.
[12]Zhao X,Eisner W,Perl-Rosenthal N,et al.Mutant prevention concentration of garenoxacin(BMS-284756)for ciprofloxacin-susceptible or-resistant Staphylococcus aureus[J].Antimicrob Agents Chemother,2003,47(3):1023-1027.
[13]Dong Y,Xu C,Zhao X,et al.Fluoroquinolone action againstmycobacteria:effects of C28 substituents on growth,survival and resistance[J].Antimicro Agents Chemother,1998,42:2978-2984.
[14]Drlica K.The future of fluoroquinolones[J].Ann Med,2000,32:585-587.
[15]Nakamura S.Mechanisms of quinolone resistance[J].J Infect Chemother,1997,3:128-138.
