家族性多发性硬化2 例报告并文献复习
2014-03-11秦新月
袁 潇,秦新月
多发性硬化(MS)为一累及中枢神经系统的炎性脱髓鞘疾病,MS 的发病原因及机制尚未完全明确,可能与遗传背景、环境因素、病毒感染、免疫调节等多方面相关,其中遗传因素作用较为重要。MS 有一定的家族聚集现象,患者亲属特别是同卵双生子的发病风险明显增高,目前我国家族性多发性硬化鲜见报告,现对一家系中两姐妹同患MS 做一报道,并结合近年的研究进展综合分析。
1 病例资料
病例1:患者女,42 岁,该患者于2009 年首次发病,主要表现为大小便障碍,双下肢无力,以左下肢明显,伴有双手麻木。同年于受凉后出现左侧肢体无力,伴有肋弓平面以下躯干及肢体麻木。2010 年再次出现左下肢无力,并伴有右下肢及右腹部麻木。查体:颅神经均正常,左下肢肌力Ⅳ级,膝反射活跃,可引出踝阵挛,双侧病理征阳性,右侧T5-T6 平面以下痛觉减退。头部及脊髓MRI 提示:C2 及C4-5 椎体水平颈髓内节段性长T1和长T2信号,T1-9 椎体水平胸髓内病灶长T1和长T2信号,其中T4-T5 椎体水平增强后强化明显(见图1A)。2011 年患者因双下肢麻木伴解便困难入院。查体:双下肢肌力Ⅳ级,左侧较差,左侧踝反射5+,右侧踝反射4+,双侧病理征阳性,右下肢痛觉减退,深感觉可疑减退。实验室检查提示体液免疫异常:血清补体C3 0.67 g/L、血清补体C4 0.11 g/L。血常规:红细胞3.74×1012/L、血红蛋白60 g/L。骨髓穿刺骨髓象提示缺铁。肝肾功能、电解质、凝血象、抗核抗体谱、抗O、CRP 未见明显异常。头部及脊髓MRI 提示:C2 及C4-5 椎体水平颈髓内节段性丝状长T1和长T2信号,T1-9 椎体水平胸髓内病灶长T1和长T2信号,其中T3-T4 椎体水平增强后呈节段性明显强化(见图1B)。
病例2:患者女,41 岁,为病例1 的妹妹,该患者于2012 年5 月首次发病,主要表现为左侧头颈部及前臂麻木,后出现四肢无力,双手强直性痉挛,伴有头晕及恶心呕吐,大小便困难。查体:四肢肌张力高,四肢肌力左侧较差,双膝反射活跃,左侧可引出踝阵挛,双侧病理征阳性,左侧偏身感觉减退,右侧C3-T7 感觉减退。血常规:白细胞2.75×109/L、红细胞3.20×1012/L、血红蛋白88 g/L。骨穿提示增生性骨髓象,内外铁阴性,考虑为缺铁性贫血。抗O:165 IU/ml。肝肾功能、凝血象、抗核抗体谱、类风湿因子、CRP、叶酸、维生素B12、乙肝两对半、HIV及梅毒检测未见明显异常。脑脊液蛋白:0.58g/L,脑脊液常规:细胞总数84×106/L,有核细胞数46×106/L,脑脊液及血中均未见寡克隆带。头部及脊髓MRI 提示:延髓及颈髓内见多发条片状长T1和长T2信号,增强后不均匀强化,其中C4 椎体水平颈髓可见环形强化(见图2A)。2012 年7 月,患者因左侧肢体无力伴视物成双入院。查体:四肢肌张力高,肌力Ⅳ级,左侧躯体感觉减退,双侧膝反(),左侧踝反射(),双侧巴氏征阳性。双眼视野、黄斑及视网膜未见明显异常。VEP:右视通路电活动差(P100:左95 ms,右111.5 ms)。头部及脊髓MRI提示:延髓及颈髓内条状长T1和长T2信号,有少许不均匀强化(见图2B)。
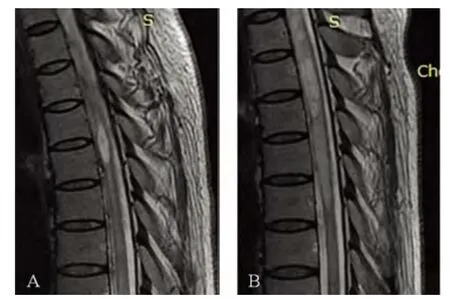
图1 病例1 磁共振T2WI
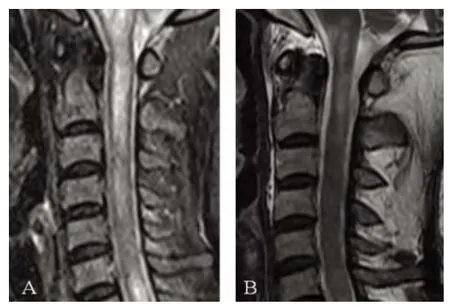
图2 病例2 磁共振T2WI
2 讨论
2.1 病例特点 该家系中2 例患者为中年女性,发病年龄相近,主要临床表现类似,均为肢体麻木乏力、大小便障碍,其中病例2 复发时出现视物成双。2 例患者均因合并贫血进一步行骨穿结果,提示缺铁性贫血。MRI 检查提示主要病灶部位均为脊髓,病例1 累及颈髓及胸髓;病例2 在累及颈髓、胸髓的同时累及延髓,急性复发时责任病灶明显强化。进一步送检水通道蛋白4(AQP4)抗体,二者结果均为阴性(滴度小于1∶10)。2 例患者均呈复发-缓解病程,就治疗措施看,急性复发时使用大剂量甲泼尼龙静滴冲击,继以泼尼松口服逐渐减量维持,经治疗后症状有缓解,两次复发间病情相对稳定。结合2例者的病程进展及影像学特点,均符合2010 年最新修订MS 的McDnonald 诊断标准。
2.2 发病风险 MS 多为散发,但仍有一定的家族聚集性,流行病学研究提示患者亲属的相对发病风险高于一般人群,特别是一级亲属,在兄弟姐妹中增高12~38 倍,父母中增高6~25 倍,子女中增高3~10 倍。瑞典一项研究纳入11154 名研究对象,标准化发病比(SIR)在MS 患者的子女为5.94(95%CI 4.88~7.16),在MS 患者的兄弟姐妹为6.25(95%CI 3.66~10.60),MS 患者的双生子同胞为9.09(95%CI 1.67~33.24)。而MS 配偶仅为1.50(95%CI 0.93~2.30),该数值基于总体人群无意义[1]。而一项荟萃分析在罹患风险上分析了不同人群,其中同卵双生子为18.44%,异卵双生子为4.61%,同父母的兄弟姐妹为2.68%,子女和父母分别为2.07%和1.45%,非同父母同胞者(half-sib)为1.89%,在侄甥(1.02%)、叔婶(0.75%)、堂(表)兄弟姐妹(0.73%)均位于中间值,无血缘关系的领养亲属(adoptee)的风险(0.13%)与一般人群(0.16%)相比没有明显增高,不同血缘关系呈现了不同梯度的发病风险值[2]。
2.3 遗传因素 对于MS 的病因及发病机制尚不完全明确,目前认为是遗传与环境因素共同作用的结果。研究表明MS 与人类白细胞抗原系统相关,其中HLA-DRB1*15:01 已被多项研究证实是主要的易感基因,但并非携带该基因一定发病,且2 个不同基因位点可能具有协同和抵抗作用,如基因易感作用可能在DR08 基因协同下增强,而因DR14、DR10、DR01 等基因的抵抗减弱[3]。传统方法对于识别遗传性单基因模式疾病的基因是一种有效工具,但对于MS 这类发病机制未完全明确的疾病,确定其基因表型却较为困难;而国际人类基因组计划及国际人类基因组单体型图计划的进展,则为MS进行全基因组关联研究(GWAS)提供了可能[4]。如一项关于欧洲人群的GWAS 研究发现,位点磷脂酰肌醇聚糖5(GPC5)等;一项由澳大利亚和新西兰联合完成的研究发现了甲基转移酶样1(METTL1)等位点;芬兰的一项研究发现了位点转录和转录激活因子3(STAT3);还有研究发现干扰素调节因子8(IRF8)、肿瘤坏死因子受体超家族1A(TNFRSF1A)等位点。而国际多发性硬化遗传学联盟(IMSGC)和维康信托基因会病例-对照协会(WTCCC2)联合进行了目前最大规模的GWAS,病例来源于15 个不同欧洲国家的23 个研究机构,目前已发现总共超过60 个易感位点与MS 相关[5]。但是即使最新的GWAS 研究也仅仅揭示了18%~24%的遗传性,其原因可能如下:通过相对较小型的研究,最小等位基因频率<5%的稀有变异型不易被察觉;通过表观遗传学的修饰调节,这种作用可能增强或减弱基因的表达,基因间作用可能互相影响从而改变各自的作用;通过基因的产物控制相应信号通路的参与,可能增强整个信号通路的作用,从而增加基因的易感性;染色体可能出现移位和倒位,也可能出现插入和缺失。这是复杂性状产生的原因,也可解释在家族性MS 患者中发病特点有相似之处,但不完全相同的现象[6]。
2.4 环境因素 MS 发病同样与环境因素相关,发病风险不归因于家庭的小环境,环境因素在整个人群水平中起调控作用。病毒感染为MS 发病的因素之一,目前EB 病毒被认为是易感因素,具体机制可能与其破坏及通过血脑屏障相关,但由于其在普通人群中的血清阳性率过高(成人约为95%),导致进一步研究其与MS 相关性较为困难[7]。流行病学早期就发现MS 在高纬度地区发病人群较多,近期发现与阳光暴露及维生素D 合成有关。一项研究表明,CYP27B1 基因的变异型可使蛋白失去酶活性,25 羟-维生素D 无法转变为有生物活性的1,25-二羟维生素D。基因序列提示维生素D 反应元件与HLA-DRB1*15 启动相关,可通过基因表达1,25-二羟维生素D,调控HLA-DRB1*15 表达的敏感性[8]。这说明环境作为一个触发点,可能通过增高或减低基因表达决定发病的作用,只有在某种环境条件下,基因才按特定方式表达,MS 发病取决于易感基因与环境因素的交互作用。
[1]Hemminki K,Li X,Sundquist J,et al.Risk for multiple sclerosis in relatives and spouses of patients diagnosed with autoimmune and related conditions[J].Neurogenetics,2009,10:5-11.
[2]O’Gorman C,Lin R,Broadley SA,et al.Modelling genetic susceptibility to multiple sclerosis with family data[J].Neuroepidemiology,2013,40:1-12.
[3]Ramagopalan SV,Knight JC,Ebers GC.Epistasis:multiple sclerosis andthe major histocompatibility complex[J].Neurology,2009,72:566-579.
[4]Gourraud PA,Harbo HF,Hauser SL,et al.The genetics of multiple sclerosis:an up-to-date review[J].Immunol Rev,2012,248:87-103.
[5]Sawcer S,Hellenthal G,Pirinen M,et al.Genetic risk and a primary role for cell-mediated immune mechanism in multiple sclerosis[J].Nature,2011,476:214-219.
[6]Lin R,Chalesworth J,Taylor BV,et al.The genetics of multiple sclerosis[J].Pract Neurol,2012,12:279-288.
[7]Casiraghi C,Dorovini-Zis K,Horwitz M.Epstein-Barr virus infection of human brain microvessel endothelial cells:a novel role in multiple sclerosis[J].J Neuroimmunol,2011,230:173-177.
[8]Handunnetthi L,Ramagopalan SV,Ebers GC.Multiple sclerosis,vitamin D,and HLA-DRB1*15[J].Neurology,2010,74:1905-1910.
