中国东北部吉兰-巴雷综合征临床及电生理表现
2014-03-11逄紫千王可人叶玉琴
逄紫千,王可人,朱 丹,叶玉琴
吉兰-巴雷综合征(GBS)是一种周围神经系统的炎症性脱髓鞘性疾病。临床上主要表现为急性进展性对称性弛缓性瘫痪可伴感觉障碍、腱反射减弱或消失及脑脊液蛋白-细胞分离现象,并常累及颅神经及自主神经,出现相应神经功能障碍[1]。GBS 的发病率约为0.6/10 万~4/10 万,男性发病率约为女性的1.5 倍[2]。通常下肢先受累并快速进展至上肢,常伴有颅神经及自主神经系统症状。40%~70%的患者在起病6 w 内有前驱感染史[3]。GBS 通常分为急性炎症性脱髓鞘性多发性神经病(AIDP)及急性运动轴索型神经病(AMAN)。据报道,AIDP是欧美国家最常见的亚型,90% 以上的患者为AIDP[4],而AMAN 相对少见,在英国大约占7%[5],北美约占5%~10%[6],而在亚洲AMAN 较为常见,日本约占40%[7],中国约65%[8]。神经电生理检查对于GBS 的诊断具有重要作用,但是GBS 早期阶段尤其是起病7 d 内的神经电生理表现尚未明确,静脉注射免疫球蛋白(IVIg)是治疗GBS 的主要方法之一,但是IVIg 对于起病2 w 后及对于症状较轻(可独立行走)的患者,其治疗效果尚不明确[4]。目前关于中国东北部GBS 的临床及电生理研究相对较少,因此,本研究收集了138 例明确诊断为GBS的患者,回顾性分析了其临床及电生理表现。
1 材料和方法
1.1 研究对象 回顾性分析了138 例于吉林大学第一医院神经内科住院的GBS 患者,所有患者均来自吉林省,且符合GBS 的诊断[9]。患者的临床评分采用Hughes 评分:0 级,正常;1 级,可跑步,仅有轻微症状及体征;2 级,独立行走5 米以上;3 级,帮助下行走5 米以上;4 级,卧床;5 级,需要辅助通气[10]。患者分为严重组(不能独立行走,Hughes 评分≥3 分)及轻微组(可独立行走,Hughes 评分≤2分)。
1.2 神经电生理检查 所有患者使用丹麦Keypoint 4CH 肌电图诱发电位仪行神经电生理检查,维持温度32 ℃以上,行上肢正中神经、尺神经,下肢胫神经、腓总神经运动传导检测;上肢正中神经、尺神经,下肢腓浅神经、腓肠神经感觉传导检测;正中神经、尺神经F 波检测及下肢胫神经H 反射检测;并行伸指总肌及胫前肌肌电。检测指标包括复合肌肉动作电位(CMAP)波幅、远端潜伏期、运动传导速度(MCV)、传导阻滞(CB)、感觉神经动作电位(SNAP)波幅、感觉传导速度(SCV)、F 波及H 反射潜伏期。各指标以我院神经内科肌电图室正常指标为参考。根据神经电生理标准[4],将患者分为AIDP及AMAN。
1.3 统计学处理 各电生理指标比较采用卡方检验,P<0.05 有统计学意义。
2 结果
2.1 临床表现 患者平均年龄32 岁(3~75岁)。138 例患者中,男性86 例,女性52 例。14 岁及以下儿童患者33 例(24%),成人患者105 例(76%)。81 例患者(59%)发病前存在上呼吸道或消化道感染史。其中存在消化道感染史者为51 例,占存在感染史患者的63%。134 例患者(97%)存在肢体无力,其中以四肢无力最为常见(51%)。详细临床表现(见表1)。135 例患者进行了IVIg 治疗,113 例(84%)患者症状改善(以Hughes 评分改善1 分以上为标准),患者分为2 w 内治疗组(113例)及2 w 后(22 例)治疗组,行组间比较,IVIg 治疗效果无显著差异(P>0.05);再将患者分为严重组(99 例)及轻微组(36 例)进行比较,治疗效果也无显著差异(P>0.05)。
2.2 电生理表现 起病7 d 内行电生理检查者20 例,8~14 d 者53 例,14 d 后者65 例。详细电生理数据(见表2)。3 个时期内均以CMAP 波幅降低、F 波及H 反射异常最常见,且各时期之间无显著差异。感觉传导检测异常在各时期均较少见。根据电生理标准,66 例(48%)患者为AIDP,33 例(24%)为AMAN,余患者不可分类。

表1 138 例GBS 患者临床表现
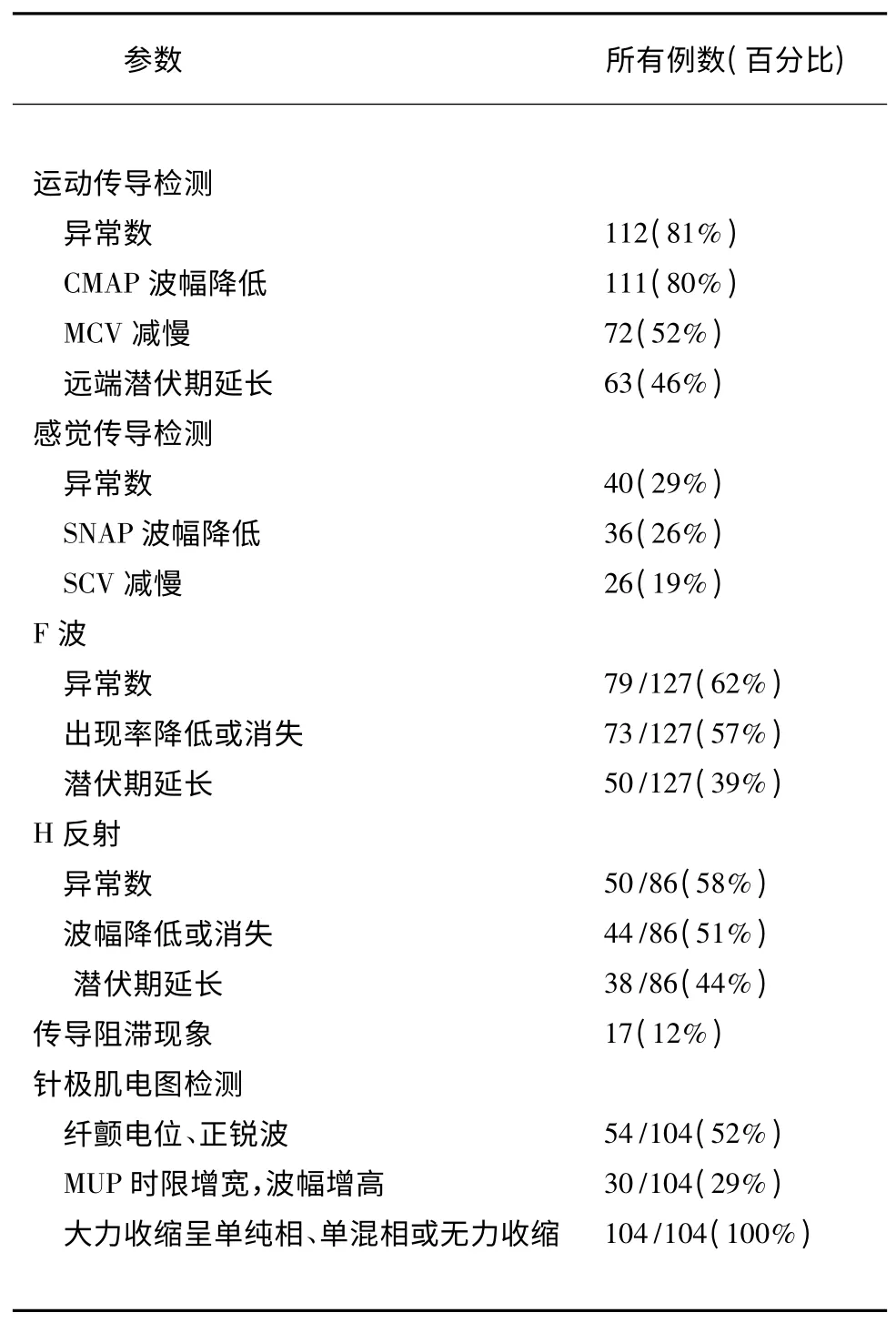
表2 GBS 患者神经电生理表现
3 讨论
GBS 是常见的周围神经系统免疫性疾病。研究发现男性发病率较女性高,约为1.5∶1,儿童发病率略低,约0.5/10 万,但发病率随年龄增长而相应增加,30 岁以下为1/10 万;75 岁以上为4/10 万[2]。40%~70%的患者在起病6 w 内有前驱感染史[3]。通常来说,56%的患者肢体无力由下肢开始逐渐发展至上肢,32%的患者表现为四肢同时受累[11]。既往报道AMAN 在中国为主要的GBS 亚型(约占65%)。但据目前报道,中国南方地区以AIDP 为主,且其出现率远高于中国北方地区,与欧美等国比例类似[12]。在我们研究的东北地区138 例患者中,大部分患者为中青年(平均年龄32 岁),仅1 例患者大于75 岁。59%的患者存在前驱感染史,且主要为胃肠道感染。临床主要表现为四肢无力及腱反射减退或消失(97%),且以四肢同时无力为主要表现,仅38%的患者出现感觉障碍。AIDP 占48%而AMAN 占24%,说明在我国东北部,仍以AIDP 为主要类型,AMAN 的比例相对较低,但较中国南方地区高。我们考虑AMAN 可能更常见于流行性GBS,而散发性GBS 中AMAN 较少见。72%的患者起病时较严重且IVIg 治疗通常有效(84%)。目前关于IVIg 对于GBS 起病2 w 后及对轻型患者治疗效果有待确定,既往法国一项研究显示对于轻型患者倾向于血浆置换[13]。根据我们的研究结果显示,IVIg对于起病2 w 后及对轻型患者同样有效。
神经电生理检查对于诊断GBS 具有重要意义。在我国南方地区,GBS 常见的电生理主要表现为:运动潜伏期延长、MCV 及SCV 减慢、传导阻滞、F 波潜伏期延长[12]。我们的研究结果显示,81%的患者存在运动传导检测异常(主要为CMAP 波幅降低,为80%)其次为F 波及H 反射异常,分别为62% 及58%,仅29%的患者出现感觉神经传导检测异常,传导阻滞仅见于12%的患者,这提示在我国东北部地区,GBS 以运动神经纤维损伤为主,感觉神经损伤相对少见。近年来,关于早期GBS 的诊断开始引起重视,有研究显示,MCV 减慢、远端潜伏期延长、F波异常及传导阻滞在GBS 起病3w 内较为明显[14]。美国一项研究显示波形离散、F 波、H 反射及瞬目反射异常在起病10 d 内较常见[15]。最近西班牙的一项研究发现在GBS 早期电生理主要表现为CMAP远端潜伏期延长及波幅降低[16]。根据我们的研究结果,在中国东北部,CMAP 波幅降低、H 反射及F波异常是GBS 起病7 d 内的主要电生理表现,且该表现与起病8~14 d 及14 d 后的表现无显著差异。在20 例7 d 内行电生理检查的患者中,8 例患者符合AIDP,3 例患者符合AMAN 的电生理诊断标准,这提示,对于初步诊断GBS 的患者,可超早期进行电生理检查来进行辅助诊断。
综上所述,中国东北部GBS 有特殊的临床及电生理表现,大部分患者为中青年,且起病时较严重,患者多有胃肠道感染史。起病时以四肢同时无力最常见,IVIg 治疗在患者症状轻重及起病时间长短方面效果相似,均有显著疗效。AIDP 为中国东北部地区GBS 的主要类型。在GBS 各个阶段,电生理方面均以CMAP 波幅降低、F 波及H 反射异常为主要表现,可以进行超早期电生理检查以辅助诊断GBS。
[1]Weinberg DH.Aaem case report 4:Guillain-barre syndrome.American association of electrodiagnostic medicine[J].Muscle Nerve,1999,22(2):271-281.
[2]Bogliun G,Beghi E.Incidence and clinical features of acute inflammatory polyradiculoneuropathy in lombardy,Italy,1996[J].Acta Neurol Scand,2004,110(2):100-106.
[3]McGrogan A,Madle GC,Seaman HE,et al.The epidemiology of guillain-barre syndrome worldwide.A systematic literature review[J].Neuroepidemiology,2009,32(2):150-163.
[4]Hughes RA,Cornblath DR.Guillain-barre syndrome[J].Lancet,2005,366(9497):1653-1666.
[5]Rees JH,Gregson NA,Hughes RA.Anti-ganglioside gm1 antibodies in guillain-barre syndrome and their relationship to campylobacter jejuni infection[J].Ann Neurol,1995,38(5):809-816.
[6]Vucic S,Kiernan MC,Cornblath DR.Guillain-barre syndrome:An update[J].J Clin Neurosci,2009,16(6):733-741.
[7]Ogawara K,Kuwabara S,Mori M,et al.Axonal guillain-barre syndrome:Relation to anti-ganglioside antibodies and campylobacter jejuni infection in Japan[J].Ann Neurol,2000,48(4):624-631.
[8]Ho TW,Mishu B,Li CY,et al.Guillain-barre syndrome in northern china.Relationship to campylobacter jejuni infection and anti-glycolipid antibodies[J].Brain,1995,118(3):597-605.
[9]Asbury AK,Cornblath DR.Assessment of current diagnostic criteria for guillain-barre syndrome[J].Ann Neurol,1990,27(Suppl):21-24.
[10]Hughes RA,Newsom-Davis JM,Perkin GD,et al.Controlled trial prednisolone in acute polyneuropathy[J].Lancet,1978,2(8093):750-753.
[11]Cosi V,Versino M.Guillain-barre syndrome[J].Neurol Sci,2006,27(Suppl 1):47-51.
[12]Hui AC,Chow KM,Tang AS,et al.Electrophysiological,clinical and epidemiological study of Guillain-Barre Syndrome in Hong Kong Chinese[J].J Clin Neurosci,2005,12(2):134-136.
[13]Appropriate number of plasma exchanges in guillain-barre syndrome.The french cooperative group on plasma exchange in guillain-barre syndrome[J].Ann Neurol,1997,41(3):298-306.
[14]McLeod JG.Electrophysiological studies in the guillain-barre syndrome[J].Ann Neurol,1981,9(Suppl):20-27.
[15]Vucic S,Cairns KD,Black KR,et al.Neurophysiologic findings in early acute inflammatory demyelinating polyradiculoneuropathy[J].Clin Neurophysiol,2004,115(10):2329-2335.
[16]Alberti MA,Alentorn A,Martinez-Yelamos S,et al.Very early electrodiagnostic findings in guillain-barre syndrome[J].J Peripher Nerv Syst,2011,16(2):136-142.
