重症肌无力患者电生理检查的特点
2014-03-11张雪玲
杨 永,张雪玲,徐 运
重症肌无力(myasthenia gravis,MG)主要是由抗乙酰胆碱受体介导的,补体参与、细胞免疫依赖性的自身免疫性疾病。该病是目前抗原、抗体最为明确的自身免疫性疾病之一,也是神经肌肉接头传递障碍疾病中最常见的类型[1]。目前针对MG 的诊断无特异性的方法,确诊需结合病史、临床表现、疲劳试验和胆碱酯酶抑制剂试验、电生理检查、抗体测定以及其他相关的实验室辅助检查结果进行综合分析[2]。
电生理检查对MG 的诊断有极为重要的价值,受成本、操作技术等因素的限制目前国内最常用的电生理技术为RNS。MG 患者全身骨骼肌均可受累,其临床表现多变,诊断存在一定难度。在诊断时应与肌病相鉴别。NEMG 对于二者的鉴别有重要意义,对于怀疑MG 的患者有必要进行NEMG 检查。国内外文献曾报道MG 患者NEMG 检查结果可有异常表现[3]。而国内少有相应文献报道。本研究通过分析近5 y 在我院治疗的50 例MG 患者的电生理检查结果,总结其特性,以进一步探求MG 电生理检查的特点。
1 材料和方法
本研究所有的患者资料均来自2009 年~2013年期间在南京鼓楼医院神经内科住院治疗的MG 患者。入组患者均符合MG 诊断标准[2]。所有的入组患者均有典型的临床表现,新斯的明试验阳性。入组患者均在我院肌电图室进行神经电生理检查。对入组患者的面神经、腋神经和尺神经进行RNS 检查(我院按照低频4 波与1 波比递减超过15%为异常),所有患者均行NEMG 检查。收集患者基本信息、临床资料和电生理检查结果建立数据库。按病情特点对患者进行Ossermen 临床分型。数据信息经整理后使用SPSS17.0 统计软件进行统计分析。定性数据间的分析比较用χ2检验,P<0.05 表示差异有统计学意义,P<0.01 表示具有显著统计学差异。
2 结果
50 例入组MG 患者中,Ⅰ型患者15 例,Ⅱ型30例(ⅡA 型11 例,ⅡB 型19 例),Ⅲ型4 例,Ⅳ型1例。RNS 结果阳性者为40 例,占到总患者的80%。对不同临床分型患者的RNS 检查结果进行分析,Ⅰ型阳性率为40%;Ⅱ、Ⅲ型阳性率都超过了90%;Ⅳ型虽高达100%,但因数量较少故不能进行统计分析。对Ⅰ、Ⅱ、Ⅲ型患者RNS 检查结果进行分析,结果示Ⅰ型与Ⅱ、Ⅲ型阳性率差异有显著统计学意义(P<0.01),而Ⅱ、Ⅲ型患者间的结果无统计学差异(P>0.05)。
对不同神经刺激所得结果进行分析结果示:刺激腋神经、面神经和尺神经时RNS 阳性率分别为60%、58%和16%。结果提示腋神经、面神经的阳性率远高于尺神经,对数据进行统计后发现尺神经较面神经和腋神经均有显著统计学差异(P<0.01),而腋神经和面神经间阳性率的差异无统计学意义(P>0.05)(见表1)。
入组患者均接受NEMG 检查,29 例(58%)检查结果符合肌源性受损表现,即运动单位时限缩短,波幅降低及募集相异常,5 例(10%)有自发电位(见表1)。不同年龄组MG 患者的EMG 检查结果阳性率有明显差异,40 岁以上患者的EMG 检查异常阳性率大于16~40 岁MG 患者(见表2)。
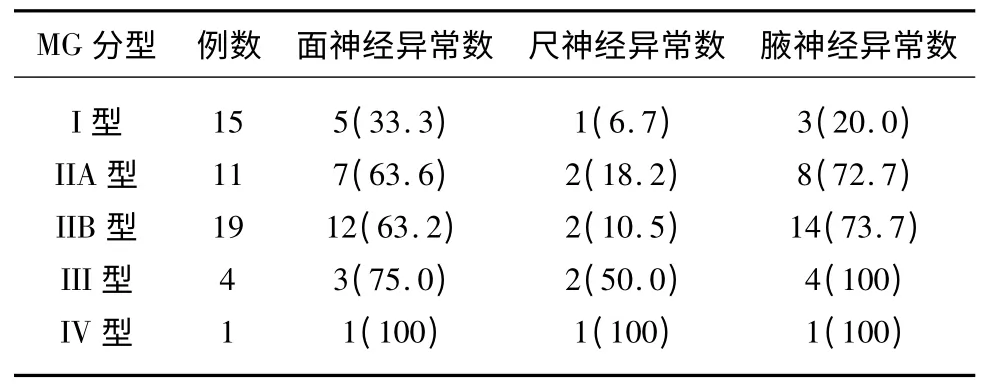
表1 MG 各临床分型的RNS 检查结果[例数(%)]

表2 不同年龄段MG 患者EMG 检查结果比较[例数(%)]
3 讨论
MG 的发病机制复杂,目前认为主要是由于机体对AChR 的异常免疫应答导致神经肌肉接头之间递质传递发生障碍而引起。有关MG 的发病机制复杂,目前仍不明确,涉及体液免疫、细胞免疫、并且病毒感染及遗传因素也发挥着重要的作用。其中由遗传因素引起的称为先天性MG,其可能是由于患者的基因变异引起,但该型患者在临床上罕见[4]。神经电生理检查在MG 的诊断中发挥着举足轻重的地位,RNS 技术始于19 世纪末,此后经过数十年的探索和完善,该技术逐渐成熟,至20 世纪中叶已成为常规检测手段,由于操作简便且无创RNS 检查是目前最常用于诊断MG 的电生理技术[5]。大量研究已证实RNS 诊断的灵敏性与MG 患者临床分型及刺激部位有关[1,6]。国内外文献均报道全身型MG 患者RNS 的异常率明显高于眼肌型患者,此外所选择的刺激神经和记录部位也对RNS 阳性率有较大影响,在近端肌肉记录时RNS 阳性率远高于远端肌肉记录所得结果,在无力症状明显的肌肉记录所得结果的阳性率高于在症状较轻或未受累肌肉进行记录所得结果[7]。在本研究中我们发现本研究的50 例MG 患者中,RNS 检查结果异常率达到了80%。除Ⅰ型异常率为40%外,其他临床类型的异常率均超过了90%。我们的研究再次证实RNS 异常率与临床分型密切相关。但我们的研究结果中RNS 异常率均高于以前的报道,这可能的一个原因可能是本研究入组的MG 患者中全身型的人数较多,而RNS异常率在该类患者中比率较高。另一个可能的原因可能是本研究中入组的患者均经确诊为MG 发病、并且病程较长、病情比较严重,此类患者RNS 异常率也较高。
国内文献报道对不同神经的检测结果的异常率差异较大,面神经的异常率大于尺神经、尺神经大于腋神经,三者的异常率依次为68.4%、32.1%、和12.7%[8]。本研究检测不同神经的RNS 异常率高低依次是腋神经、面神经和尺神经,异常率分别为:60%、58%和16%。检测近端肌肉时RNS 异常率比远端肌肉的高。本研究在小指展肌检测所测到的RNS 异常率明显低于三角肌、眼轮匝肌,这与文献报道一致[8,9]。虽然RNS 检测在近端肌肉具有更高的灵敏性,但是由于操作困难以及影响因素多,结果中出现假阳性的机率大。而在远端肌肉检测时虽然敏感性不如近端肌肉,但在技术上比较容易实现、影响因素少,所以结果也相对更稳定,准确性更高[10,11]。
对于MG 患者常规行NEMG 检查有助于与肌病相鉴别,然而部分MG 患者NEMG 检查可出现肌源性受损表现[3]。EMG 检查时MG 患者主要的表现是MUAP 波形的改变,这可能一方面神经肌肉接头传递障碍可使运动单位内肌纤维电位的时间离散,使多相波增多;另一方面是传递障碍还可使执行功能的肌纤维减少,使MUAP 呈现短时限、低波幅改变进行共同引起神经肌肉接头处递质传递障碍所致[12]。目前对于MG 患者NEMG 检查的相关研究报道较少,其出现异常的机制目前仍未完全明确。部分研究认为此类MG 患者可能合并肌肉病变,然而也有部分研究认为这可能是神经肌肉接头传递障碍造成的“假性”肌源性损害的表现[13,14]。在我们的研究中MUAP 时限缩短,募集相异常及波幅降低的患者为29 例(58%),有自发电位的患者为5 例(10%)。由此可见MUAP 改变是NEMG 异常的主要表现,肌源性受损及自发电位的出现的原因有待于肌肉活检及电镜检查进一步证实。经CT 辅助检查发现在出现自发电位的患者中伴发胸腺瘤患者高达4 例,而以往文献报道,胸腺瘤患者易出现自发电位,其原因不明[15]。因此对于NEMG 出现自发电位的患者应警惕胸腺瘤的可能。
另外,我们对各个年龄段MG 患者进行亚组分析,结果显示高年龄组患者EMG 检查异常率明显增高,原因可能为高龄MG 患者常常合并自身免疫性疾病,例如:甲状腺功能亢进、系统性红斑狼疮、多发性皮肌炎、类风湿性关节炎、吉兰-巴雷综合征等。需要引起我们临床医师重视,有利于高龄MG 患者的早期诊断和治疗,减少误诊和漏诊的发生。
通过本研究我们得到以下结论:RNS 技术是诊断MG 可靠的电生理方法。RNS 诊断的灵敏性不仅与MG 患者所属的临床类型有关,还与所检测的部位密切相关。EMG 检查时,MG 患者的主要表现为MUAP 时限缩短,募集相异常及波幅降低。部分患者可出现自发电位,对于合并自发电位的患者,应警惕胸腺瘤的可能。我们的工作充实了国内MG 电生理研究,进一步探索了MG 电生理检查的临床意义,但结论仍需大样本、多中心研究进一步证实。
[1]Spillane J,Beeson DJ,Kullmann DM.Myasthenia and related disorders of the neuromuscular junction[J].J Neurol Neurosurg Psychiatry,2010,81(8):850-857.
[2]中国免疫学会神经免疫学分会.重症肌无力诊断和治疗中国专家共识[J].中国神经免疫学和神经病学杂志,2012,19(6):401-408.
[3]Odabasi Z,Kuruoglu R,Oh SJ.Turns-amplitude analysis and motor unit potential analysis in myasthenia gravis[J].Acta Neurol Scand,2000,101(5):315-320.
[4]Benatar M.Pearls:myasthenia[J].Semin Neurol,2010,30(1):35-37.
[5]卢祖能.实用肌电图学[M].人民卫生出版社,2000.389-409.
[6]Zambelis T,Kokotis P,Karandreas N.Repetitive nerve stimulation of facial and hypothenar muscles:relative sensitivity in different myasthenia gravis subgroups[J].Eur Neurol,2011,65(4):203-207.
[7]Costa J,Evangelista T,Conceicao I,et al.Repetitive nerve stimulation in myasthenia gravis-relative sensitivity of different muscles[J].Clin Neurophysiol,2004,115(12):2776-2782.
[8]汤晓芙.神经系统临床电生理学(下)[M].人民军医出版社,2002.317-320.
[9]W itoonpanich R,Barakul S,Dejthevaporn C.Re la tive fatigab ility of musc les in response to repetitive nerve stim ulation in myasthenia g rav is[J].J M ed Assoc Tha,2006,89(12):2047-2049.
[10]Kouyoumdjian JA,Stalberg E.Stimulated jitter with concentric needle in 42 myasthenia gravis patients[J].Arq Neuropsiquiatr,2013,71(4):237-243.
[11]Lo YL,Leoh TH,Dan YF,et al.Repetitive stimulation of the long thoracic nerve in myasthenia gravis:clinical and electrophysiological correlations[J].J Neurol Neurosurg Psychiatry,2003,74(3):379-381.
[12]Somnier FE,Skeie GO,Aarli JA,et al.EMG evidence of myopathy and the occurrence of titin autoantibodies in patients with myasthenia gravis[J].Eur J Neurol,1999,6(5):555-563.
[13]张兴文,崔丽英,管宇宙,等.重症肌无力合并肌电图肌源性损害53 例临床和电生理特点[J].中华神经科杂志,2007,40(12):812-815.
[14]Samuraki M,Furui E,Komai K,et al.Myasthenia gravis presenting with unusual neurogenic muscle atrophy[J].Muscle Nerve,2007,36(3):394-399.
[15]Suzuki S.Autoantibodies in thymoma-associated myasthenia gravis and their clinical significance[J].Brain Nerve,2011,63(7):705-712.
