NLRP3 炎症小体在癫痫发病机制中的作用研究
2014-03-11张海清孔庆霞
张海清,孔庆霞
癫痫(epilepsy)是一种神经系统常见病,是大脑神经元异常放电导致的短暂性大脑功能障碍。近年来临床研究及动物实验均证实,炎症反应与癫痫的关系密不可分,脑内特定区域(兴奋性增高的病变组织)的炎症反应是其共同的本质特征[1],炎症反应可以降低痫性发作的阈值、增加神经元兴奋性、破坏血脑屏障、介导神经元凋亡及突触重塑[2]。目前已经发现多种炎性介质在癫痫患者或动物模型组中表达水平升高,其中包括白细胞介素-1β(IL-1β)。在难治性癫痫患者手术切除脑组织及癫痫动物模型中均证实存在IL-1β 表达水平异常升高[3~6],并且Ravizza 等发现患者脑组织中IL-1β 升高水平与其术前痫性发作的严重程度成正相关[5]。IL-1 受体拮抗剂(IL-1ra)或者抑制IL-1β 合成能有效发挥抗痫作用[7]。NLRP3 炎症小体是一种存在于细胞胞浆中的多蛋白复合物,主要是由NOD 样受体(NODlike receptor 3,NLRP3)、凋亡相关点状蛋白(apoptosis-associated speck-like protein,ASC)和磷酸化的半胱氨酸天冬氨酸酶-1(caspase-1)前体相互结合形成的。NLRP3 炎性小体能使磷酸化的caspase-1 去磷酸化,活化的caspase-1 促进IL-1β、白介素-18(IL-18)炎性因子前体的成熟,由此可见NLRP3 炎性小体活化是IL-1β 成熟的关键。尽管临床研究及动物实验均证实IL-1β 在癫痫中表达上调,但是目前国内外尚没有关于NLRP3 炎症小体与癫痫发作关系相关研究。本研究通过检测癫痫大鼠海马组织不同时间点NLRP3 炎症小体表达,探讨NLRP3 炎症小体是否参与癫痫诱导炎症反应及其作用机制,将可能为癫痫治疗提供新的方向。
1 材料和方法
1.1 材料及实验分组 健康雄性Wistar 大鼠60 只,鼠龄2 m,由山东鲁抗实验动物中心提供(生产许可证scxk 鲁20130001),体重250~300 g。按随机数字表法将大鼠分为癫痫24 h、48 h、72 h 组,每组10 只,及正常对照组、7 d 组,每组15 只。匹罗卡品、氯化锂(美国SIGMA);兔抗大鼠NLRP3、ASC、caspase-1 及羊抗兔IgG 单克隆抗体(美国Santa Cruz),兔抗大鼠GFAP-Cy3 标记(美国abcam)、兔抗大鼠Iba1(日本wako)、FITC 标记驴抗兔二抗(美国abcam);总RNA 提取试剂盒(上海生物工程有限公司),逆转录试剂盒、荧光定量试剂盒(北京天根生物科技),引物由上海生物工程有限公司设计合成;DYY-11 型电泳仪(北京六一仪器厂),BIORAD 凝胶成像系统(美国BIO-RAD);Leica 荧光显微镜(德国莱卡);大鼠IL-1βELISA 试剂盒(武汉博士德);Themro 酶标仪(Themro)。
1.2 动物模型制备 氯化锂-匹罗卡品法制备癫痫模型,方法如下:大鼠腹腔内提前18~20 h 预先注射氯化锂(LiCl)127 mg/kg(利用氯化锂与匹罗卡品的协同作用),第2 天提前30 min 预先给予大鼠腹腔注射溴化甲基阿托品1 mg/kg,以减少外周胆碱能反应,30 min 后实验组腹腔注射新鲜配置的匹罗卡品(PILO)30 mg/kg(对照组注射0.9%的生理盐水替代匹罗卡品)。大鼠在匹罗卡品注射后可出现外周胆碱能反应、刻板动作、癫痫发作直至全身强直-阵挛癫痫大发作。按照Racine 癫痫行为标准观察记录大鼠行为30 min,若大鼠未达到Racine 分级的IV~V 级的痫性发作,则可以追加匹罗卡品的剂量,每隔10 min 重复注射匹罗卡品一次,每次为10 mg/kg,最大追加剂量可达60 mg/kg。只有发作级别达Racine 分级IV~V 级才能进入后续实验。所有大鼠达IV~V 级痫性发作1 h 后腹腔注射地西泮10 mg/kg,以终止发作,降低死亡率。对造模失败大鼠通过随机抽样原则作及时补充,以保证各实验组大鼠数量恒定。
1.3 癫痫动物模型评定标准 采用1972 年的Racine 标准,Racine 标准共分6 级,其中I、II、III 级为复杂部分性发作;IV、V 为部分性发作继发的全身性发作。0 级:行为正常,无抽搐发作;I 级:面部阵挛,包括眨眼、动须、节奏性咀嚼等;II 级:面部痉挛+节律性点头;III 级:面部痉挛+节律性点头+单侧前肢肌阵挛,但无后肢直立位;IV 级:面部痉挛+节律性点头+双侧前肢阵挛+后肢直立位;V 级:全面性强直-阵挛发作,并失去体位控制。动物出现Racine IV 级以上发作并存活者入组。SE 出现当天记为0 d。
1.4 检测指标及方法
1.4.1 组织取材及处理 各组大鼠于各观察时间点采用10%水合氯醛(0.3~0.4 ml/100 g)腹腔注射麻醉,待大鼠眨眼反射消失时,仰卧位,四肢稍固定,局部消毒后打开腹腔,轻柔拨开脏器暴露腹主动脉,用5 ml 注射器取血,将血注入促凝管中,室温静止2 h 后离心取上清,-80 ℃冻存备用。腹主动脉取血后立即脱颈处死大鼠,断头取出大脑,并且立即冰上分离获取海马,将海马迅速放入液氮中保存。各组10 只大鼠其中随机抽5 只用于提取蛋白,各组中剩余5 只用于提取组织RNA。正常对照组及造模后7 d 组剩余5 只大鼠上述方式麻醉,依次以0.9%生理盐水及4%多聚甲醛经心脏灌注固定,分离脑组织置于4%的多聚甲醛中继续固定12 h(4 ℃),后经30%蔗糖脱水沉底,行冰冻连续冠状位切片,切片厚15 μm,用于免疫荧光染色。
1.4.2 免疫蛋白印记(Western blot)冰上研磨海马组织,加入裂解液及蛋白酶抑制剂(RIPA)充分裂解细胞,冰上研磨40 min,离心组织匀浆4 ℃12000 r/min×30 min,取上清,即为得到组织总蛋白。BCA 法测定蛋白浓度,绘制标准曲线,计算蛋白质浓度。所得蛋白质加入5×蛋白上样缓冲液并热变性备用。各组分别取50 μg 进行SDS-PAGE 电泳,湿转法转膜并封闭,与NLRP3、ASC、caspase-1 一抗4 ℃孵育过夜,TBS-T 洗去一抗后加二抗孵育2 h,用ECL 化学发光剂显影,在BIO-RAD 凝胶成像系统图像分析系统曝光并定量分析条带的光密度值。
1.4.3 免疫荧光染色 将冰冻切片常温下复温30 mins,加5%山羊血清封闭2 h,加入抗GFAP(Cy3 标记)及Iba1 一抗4 ℃孵育过夜,PBS 洗3次,加入FITC 标记驴抗兔二抗,避光室温条件孵育1 h,PBS 洗净后加入DAPI 染色3 min,PBS 洗3 次,抗荧光衰减封片剂封片,激光共聚焦显微镜下观察。
1.4.4 荧光定量PCR(RT-PCR)用Trizol 试剂提取大鼠海马组织总RNA,研钵中加液氮研磨海马组织,组织研磨至粉末状时按RNA 提取试剂盒说明书提取海马组织总RNA,逆转录为cDNA,以1 μl cDNA 为模板行PCR 扩增,实时定量PCR 样品反应体系采用SYBR Green I,其最终的反应体系20 μl。NLRP3 上游引物:5’-GCAAGAGGTGCTGATGAAGA-3’,下游引物:5’-CCTTTCTCGGGTGGGTAATC-3’;ASC 上游引物:5’-TTGCTGGATGCTCTGTATGG-3’,下游引物:5’-CCAAGTAGGGCTGTGTTTGC-3’;caspase-1 上游引物:5 ’-AGATGCCAACCACTGAAAGG-3’,下游引物:5’-GCATGATTCCCAACACAGGT-3’;β-actin 上游引物:5’-CATCACTATCGGCAATGAGC-3’,下游引物5’-GACAGCACTGTGTTGGCATA-3’。PCR 循环条件为:95 ℃ 15 min,95 ℃变性10 s,60 ℃32 s,40 个循环。每个样品均设置相应未经逆转录的模板作为阴性对照,绘制NLRP3、ASC、caspase-1、β-actin 的荧光曲线和溶解曲线,并得到各自的荧光域值循环数(Ct 值),采用相对定量法2-△△Ct 进行计算实验组相对与对照组的基因表达量。
1.4.5 ELISA 严格参照ELISA 试剂盒说明书检测IL-1β,以空白调零,450 nm 波长检测各孔光密度D(λ)值。
1.5 统计学方法 采用SPSS 19.0 统计软件分析数据。实验结果以均数±标准差(±s)表示,多组间均数比较采用单因素方差分析,P 值<0.05认为差异有统计学意义,两组间均数比较采用两独立样本t 检验,P 值<0.05 认为差异有统计学意义。
2 结果
2.1 造模情况 实验组大鼠腹腔注射匹罗卡品10~40 min 后开始出现外周胆碱能反应:立毛、抖动、流涎、流泪等;刻板行动:凝视、吸鼻、反复点头等;随后出现癫痫发作:咀嚼或动须、节律性点头、湿狗样抖动、前肢及后肢痉挛、最后出现全身强直-痉挛发作并跌倒。按照Racine 分级标准,只有达到IV级及以上的大鼠进入后续试验,癫痫达IV 级以上发作后1 h 腹腔注射地西泮终止其发作,此时大鼠活动减少。造模成功率为83.3%,死亡率10%(60 只大鼠,50 只成功建立模型,其中3 只在造模后24 h内死亡,2 只在造模后48 h 内死亡),模型成功后注意保暖,加强呼吸道及体液管理能有效降低模型死亡率。对照组大鼠腹腔注射生理盐水,无任何抽搐表现,行为正常。
2.2 免疫蛋白印记Western blot 检测各组NLRP3 炎症小体表达情况 各时间点致痫组大鼠海马NLRP3、ASC、caspase-1 蛋白的表达较对照组均有明显增加,差异具有统计学意义(P<0.05)。结果显示NLRP3 炎性小体各部分随时间延长逐渐增加,并于72 h达高峰,癫痫发作7 d 后炎性小体表达稍下降,但仍高于正常对照组,差异有统计学意义(P<0.05)。
2.3 GFAP 与Iba1 免疫荧光双重染色荧光显微镜(×400 倍)下观察,造模后7 d,与对照组比较模型组海马CA3区星形胶质细胞(红色)和小胶质细胞(绿色)增生现象明显(P<0.05),差异有统计学意义。
2.4 荧光实时定量PCR(RT-PCR)检测海马组织NLRP3 炎症小体各部分mRNA 的表达 采用2-△△Ct(RQ)法计算目的基因相对表达率。从扩增曲线和溶解曲线中可以看出,荧光定量PCR 反应中目的基因及内参得到了扩增,并且扩增产物单一,所得实验结果可信。统计结果显示各致痫组NLRP3 炎性小体mRNA 表达量均显著高于正常对照组,差异有统计学意义(P<0.05),在不同时间点的海马组织中NLRP3炎性小体各部分的相对表达量关系如下:照组<24 h组<48 h 组<7 d 组<72 h 组。
2.5 ELISA 检测大鼠血清中IL-1β 含量并分析其与海马组织中NLRP3 的相关性 统计结果显示:24 h、48 h、72 h、7 d 各致痫组血清中IL-1β 的含量较对照组高,其中以72 h 组水平最高,差异有统计学意义(P<0.05,见表1);另外分析结果显示IL-1β 与NLRP3炎性小体活化呈正相关(r=0.849,P=0.000)。
表1 不同时间点各组血清IL-1β 含量的变化及其与海马组织NLRP3 的相关性分析(±s,ng/L,n=10)
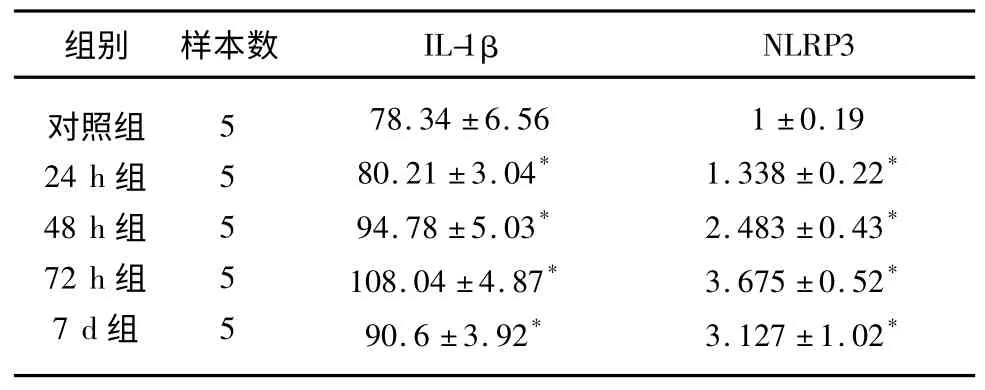
表1 不同时间点各组血清IL-1β 含量的变化及其与海马组织NLRP3 的相关性分析(±s,ng/L,n=10)
经t 检验,与正常对照组比较* P<0.05
3 讨论
天然免疫反应又称为固有免疫反应,是机体防御病原体的特异性第一道防线。吞噬细胞通过模式识别受体(pattern recognition receptor,PRR)识别病原相关分子模式(pathogen-associated molecular pattern,PAMP),促进多种炎性细胞因子释放及炎症反应,启动天然免疫反应。PRR 主要表达于固有免疫细胞表面,PRP 包括多种不同类型识别受体,近来研究较多的PRR 为NOD 样受体(NOD-like receptor,NLR)家族,NLRP3 即为NLR 家族成员之一,它可以识别病原相关分子模式(pathogen-associated molecular pattern,PAMP)以及损伤相关分子模式(damageassociated molecular pattern,DAMP)而被激活,在激活之后能够通过与接头蛋白凋亡相关的点状蛋白(apoptosis-associated speck-like protein,ASC)相互作用,活化半胱氨酸蛋白酶-1(caspase-1),形成蛋白复合物“炎症小体(inflammasome)”,进而诱导白介素(Interleukin,IL)-1β(IL-1β)和白介素-18(IL-18)的成熟与分泌。IL-1 介导的信号转导途径是组织炎症反应的开始,IL-1β 作为上游炎性因子能介导多种炎性因子表达上调,因此IL-1β 被称为“前炎性因子”[8]。研究发现NLRP3 炎症小体激活主要通过以下途径:(1)溶酶体破裂介导的激活途径,溶酶体裂解释放组织蛋白酶B,组织蛋白酶B 能进一步激活caspase-1,发挥切割白介素-1β 前体作用[9];(2)钾离子外流介导的激活途径,细胞外ATP 与ATP 门控的阳离子通道受体(P2X)家族亚型P2X7R 结合介导细胞内钾离子外流,细胞内低钾能有效促使NLRP3 炎症小体激活[10];(3)活性氧介导激活途径,线粒体损伤释放活性氧(ROS),ROS 使硫氧还蛋白相互作用的蛋白(thioredoxin-interacting protein,TXNIP)与硫氧蛋白(TRX)分离,TXNIP 与NLRP3 结合能招募ASC、pro-caspase-1 促进形成炎症小体[11]。研究发现NLRP3 炎症小体在多种疾病中被激活,其中包括家族性周期性自身炎症反应、2 型糖尿病、阿尔茨海默病、动脉粥样硬化症、脑梗死、多发性硬化症等。
以往研究发现在癫痫发作过程中,发生氧化应激损伤、线粒体裂解,释放ATP、ROS 水平升高[12]。另外近期有研究发现ATP 通过激活P2X7R 参与癫痫持续状态发病过程,在海马组织中P2X7R 表达上调,给予P2X7R 受体拮抗剂能减轻海马区域损伤[13]。Jimenez 等发现在癫痫患者及小鼠模型皮质中P2X7R 表达亦上调,特异性P2X7R 受体抑制剂A-438079 能有效小鼠痫性发作次数及严重程度[14]。由此可见,P2X7R 在癫痫的发病过程中发挥重要作用。目前关于癫痫与炎症反应的研究主要集中在各类炎性介质及其相应阻断剂的作用方面,至于NLRP3 炎症小体在癫痫中是否表达上调,其意义又如何,国内外未见有相关报道。
目前研究认为匹罗卡品可诱导动物出现数小时的癫痫持续状态,而引起一系列的层级反应最终导致特定脑区兴奋性增强,轴突出芽和功能性突触重建,能够较好模拟人类颞叶癫痫。本实验中应用氯化锂、匹罗卡品诱导SD 大鼠建立癫痫模型[15]。通过RT-PCR 检测发现发现模型组海马组织中的NLRP3、caspase-1 及ASC mRNA 表达与对照组相比有显著升高,Western blot 检测显示NLRP3、caspase-1及ASC 蛋白在模型组也明显增加。模型建立后NLRP3 炎症小体各部分均随时间变化逐渐上升,72 h左右达到最高峰,提示在癫痫发病过程中激活炎症反应,NLRP3 炎症小体参与癫痫发作后的炎症过程。本次实验还发现NLRP3 与IL-1β 之间有明显相关性,提示选择性抑制NLRP3 炎性小体活化或者特异性阻断caspase-1 活性可能有效抑制癫痫导致IL-1β 异常升高。在中枢神经系统中星形胶质细胞是调控ROS 生成、氧化应激、固有免疫和炎症反应的重要场所,小胶质细胞是中枢神经系统IL-1β 的主要来源。癫痫诱导胶质细胞活化可能是NLRP3炎性小体激活的潜在机制,仍需进一步实验证明。
综上所述,本实验结果证实了在急性癫痫发病过程中NLRP3 炎症小体被激活,但是需要指出的是,本研究目前只能反映NLRP3 炎性小体与癫痫急性期的相关性,其在癫痫中的发病机制,另外本实验没有对NLRP3 炎性小体进行组织定位。因此,需进一步研究NLRP3 炎症小体参与癫痫发病过程的具体机制,可以通过抑制NLRP3 炎性小体激活观察对癫痫大鼠细胞凋亡、炎症反应及认知功能的影响。为控制癫痫发作、研制新的神经保护剂提供新的方向。
[1]Vezzani A,French J,Bartfai T,et al.The role of inflammation in epilepsy[J].Nat Rev Neurol,2011,7(1):31-40.
[2]Xu D Miller SD,Koh S.Immune mechanisms in epileptogenesis[J].Front Cell Neurosci,2013,7:195.
[3]Ravizza T,Gagliardi B,Noe F,et al.Innate and adaptive immunity during epileptogenesis and spontaneous seizures:evidence from experimental models and human temporal lobe epilepsy[J].Neurobiol Dis,2008,29(1):142-160.
[4]Henshall DC,Clark RS,Adelson PD,et al.Alterations in bcl-2 and caspase gene family protein expression in human temporal lobe epilepsy[J].Neurology,2000,55(2):250-257.
[5]Ravizza T,Boer K,Redeker S,et al.The IL-1beta system in epilepsyassociated malformations of cortical development[J].Neurobiol Dis,2006,24(1):128-143.
[6]Boer K,Jansen F,Nellist M,et al.Inflammatory processes in cortical tubers and subependymal giant cell tumors of tuberous sclerosis complex[J].Epilepsy Res,2008,78(1):7-21.
[7]Mattia M,Silvia B,Teresa R.Interleukin-1beta biosynthesis inhibition reduces acute seizures and drug resistant chronic epileptic activity in mice[J].Neurotherapeutics,2011,8(2):304-315.
[8]Vezzani A,Friedman A,Dingledine RJ.The role of inflammation in epileptogenesis[J].Neuropharmacology,2013,69:16-24.
[9]Hornung V,Bauernfeind F,Rock KL,et al.Silica crystals and aluminum salts activate the NALP3 inflammasome through phagosomal destabilization[J].Nat Immunol,2008,9(8):847-856.
[10]Petrilli V,Papin S,Dostert C,et al.Activation of the NALP3 inflammasome is triggered by low intracellular potassium concentration[J].Cell Death and Differentiation,2007,14(9):1583-1589.
[11]Zhou R,Tardivel A,Tschopp J,et al.Thioredoxin-interacting protein links oxidative stress to inflammasome activation[J].Nature Immunology,2010,11(2):136-140.
[12]刘朝巍,张 涛,杨 卓.氧化应激损伤线粒体参与癫痫病理过程[J].中国病理生理杂志,2008,24(1):198-200.
[13]Kim JE,Kim DS,Kang TC,et al.The effect of P2X7 receptor activation on nuclear factor-κB phosphorylation induced by status epilepticus in the rat hippocampus[J].Hippocampus,2013,23(6):500-514.
[14]Jimenez-Pacheco A,Mesuret G,Sanz-Rodriguez A,et al.Increased neocortical expression of the P2X7 receptor after status epilepticus and anticonvulsant effect of P2X7 receptor antagonist A-438079[J].Epilepsia,2013,54(9):1551-1561.
[15]Glien M,Brandt C,Potschka H,et al.Effects of the novel antiepileptic drug levetiracetam on spontaneous recurrent seizures in the rat pilocarpine model of temporal lobe epilepsy[J].Epilepsia,2002,43(4):350-357.
