CYP3A5 基因多态性对汉族癫痫患者卡马西平稳态血药浓度及疗效的影响
2014-03-09刘建锋李艳春张国利湖南医药学院附属怀化市第三人民医院湖南怀化418000
刘建锋,李艳春,张国利,唐 强(湖南医药学院附属怀化市第三人民医院,湖南怀化 418000)
卡马西平(Carbamazepine,CBZ)可有效控制多种类型的癫痫发作,是治疗癫痫全面性强直-阵挛发作、部分性发作和继发性全身发作的首选药物之一,还用于治疗神经源性尿崩症和躁狂抑郁症等[1]。CBZ 用药剂量的个体差异较大,从每日200 mg 到1 200 mg 不等,治疗窗窄,血浆蛋白结合率较高,除约5%以原型排泄,其余主要经肝脏CYP3A4/5 代谢成10,11-环氧化卡马西平(CBZ-E)[2],代谢率在不同个体间最多可相差40倍[3]。CYP3A5的基因突变是产生酶活性差异的主要原因,CYP3A5*3在中国人中出现频率为71%~76%[4-5]。本研究考察了CYP3A5 与患者CBZ 稳态血药浓度的相关性,旨在为CBZ的个体化给药提供理论依据。
1 材料
1.1 仪器
LC-20A 高效液相色谱仪,配有7725i 六通阀、20 μl 定量环、N2000色谱数据工作站(日本岛津公司);Kromasil C18色谱柱(250 mm×4.6 mm,5 μm,瑞典AKZO NOBEL 公司);EDC-810 PCR 仪和ABI 3730XL DNA 测序仪等基因检测所用仪器由中南大学临床药理研究所提供。
1.2 药品与试剂
CBZ片(江苏恩华药业股份有限公司,规格:0.1 g×100片,批号:20100601);甲醇(天津市科密欧化学试剂有限公司,色谱纯,批号:20110210);基因检测所用试剂由中南大学临床药理研究所提供。
2 对象与方法
2.1 研究对象
所有对象均为我院2012 年4-12 月门诊、住院口服CBZ的汉族癫痫患者,共40例,详细记录患者一般资料、诊疗记录、用药信息等。纳入标准:(1)所有患者均依照1981年国际抗癫痫联盟(International League Against Epilepsy,ILAE)分类和诊断标准,经临床医师结合患者临床症状、脑电图及影像学检查(头颅MRI 或头颅CT)确诊为癫痫,无并发症,适合应用CBZ治疗的患者;(2)患者服用CBZ至少3个月,且未服用其他影响肝药酶活性的药物,年龄在20~60岁之间;(3)患者肝、肾功能的实验室检查指标均在正常范围。本研究方案经我院医学伦理委员会批准,所有患者或其家属均签署知情同意书。
为了消除服用剂量、患者体质量对血药浓度的影响,进行如下定义[6]:
标准化剂量=服药剂量/体质量
剂量校正浓度=血药浓度/服药剂量
标准化浓度=剂量校正浓度/体质量
2.2 基因分型与设计分组
提取外周血基因组DNA,通过聚合酶链反应-限制性内切片段长度多态性法(PCR-RFLP 法)确定该等位基因各基因型的分布(中南大学临床药理研究所代为检测),将野生纯合型(CYP3A5*1*1)基因序列归为A 组,而将杂合型(CYP3A5*3*3)基因序列归为B组。
2.3 卡马西平血清浓度的测定
因CBZ 对肝药酶有自身诱导作用,故本试验测定的血药浓度均在患者服药3个月或更改治疗方案4周后采血,采集方式为末次晚服药后,次日晨8~9 点服药之前采集静脉血,离心,分离血清,采用高效液相色谱法测定CBZ 的稳态血药浓度[7](测定方法已通过原卫生部临床检验中心室间质量评价)。
2.4 疗效和不良反应评价
观察5个以上平均发作间隔时间的疗效,疗效评定采用谭启富癫痫疗效评定标准[8]。不良反应的判断采用因果关系评定方法。
2.5 统计学方法
3 结果
3.1 不同基因型患者基本情况
40例符合入选条件的患者,归为A组的有27例,归为B组的有13例,通过检验,不同基因型的两组患者在性别、年龄、体质量等方面的差异无统计学意义(P>0.05),详见表1。
表1 不同基因型患者基本情况()Tab 1 General information of patients according to different genotype()

表1 不同基因型患者基本情况()Tab 1 General information of patients according to different genotype()
3.2 不同基因型患者CBZ给药剂量、血药浓度比较
不同基因型的两组患者CBZ 剂量、标准化剂量、血药浓度、剂量校正浓度、标准化浓度的比较详见表2。
表2 不同基因型患者CBZ给药剂量、血药浓度比较()Tab 2 Comparison of CBZ dose and serum concentrations according to different genotype()
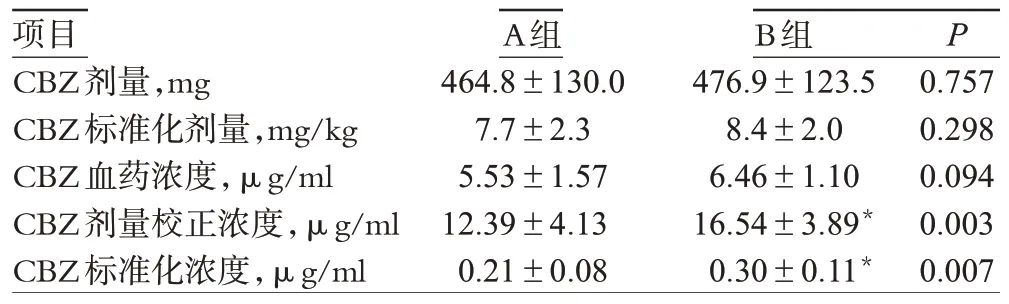
表2 不同基因型患者CBZ给药剂量、血药浓度比较()Tab 2 Comparison of CBZ dose and serum concentrations according to different genotype()
与A组比较:*P<0.05vs.group A:*P<0.05
从表2可以看出,不同基因型的两组患者CBZ剂量、标准化剂量和血药浓度的差异无统计学意义(P>0.05),而剂量校正浓度和标准化浓度的差异有统计学意义(P<0.05),杂合型基因携带患者剂量校正浓度和标准化浓度显著高于野生纯合型基因携带患者。
3.3 不同基因型患者疗效和不良反应比较
不同基因型的两组患者疗效和不良反应比较,差异均无统计学意义(P>0.05),详见表3。两组患者发生的不良反应包括头痛、胃肠道反应等,均较轻微、可耐受,均未见其他严重不良应发生。

表3 不同基因型患者疗效和不良反应比较(例)Tab 3 Comparison of therapeutic efficacy and ADR among patients according to different genotype(case)
4 讨论
癫痫是一种常见的多病因引起的反复发作性慢性脑部疾患,在神经科的发病率仅次于脑血管疾病,是常见病更是我国目前的重大疾病之一[9-11],临床上主要通过规范服用抗癫痫药物(Antiepileptic drugs,AEDs)来控制发作。作为其中经典一线药物的CBZ为钠通道调节剂,通过增强钠通道的灭活效能,限制突触后神经元高频动作电位的发散以及阻断突触前钠通道和动作电位发散,阻断神经递质的释放,从而调节神经兴奋性,产生抗惊厥、抗癫痫效应。尽管CBZ疗效肯定、应用广泛,但其治疗窗窄且其血药浓度、疗效存在明显的个体化差异[12]。
近年来,许多研究结果表明,个体间药物处置和反应差异35%~85%由遗传因素如单核苷酸多态性造成[13]。CBZ 的代谢基因CYP3A4 外显子编码区变异的频率大多小于5%[14],不会造成其代谢的巨大差异。而CYP3A5也是细胞色素P450酶系中重要一员,其表达在不同种族人群中呈多态分布,最常见、最重要的功能性CYP3A5 多态性为第三内含子的6 986 位的A→G 突变,这种突变使CYP3A5 酶活性降低或消失,故可能与CBZ的个体反应差异大相关。CBZ体内代谢物CBZ-E也具有类似的抗癫痫活性,应用CBZ 治疗后发生的一些不良反应与CBZ-E也有关[1]。
本研究对40 例服用CBZ 的癫痫患者进行CYP3A5 基因多态性的检测,未发现CYP3A5*1*3基因型。按基因型分组测定CBZ的血药浓度,通过比较发现,未校正血药浓度组间比较差异无统计学意义,而校正后血药浓度(剂量校正浓度、标准化浓度)组间比较差异均有统计学意义。剂量校正浓度和标准化浓度消除了剂量、体质量的影响而更具有临床参考意义。由此表明,CYP3A5 基因多态性可能是造成不同个体间CBZ 血药浓度差异的影响因素之一,这种差异表现为杂合型基因携带患者代谢减弱,其校正血药浓度显著高于野生纯合型基因携带患者。另外,不同基因型的两组患者疗效和不良反应比较差异无统计学意义,表明CYP3A5 基因多态性对CBZ治疗癫痫的疗效和不良反应可能无显著影响。
本研究表明,CYP3A5基因多态性可能是汉族癫痫患者不同个体间CBZ稳态血药浓度差异的影响因素之一。由于本研究病例有限,基因-剂量-效应的关系尚不明确,也未同时测定CBZ-E 的血清浓度,有待在以后的研究中扩大样本量以进一步确定CYP3A5 基因与CBZ 给药剂量、血药浓度的关系以及CBZ-E浓度对不良反应的影响。
[1]陈新谦,金有豫,汤光.新编药物学[M].17版.北京:人民卫生出版社,2011:215-216.
[2]Eichelbaum M,Tomson T,Tybring G,et al.Carbamazepine metabolism in man.Induction and pharmacogenetic aspects[J].Clinical Pharmacokinetics,1985,10(1):80.
[3]郭桂梅,任金岩,郭颖杰,等.抗癫痫药卡马西平疗效与血药浓度的相关性研究[J].中风与神经疾病杂志,2011,28(4):336.
[4]Fukushima-Uesaka H,Saito Y,Watanabe H,et al.Haplotypes of CYP3A4 and their close linkage with CYP3A5 haplotypes in a Japanese population[J].Hum Mutat,2004,23(1):100.
[5]Xie HG,Wood AJ,Kim RB,et al.Genetic variability in CYP3A5 and its possible consequences[J].Pharmacogenomics,2004,5(3):243.
[6]Park PW,Seo YH,Ahn JY,et al.Effect of CYP3A5*3 genotype on serum carbamazepine concentrations at steady-state in Korean epileptic patients[J].J Clin Pharm Ther,2009,34(5):569.
[7]张国阳,王守勇,徐建洋,等.102例癫痫患者卡马西平唾液浓度与血药浓度测定及其相关性研究[J].药学与临床研究,2009,17(6):475.
[8]江建东,姚一,张小斌,等.国内癫痫术后疗效评估方法的比较[J].立体定向和功能性神经外科杂志,2008,21(4):231.
[9]MacDonald BK,Cockerell OC,Sander JW,et al.The incidence and lifetime prevalence of neurological disorders in a prospective community-based study in the UK[J].Brain,2000,123(Pt 4):665.
[10]Rocca WA,Savettieri G,Anderson DW,et al.Door-todoor prevalence survey of epilepsy in three Sicilian municipalities[J].Neuroepidemiology,2001,20(4):237.
[11]Ding D,Hong Z,Wang WZ,et al.Assessing the disease burden due to epilepsy by disability adjusted life year in rural China[J].Epilepsia,2006,47(12):2 032.
[12]朱国行,吴洵昳,虞培敏,等.新诊断癫痫患者的规范化药物治疗[J].中华神经科杂志,2011,44(1):6.
[13]Evans WE,Mcleod HL.Pharmacogenomics--drug disposition,drug targets and side effects[J].N Engl J Med,2003,348(6):538.
[14]Hata M,Tanaka Y,Kyoda N,et al.An epoxidation mechanism of carbamazepine by CYP3A4[J].Bioorg Med Chem,2008,16(9):5 134.
