洛铂对比顺铂治疗晚期非小细胞肺癌疗效和安全性的Meta分析Δ
2014-03-09赵凤芝赵建夫暨南大学附属第一医院广州510632
赵凤芝,徐 萌,赵建夫(暨南大学附属第一医院,广州 510632)
肺癌已成为全世界发病率和死亡率最高的恶性肿瘤,其中非小细胞肺癌(NSCLC)占肺癌的80%以上[1]。化疗是晚期NSCLC 的主要治疗方法,其中含铂类[主要为顺铂(DDP)]药物的联合方案被认为是治疗晚期NSCLC最常用的方案[2-3],但DDP的毒副作用和易耐药性明显限制了其临床的应用。洛铂(LBP)是第三代铂类抗肿瘤药物,它与DDP 的抗肿瘤活性相似,但肾毒性、神经系统毒性和胃肠道反应较轻,且对DDP 无交叉耐药[3]。近年来,以LBP为主的联合化疗方案已开始应用于NSCLC,且显示了较好的临床疗效。但是,各研究较为分散、样本量较小,临床参考价值有限。同时,目前尚无以LBP为主的联合化疗方案治疗晚期NSCLC 的循证医学报道。因此,本研究采用Meta方法,系统评价了以LBP为主的联合化疗方案对比以DDP 为主的联合化疗方案治疗晚期NSCLC 的疗效和安全性,以为临床治疗提供循证参考。
1 资料与方法
1.1 纳入与排除标准
1.1.1 研究类型 国内外公开发表的随机对照试验(RCT)。
1.1.2 研究对象 经病理学或细胞学确诊证实的Ⅲ~Ⅳ晚期NSCLC 患者,且卡氏评分>60 分或体力状况(ECOG)评分为0~2分,心、肝、肾功能和血常规检查基本正常。
1.1.3 干预措施 试验组患者给予以LBP为主的联合化疗方案,对照组患者给予以DDP为主的联合化疗方案。
1.1.4 结局指标 疗效指标:①客观缓解率(ORR);安全性指标:②恶心呕吐发生率、③腹泻发生率、④白细胞减少发生率、⑤血小板减少发生率。ORR 为完全缓解(CR)和部分缓解(PR)的病例数之和,是肿瘤(主要是实体瘤)最常见的衡量疗效的指标。疗效评价标准为世界卫生组织(WHO)或其他实体瘤疗效评价标准(RECIST)。
1.1.5 排除标准 ①非临床试验研究;②不以LBP 为基础的联合化疗试验;③未提及有效的统计学数据;④非RCT。
1.2 文献检索
计算机检索Cochrane Library、PubMed、EMbase、中国期刊全文数据库(CNKI)、中国生物医学文献数据库(CBM)、维普数据库、万方数据库。检索时限从建库起至2013年12月。中文检索词:“洛铂”“顺铂”“非小细胞肺癌”“联合化疗”;英文检索词:“lobaplatin”“LBP”“Cisplatin”“DDP”“non-small cell lung cancer”“NSCLC”。
1.3 文献筛选和资料提取
由两位研究者独立阅读所获文献进行资料提取,并交叉核对。提取数据包括:文献发表的时间;试验组和对照组的干预措施;药物使用剂量;纳入标准和排除标准;样本量;一般资料,如年龄、临床分期;主要结局指标;失访及随访记录;不良反应;客观缓解率及中位生存期。对有分歧而难以确定的试验通过讨论决定其是否纳入。
1.4 质量评价
两位评价员独立选择试验、提取资料,按改良后的Jadad量表[评价的标准包括随机分配方法、分配方案隐藏、研究对象和治疗方案实施者和研究结果评价者是否采用盲法,有无失访和退出,有无进行意向性分析(ITT 分析),是否选择性报告结果]对RCT 的质量进行评价[4],对于每一个研究结果的内容作出“低度偏倚”“高度偏倚”和“不清楚”(缺少相关信息或偏倚情况不确定)的判断。总分为7 分,1~3 分为低质量研究,4~7分为高质量研究。对所纳入文献的发表是否存在偏倚和偏倚的大小采用倒漏斗图分析。
1.5 统计学方法
采用Cochrane 协作组提供的Rev Man 5.2 统计软件进行Meta 分析,计数资料采用相对危险度(RR)及其95%CI 表示。采用χ2检验和I2检验统计异质性。各研究间无统计学异质性(P>0.1,I2<50%)时,采用固定效应模型对各研究进行Meta分析;当各研究间存在统计学异质性(P≤0.1,I2≥50%)时,采用随机效应模型进行Meta分析,同时分析异质性来源,并进行亚组分析。异质性来源于低质量研究时,进行敏感性分析。若两组间异质性过大或无法找到数据来源时,就采用描述性分析。
2 结果
2.1 文献检索结果
初检出相关文献1 249篇,去重后通过阅读文题和摘要初步纳入文献15篇,进一步阅读全文,排除非RCT,最终纳入11篇文献[5-15],均是中文文献。11项RCT共纳入724例患者(试验组376例,对照组348例)。其中,LBP+培美曲塞(Pemetrexed)vs DDP+Pemetrexed 的2 篇[8-9],LBP+紫杉醇(TAX)vs DDP+TAX 的3 篇[6,10,12],LBP+长春瑞滨(NVB)vs DDP+NVB 的2篇[5,7],LBP+吉西他滨(GEM)vs DDP+GEM的3篇[11,13,15],LBP+多西他赛(Docetaxel)vs DDP+Docetaxel 1 篇[13],LBP+依托泊苷(Etoposide)vs DDP+Etoposide 1 篇[13]。进入分析的文献两组基线资料均具有可比性,纳入研究基本特征见表1。
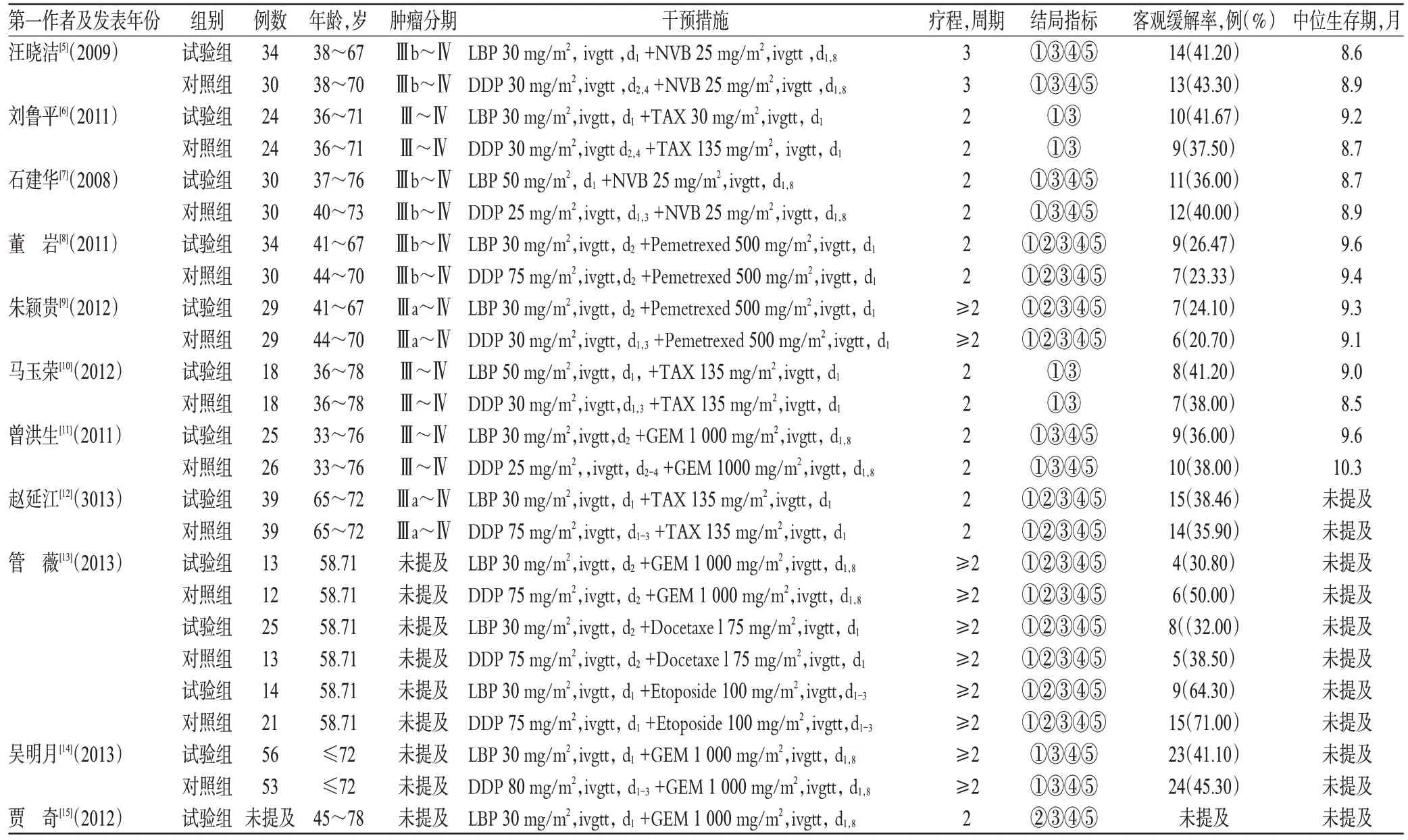
表1 纳入研究基本信息Tab 1 Basic information of included studies
2.2 纳入文献质量评价结果
纳入的11 项RCT 中,均是用随机对照方法,但仅有4项[12-15]注明了利用随机数字表方法,均无失访/退出病例,其余未作描述。纳入研究的质量评价结果见表2。

表2 纳入研究的方法学质量评价结果Tab 2 Methodology quality evaluation of included studies
2.3 Meta分析结果
2.3.1 ORR 10 项研究(653 例患者)报道了ORR[5-14],各研究间无统计学异质性(P=1.00,I2=0),采用固定效应模型分析。详见图1。Meta 分析结果显示,两组患者ORR 比较差异无统计学意义[RR=0.96,95%CI(0.79,1.16),P=0.65]。通过亚组分析可以看出LBP+GEM、NVB、Pemetrexed、TAX、Etoposide、Docetaxel与DDP联合上述药物相比,患者ORR差异都无统计学意义,其P值分别为0.43、0.76、0.67、0.63、0.66、0.34。提示以LBP为主的联合化疗方案与以DDP为主的联合化疗方案治疗晚期NSCLC的疗效相当。
2.3.2 恶心呕吐发生率 11项研究(724例患者)报道了恶心、呕吐发生率[5-15],各研究间无统计学异质性(P=0.87,I2=0),采用固定效应模型分析,详见图2。Meta 分析结果显示,两组患者恶心呕吐发生率比较差异有统计学意义[RR=0.55,95%CI(0.46,0.64),P<0.05],提示以FBP 为主的联合化疗方案与以DDP 为主的联合化疗方案治疗晚期NSCLC 相比恶心呕吐的发生率少。
2.3.3 腹泻发生率 5 项研究(356 例患者)报道了腹泻发生率[8-9、12-13、15],各研究间无统计学异质性(P=0.66,I2=0),采用固定效应模型分析,详见图3。Meta 分析结果显示,两组患者腹泻发生率比较差异有统计学意义[RR=0.43,95%CI(0.31,0.61),P<0.05],提示以LBP为主的联合化疗方案与以DDP为主的联合化疗方案治疗晚期NSCLC相比腹泻发生率少。
2.3.4 白细胞减少发生率[5-15]11项研究(731例患者)报道了白细胞减少发生率,各研究间无统计学异质性(P=0.09,I2=37%),采用固定效应模型分析,详见图4。Meta 结果显示,两组患者白细胞减少发生率比较差异无统计学意义[RR=0.95,95%CI(0.83,1.08),P=0.42],提示以LBP 为主的联合化疗方案与以DDP 为主的联合化疗方案治疗晚期NSCLC 相比白细胞减少发生率相当。
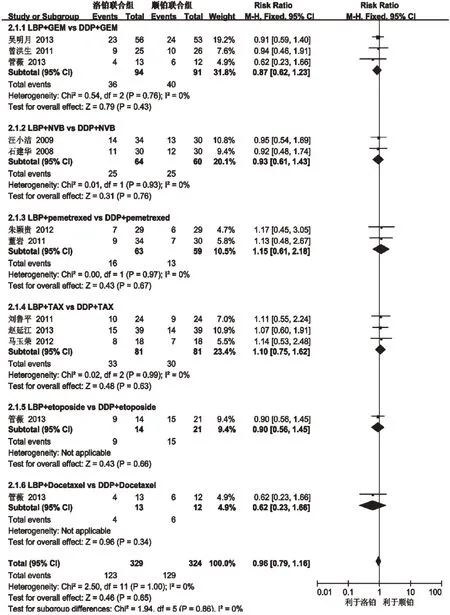
图1 两组患者ORR的Meta分析森林图Fig 1 Forest plot of Meta-analysis of ORR between 2 groups

图2 两组患者恶心呕吐发生率的Meta分析森林图Fig 2 Forest plot of Meta-analysis of the incidence of nausea and vomiting in 2 groups
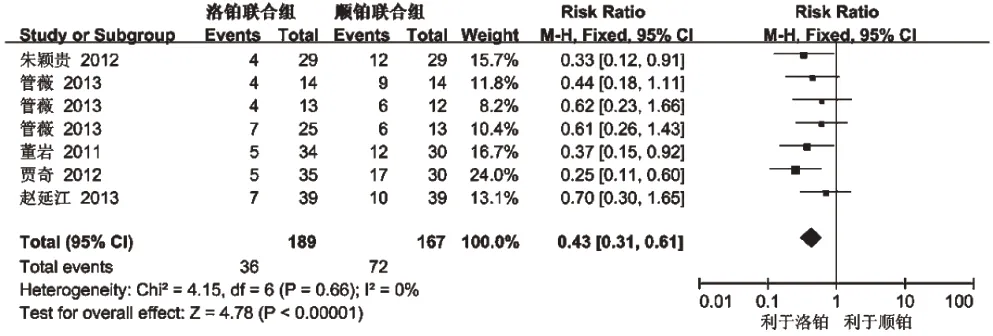
图3 两组患者腹泻发生率的Meta分析森林图Fig 3 Forest plot of Meta-analysis of the incidence of diarrhea in 2 groups
2.3.5 血小板减少发生率 9项研究(650例患者)报道了血小板减少发生率[5,7-9,11-15],各研究间无统计学异质性,(P=0.03,I2=49%),采用固定效应模型分析,详见图5。Meta分析结果显示,两组患者血小板减少发生率差异无统计学意义[RR=0.96.,95%CI(0.80,1.15),P=0.68],提示以LBP为主的联合化疗方案与以DDP 为主的联合化疗方案治疗晚期NSCLC 的血小板发生率相当。
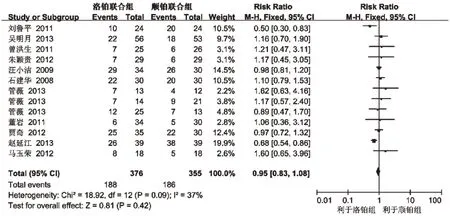
图4 两组患者白细胞减少发生率的Meta分析森林图Fig 4 Forest plot of Meta-analysis of the incidence of leucopenia in 2 groups
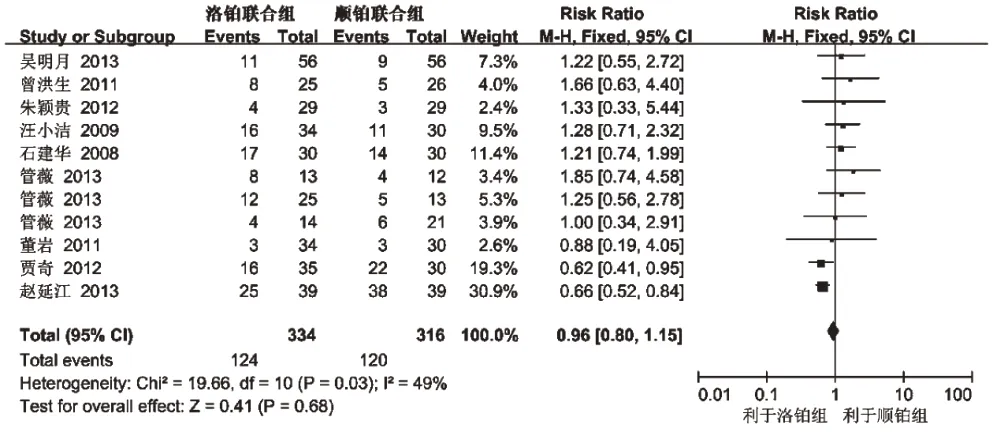
图5 两组患者血小板减少发生率的Meta分析森林图Fig 5 Forest plot of Meta-analysis of the incidence of thrombocytopenia in 2 groups
2.4 文献的发表偏倚情况
对纳入本次Meta分析的11项RCT进行倒漏斗图分析,以效应量RR为横坐标,以SE(log[RR])为纵坐标绘制漏斗图,详见图6、图7、图8、图9、图10。结果显示,左右基本对称,表明各研究的发表偏倚的可能性较小,结果稳健。
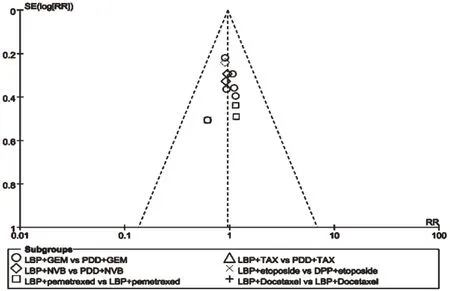
图6 ORR的倒漏斗图Fig 6 Inverted funnel plot of ORR
3 讨论
晚期NSCLC 主要是采取化疗为主的综合治疗方案。现阶段,临床以铂类为基础的化疗方案仍是晚期NSCLC的主要治疗方案。这对于延长患者的生存期和提高患者的生存率具有重要的意义。但是,由于DDP的耳毒性、肾毒性及胃肠道反应等较严重且极易产生耐药,明显限制了其临床应用,特别是对老年及体质较弱的患者,迫切需要新的联合治疗方案应用于临床。

图7 恶心呕吐发生率的倒漏斗图Fig 7 Inverted funnel plot of nausea and vomiting
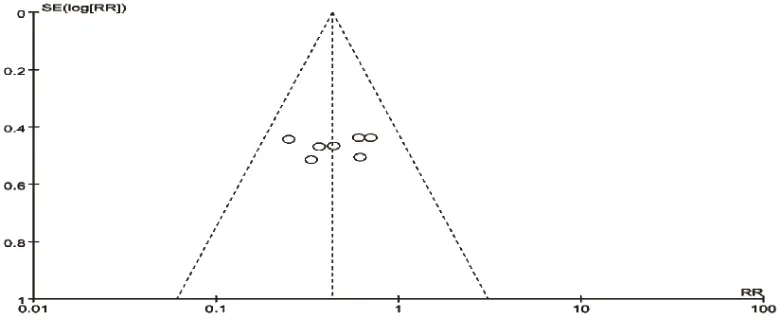
图8 腹泻发生率的倒漏斗图Fig 8 Inverted funnel plot of diarrhea
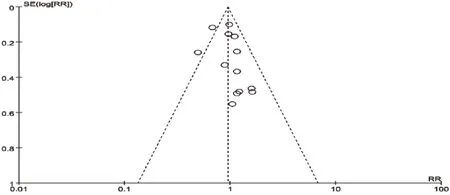
图9 白细胞减少发生率的倒漏斗图Fig 9 Inverted funnel plot of leucopenia
LBP 为第三代新型铂类抗癌药物,除了对晚期乳腺癌、NSCLC 和慢性粒细胞白血有效外,临床已证明其对晚期NSCLC、食道癌、胃肠道恶性肿瘤、恶性胸腔积液和腹腔积液有较强的抗癌活性[16-17],其作用机制与其他铂类相似,通过选择性地抑制肿瘤细胞内DNA合成影响细胞周期,延缓G1期进入S期和G2期进入M期,达到抗肿瘤目的。基础研究已证明,LBP 显示了与DDP 相当的甚至更高的细胞毒作用,且与DDP无交叉耐药,还表现出抗癌活性强、溶解度好、在水中稳定的特点[18]。
本次研究纳入的11 项RCT 在试验期间无失访/退出病例。表1 对LBP 联合组和DDP 联合组的基本特征作了描述,可以看出两组患者的中位生存期比较无明显差异。Meta分析主要针对两组的ORR,恶心呕吐、腹泻等消化道不良反应和白细胞减少、血小板减少等骨髓抑制的不良反应作出比较,结果显示,LBP 联合化疗治疗晚期NSCLC 的ORR 不劣于DDP 联合化疗,表明对DDP 耐药或是用DDP 化疗失败的NSCLC 患者,LBP可以作为一个较好的替代治疗方案。在恶心呕吐、腹泻等消化道不良反应方面,LBP 治疗组的发生率显著低于DDP 治疗组,这与Zhao C 等的报道[19]相符。可能是因为LBP在肿瘤内的药物浓度分布高,而在其他部位的分布浓度低,并且LBP 无明显的肾毒性,具有高度的水溶性,能够在48 h 内使进入机体内的药物自肾脏排出,且对肝脏无明显的影响作用[18]。鉴于LBP 相对于DDP 的这些优势,增加了患者对化疗药物的耐受性,在一定程度上提高患者的生活质量,所以对因消化道反应不能继续化疗或是患有消化道疾病的患者,应选择以LBP为基础的联合化疗方案。LBP最常见的剂量限制性毒性是血小板减少,但本研究结果表明,在血小板减少方面,LBP 联合治疗组的发生率并不高于DDP 联合治疗组。另外,有趣的是目前还没有关于LBP 引起的脱发、肾毒性和神经毒性的报道[20]。因此可认为,LBP 联合化疗方案可用于晚期NSCLC,尤其是对不能耐受DDP或对DDP耐药以及年老体弱的患者。
纳入的11项研究均为RCT,均无隐藏分配方案,且无一采用意向性分析和选择性的报告结果。从Meta分析的各个倒漏斗图来看,所有指标同质性较好,无发表性偏倚,说明本Meta分析结果尚稳定可靠,可为NSCLC临床制订化疗方案提供循证医学依据。本研究纳入的11 篇文献方法学质量相对较低,多数未具体描述随机分组方法和盲法,但考虑到肿瘤化疗具有一定的特殊性,所以随机方法的隐藏和盲法的实施有一定的难度。
综上所述,以LBP为主的联合化疗治疗晚期NSCLC患者的疗效与以DDP 为主的联合化疗方案疗效相当,但安全性优于后者。由于纳入研究的样本量偏小、质量较低,此结论尚需大样本、多中心的RCT进一步验证。
[1]Ettinger DS,Bepler G,Bueno R,et al.Non-sm-all cell lung cancer clinical practice guidelines in oncology[J].J Natl Compr Canc Netw,2006(4):548.
[2]Socinski MA,Morris DE,Masters GA,et al.Chemother apeutic management of stage IV non-small cell lung cancer[J].Chest,2003,123(1):226s.
[3]Yu YF,Chen ZW,Zhou Z,et al.A Cost-effeciveness analysis of docetaxel versus pemetrexed in second-line chemotherapy for stage ⅢBor Ⅳnon-small cell lung cancer in China[J].Chemotherapy,2010,56(6):472.
[4]Jadad AR,moore RA,Caoroll D,et al.Assessing the quality of reports of randomized clinical trials is blingding necessary[J].Controoed Clin Trials,1966,17(1):1.
[5]汪晓洁,寿涛,陈庆,等.洛铂联合长春瑞滨治疗晚期非小细胞肺癌的临床观察[J].中国癌症杂志,2009,19(12):929.
[6]刘鲁平,张玉星.紫杉醇联合洛铂或顺铂治疗晚期非小细胞肺癌48例比较[J].现代肿瘤医学,2011,19(01):78.
[7]石建华.长春瑞滨联合洛铂与联合顺铂治疗晚期非小细胞肺癌的疗效比较[J].现代中西医结合杂志,2008,17(33):5 105.
[8]董岩,李颖,高亚杰.洛铂与顺铂联合培美曲塞一线治疗晚期肺腺癌的临床观察[J].医学与哲学,2011,32(10):27.
[9]朱颖贵,王辉.培美曲塞联合洛铂或顺铂二线治疗晚期肺腺癌临床观察[J].中国社区医师:医学专业,2012,14(322):60.
[10]马玉荣.紫杉醇联合洛铂或顺铂治疗晚期非小细胞肺癌36例比较[J].云南医药,2012,33(6):538.
[11]曾洪生,郭其森,傅玲,等.吉西他滨联合洛铂治疗晚期非小细胞肺癌疗效分析[J].山东医药,2011,51(19):29.
[12]赵延江.紫杉醇加洛铂治疗晚期非小细胞肺癌的疗效及安全性评价[J].中国实用医药,3013,8(13)182.
[13]管薇.洛铂和顺铂分别用于两药联合方案治疗晚期肺癌的对比研究[D].长春:吉林大学,2013.
[14]吴明月.洛铂或顺铂联合吉西他滨治疗晚期非小细胞肺癌的疗效分析[J].中国医师进修杂志,2013,36(17):66.
[15]贾奇.洛铂与顺铂在联合化疗方案中毒副作用的比较[C]//2012 年中医药防治肿瘤学术年会论文集,2012:279.
[16]Wheate NJ,Walker S,Craig GE,et al.The status of platinum anticancer drugs in the clinic and in clinical trials[J].Dalton Trans,2010,39(35):8 113.
[17]Li KW,Li X,Wen TF,et al.The effect of postoperative TACE on prognosis of HCC:an update[J].Hepatogastroenterology,2013,60(122):248.
[18]McKeage MJ.Lobaplatin,a new antitumour platinum drug[J].Exp Opin Invest Drugs,2001,10(1):119.
[19]Zhao C,Wang XJ,Wang S,et al.Lobaplatin Combined Floxuridine/Pirarubicin-based Transcatheter Hepatic Arterial Chemoembolization for Unresectable Primary Hepatocellular Carcinoma[J].Asian Pac J Cancer Prev,2014,15(5):2 057.
[20]Welink J,Boven E,Ver morken JB,et al.Pharmacokinetics and pharmacodynamics of lobaplatin(D-19466)in patients with advanced solid tumors,including patients with impaired renal of liver function[J].Clin Cancer Res,1999,5(9):2 349.
